Indice
-
Inizio
-
1 Biosintesi e secrezione della triiodotironina
-
2 Trasporto di triiodotironina nel sangue
-
3 Metabolismo periferico della triiodotironina
-
4 Captazione cellulare della triiodotironina
-
5 Regolazione della sintesi di triiodotironina
-
6 Meccanismo molecolare di azione
-
7 Effetti biologici intracellulari
-
8 Effetti biologici sistemici
-
9 Note
-
10 Bibliografia
-
11 Voci correlate
-
12 Altri progetti
-
13 Collegamenti esterni
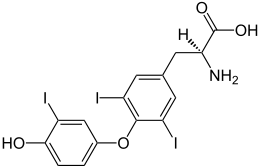
Triiodotironina
| Triiodotironina | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| Acido (2S)-2-ammino-3-[4-(4-idrossi-3-iodofenossil)-3,5-diiodofenil] propanoico {nome sistematico = O-(4-idrossi-3-iodofenil)-3,5-diiodo-L-tirosina} | |
| Abbreviazioni | |
| T3 | |
| Nomi alternativi | |
| Liotironina | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C15H12I3NO4 |
| Massa molecolare (u) | 650,9776 g/mol |
| Numero CAS | |
| Numero EINECS | 229-999-3 |
| PubChem | 5920 e 7048703 |
| DrugBank | DBDB00279 |
| SMILES | C1=CC(=C(C=C1OC2=C(C=C(C=C2I)CC(C(=O)O)N)I)I)O |
| Indicazioni di sicurezza | |
La triiodotironina (T3) è un ormone tiroideo, prodotto dalla ghiandola endocrina tiroide insieme alla tiroxina.
Contiene tre atomi di iodio ed è presente nel flusso sanguigno con una concentrazione di 80/180 ng/dL di sangue. Nei tessuti periferici la tiroxina viene trasformata in triiodotironina.
Biosintesi e secrezione della triiodotironina
[modifica | modifica wikitesto]Il processo di biosintesi della triiodotironina coinvolge i seguenti fenomeni:
- Captazione attiva di ioduro tramite cotrasportatori di membrana della cellula follicolare tiroidea, direzionamento dello ioduro al lato apicale della cellula e trasporto attraverso la membrana apicale in direzione del lume follicolare
- Ossidazione dello ioduro nel lume follicolare
- Iodazione dei residui tirosile della molecola della tireoglobulina, con la formazione di iodotirosine
- Accoppiamento ossidativo di due iodotirosine, producendo iodotironine ancora legate alla tireoglobulina.
La tiroide capta lo ioduro circolante tramite un processo attivo che richiede energia. Questo processo di captazione è realizzato dalla proteina NIS (Sodium Iodide Symporter), che utilizza l'energia elettrochimica del sodio intracellulare.
La proteina NIS trasporta all'interno della cellula ioni sodio (Na+) e iodio (I-) in proporzione 2:1. L'attività della Na+/K+ ATPasi garantisce l'energia elettrochimica necessaria all'ingresso dello ioduro, tramite trasporto attivo di sodio fuori dalla cellula contro il suo gradiente elettrochimico, richiedendo una spesa di ATP. Questo trasporto di ioduro è inibito da ioni come il perclorato, il tiocianato e il pertecnetato.
Una volta dentro la cellula, lo ioduro si diffonde verso il lato apicale fino al lume del follicolo tiroideo, essendo trasportato attraverso la membrana apicale tramite la proteina pendrina (PDS).
Lo ioduro è infine ossidato dalla ioduro perossidasi (TPO), enzima situato sulla membrana apicale, che ha il sito catalitico all'interno del lume follicolare. Il processo di ossidazione ha come donatore di elettroni il perossido di idrogeno (H2O2), generato dall'enzima della membrana apicale DUOX.
Dopo l'ossidazione lo ioduro sarà incorporato ai residui di tirosina della molecola tireoglobulina. Quando un radicale iodio è incorporato alla tirosina, si produce una monoiodotirosina (MIT). Quando due radicali iodio, invece, sono incorporati alla tirosina, si produce una diiodotirosina (DIT).
Anche l'accoppiamento dei residui tirosile della tireoglobulina, che avviene dopo l'organificazione dello ioduro, è catalizzato dalla TPO. Ancora legate alla tireoglobulina, alcune tirosine (MIT e DIT) si accoppiano, producendo iodotironine. L'accoppiamento di una MIT con una DIT produce triiodotironina (T3), oppure rT3 (triiodotironina inversa, che non è biologicamente attiva, dato che uno dei radicali iodio non è legato al carbonio 5 della molecola bensì al carbonio 5'). L'accoppiamento di due DIT produce tetraiodotironina, altro ormone della ghiandola tiroide (T4). Due MIT producono diiodotironina, che, come la rT3 non possiede attività biologica.
Il colloide del lume follicolare, che contiene le iodotironine ancora legate alla tireoglobulina è endocitato dalla cellula follicolare tramite il processo di pinocitosi. Nel citoplasma, dunque, le vescicole di colloide endocitate si fondono a lisosomi con enzimi di attività proteolitica, che idrolizzano la tireoglobulina, rilasciando molecole libere di T4, T3, rT3, diiodotironina, MIT e DIT. Queste ultime tre molecole, visto che non possiedono attività biologica, perdono i loro radicali iodio grazie all'azione dell'enzima DHAL nel citoplasma.
Circa il 10% della T4 prodotta dalla cellula follicolare è convertita a T3 tramite l'attività dell'enzima 5'-deiodasi ancora nel citoplasma.
Le cellule follicolari esprimono a livello della membrana baso-laterale un trasportatore appartenente alla famiglia dei trasportatori di monocarbossilato (MCT). Nel caso dei tireociti questo trasportatore è indicato come MCT8. Dati recenti indicano che MCT8 sia coinvolto nella secrezione degli ormoni tiroidei in circolo.
Trasporto di triiodotironina nel sangue
[modifica | modifica wikitesto]La concentrazione totale di triiodotironina nel sangue è di 2,3 nmol/L. Comunque, una piccola frazione si trova libera nel plasma (fT3), dato che la maggior parte dell'ormone si trova legato a proteine plasmatiche, come la proteina legante di tiroxina (TBG), la transtiretina (TTR), l'albumina e le lipoproteine.
Essendo un equilibrio chimico, espresso dalla formula:
si può definire la costante:
La concentrazione libera di T3 sarà quindi:
Metabolismo periferico della triiodotironina
[modifica | modifica wikitesto]La ghiandola tiroide produce maggiori quantità di tiroxina rispetto a triiodotironina. La triiodotironina è inoltre metabolicamente più attiva. Così, nei tessuti periferici la tiroxina viene trasformata in triiodotironina (80% della triiodotironina viene prodotta dalla tiroxina perifericamente e 20% viene prodotta nella ghiandola tiroide).
La trasformazione di tiroxina a triiodotironina avviene grazie alle deiodasi, enzimi che contengono selenocisteina e che rimuovono il radicale iodio della tiroxina, producendo triiodotironina e triiodotironina inversa (dipende dal radicale rimosso). Anche la triiodotironina può perdere radicali iodio, diventando diiodotironina. Questi meccanismi di produzione di rT3 e T2 sono realizzati dalla deiodasi 3 (D3) e costituiscono un metodo di inattivazione della T3 quando i suoi livelli plasmatici sono troppo alti (in situazioni di ipertiroidismo questo meccanismo non è sufficiente).
Da queste informazioni, si conclude, dunque, che la potenziale attività della triiodotironina si trova non nella T3 plasmatica (che è bassa), ma nella T4 plasmatica, che costituisce un "serbatoio" di T3 grazie alla successiva azione delle deiodasi periferiche.
La mancanza di selenio può diminuire l'attività delle deiodasi. Anche il propiltiouracile inibisce le deiodasi, causando ipotiroidismo.
Captazione cellulare della triiodotironina
[modifica | modifica wikitesto]La captazione cellulare della triiodotironina è realizzata da trasportatori di membrana. Sono due le famiglie di queste trasportatori: "trasportatori di anioni organici" e "trasportatori di aminoacidi".
È di speciale interesse medico la famiglia di trasportatori di aminoacidi che trasporta iodotironine, visto che esse sono costituite da due residui dell'aminoacido tirosina. Il trasportatore di aminoacido responsabile di questa azione è il MCT8 (Monocarboxylate transporter), che trasporta aminoacidi aromatici, come la tirosina.
Nel sistema nervoso, l'azione del MCT8 è di grande importanza per i neuroni perché questo tipo cellulare non ha la deiodasi D2 sulla membrana e la captazione di triiodotironina accade grazie all'azione della D2 degli astrociti. Il MCT8 è, quindi, fondamentale per la captazione neuronale della triiodotironina convertita dall'astrocito. Una mutazione di questo trasportatore causa una sindrome legata al cromosoma X, caratterizzata da un grave ritardo psicomotore e da alti livelli di T3 plasmatica, la sindrome di Allan-Herndon-Dudley[1].
Regolazione della sintesi di triiodotironina
[modifica | modifica wikitesto]Dal TSH
[modifica | modifica wikitesto]L'ormone TSH, prodotto nell'ipofisi è il principale regolatore dell'attività della tiroide. Comunque, anche il TSH è regolato tramite l'ormone ipotalamico TRH (TSH Releasing Hormone), costituendo un meccanismo di retroazione negativa.
Questo meccanismo è spiegato dalla responsività delle cellule dell'ipofisi che producono il TSH alle variazioni di ormoni tiroidei nel sangue. Quando i livelli sono bassi, c'è una sintesi maggiore di recettori di TRH da queste cellule, aumenta la recettività verso il TRH e quindi si produce più TSH. Il contrario succede quando i livelli plasmatici di ormoni tiroidei sono alti.
Come l'espressione del TSH e di recettori del TRH è regolata dai livelli intracellulari di triiodotironina, i livelli plasmatici di tiroxina hanno un effetto più forte su questa regolazione, visto che la tiroxina plasmatica è la risorsa fondamentale di triiodotironina intracellulare (80% del totale), grazie all'azione della deiodasi D2 della cellula ipofisaria. I livelli di tiroxina plasmatica sono, quindi, importantissimi per la clinica.
Il TSH agisce direttamente sulla cellula follicolare della tiroide, promuovendo la sua crescita, proliferazione e la sua attività. I recettori del TSH nella cellula follicolare, tramite la trasduzione del segnale e l'azione della proteina G fanno aumentare i livelli plasmatici di AMP ciclico. I geni del trasportatore NIS e della tireoglobulina hanno siti regolatori mediati dai livelli di AMP ciclico e, quando essi sono elevati, la sintesi di NIS e tireoglobulina è aumentata. Così, il TSH fa aumentare l'attività degli enzimi responsabili per la sintesi degli ormoni tiroidei.
Dai livelli intracellulari di iodio organificato
[modifica | modifica wikitesto]Il meccanismo auto-regolatore della sintesi della triiodotironina è dovuto alla responsività da parte della cellula follicolare ai livelli intracellulari di iodio organificato. Lo iodio organificato intracellulare inibisce l'attività dell'enzima DUOX, che fornisce il perossido di idrogeno all'ossidazione dello ioduro[2]. Diminuisce così la sintesi di iodio organificato. Quando i livelli plasmatici di ioduro sono alti, causano un effetto di diminuzione della sintesi di ormoni tiroidei, l'effetto Wolff-Chaikoff.
L'effetto Wolff-Chaikoff ha una durata di alcuni giorni, dopodiché l'effetto termina quando la sintesi degli ormoni ritorna al normale.
Meccanismo molecolare di azione
[modifica | modifica wikitesto]Genomico
[modifica | modifica wikitesto]L'azione genomica della triiodotironina promuove la modificazione dell'espressione genica della cellula bersaglio. La T3 viene dal sangue o dal metabolismo intracellulare della tiroxina da parte delle desiodasi. Il recettore degli ormoni della tiroide (TR, dall'inglese thyroid-hormone receptor) è nucleare e si accoppia a regioni di regolazione del gene-bersaglio. Queste regioni sono denominate TRE (dall'inglese thyroid-hormone responsive element).
Il recettore TR si lega al DNA del gene-bersaglio come un monomero, omodimero o anche eterodimero. La situazione principale è la formazione dell'eterodimero del TR con il recettore nucleare RXR (dall'inglese Retinoid X Receptor, Recettore X Retinoide). Il TR può ancora formare eterodimeri con altri recettori. Comunque il complesso più stabile e con maggiore affinità per le regioni TRE è il complesso TR-RXR.
La triiodotironina genera diversi segnali cellulari che dipendono dai geni e dai tessuti, regolando tanto l'attivazione come la repressione della trascrizione del mRNA.
Repressione della trascrizione in assenza della triiodotironina
[modifica | modifica wikitesto]Il legame chimico del TR con le regioni TRE del DNA avviene indipendentemente dalla presenza della triiodotironina. Molte proteine di regolazione si legano all'omodimero TR-TR o all'eterodimero TR-RXR, come la proteina HDAC (deacetilasi di istone). Questo complesso repressore promuove la deacetilazione degli istoni, rendendo compatta la cromatina e, così, inibendo l'azione dell'enzima di trascrizione RNA polimerasi.
Repressione della trascrizione in presenza di triiodotironina
[modifica | modifica wikitesto]La presenza della triiodotironina può anche reprimere la trascrizione di alcuni geni. Questo fenomeno è importante nell'ipotalamo e nell'ipofisi per garantire la retroazione negativa che regola la secrezione della triiodotironina: la repressione della trascrizione è fondamentale per diminuire la secrezione di TSH e TRH quando i livelli di ormoni tiroidei solo alti.
Il processo di repressione verificato in questo meccanismo di retroazione è realizzato da parte del recettore TRβ2, che è espresso dalle cellule ipotalamiche e ipofisarie coinvolte nel processo di regolazione dell'attività della tiroide. Il recettore TRβ, quindi, diminuisce la trascrizione quando legato alla triiodotironina[3].
Attivazione della trascrizione in presenza di triiodotironina
[modifica | modifica wikitesto]Quando la triiodotironina si lega al TR (eccetto i tipi di TR coinvolti nella regolazione della sintesi di ormoni tiroidei, TRβ2), attiva la trascrizione di mRNA. Ciò accade perché in presenza di T3 il complesso repressore è inattivato. In questo fenomeno è importante il ruolo di proteine co-attivatorie, essendo le principali le proteine della famiglia TRAP (Thyroid Hormone Receptor-associated Proteins, ossia proteine associate al recettore degli ormoni tiroidei) e della famiglia SRC (steroid receptor co-activator, ossia attivatore del recettore steroideo). Queste ultime aumentano la trascrizione mediate non solo da recettori per steroidi, ma anche da altri recettori, come il TR.
L'interazione fra SRC-1 e le proteine della famiglia di co-attivatori p300-CBP promuove l'acetilazione delle istoni. Questa reazione chimica rende la cromatina accessibile alla RNA polimerasi, favorendo la trascrizione[4].
Problemi nel meccanismo genomico
[modifica | modifica wikitesto]Mutazioni dei recettori TR possono causare resistenza agli ormoni tiroidei. Quando la mutazione è verificata nei recettori espressi da vari tessuti (come il TRα), il quadro è di ipotiroidismo, visto che i recettori TRα non riescono a regolare la trascrizione anche quando si trovano alti livelli di ormoni tiroidei nel sangue (resistenza periferica). Quando la mutazione è verificata nei recettori espressi solo dall'ipotalamo e dall'ipofisi, invece, si ha una situazione di ipertiroidismo, perché i recettori (TRβ2) non sono capaci di inibire la sintesi di TRH e TSH anche quando si trovano alti livelli di ormoni tiroidei nel sangue (resistenza ipofisaria)[5].
Non genomico
[modifica | modifica wikitesto]La triiodotironina ha anche meccanismi di azione non-genomici che, quindi, non coinvolgono la regolazione dell'espressione genica. Questo meccanismo di azione avviene grazie all'interazione fra la triiodotironina e alcune proteine della membrana cellulare e della membrana mitocondriale, che regolano, per esempio, il traffico di ADP e ATP dall'interno del mitocondrio.
Effetti biologici intracellulari
[modifica | modifica wikitesto]Prodotti dall'attività genomica
[modifica | modifica wikitesto]La triiodotironina promuove la trascrizione di diversi enzimi coinvolti nel metabolismo, specialmente il metabolismo respiratorio. Enzimi che hanno un ruolo importante nella catena di trasporto degli elettroni, come la NADPH-citocromo-c2 reduttasi, la citocromo-c ossidasi hanno una sintesi elevata in presenza di ormoni tiroidei e, quindi, incrementano il tasso di respirazione cellulare grazie alla loro aumentata attività.
Altri prodotti dell'attività genomica della triiodotironina sono: la glicerolo-3-fosfato deidrogenasi, l'enzima malica, eritropoietina, proteina-G stimolatoria, ecc.
Aumentano anche i livelli di UCP nel mitocondrio, un forte disaccoppiante della catena respiratoria dalla fosforilazione ossidativa, causando la produzione di calore e non di ATP come risultato della respirazione.
Non genomici
[modifica | modifica wikitesto]Alcuni effetti non genomici sono osservati in presenza di triiodotironina nella cellula. Questi effetti sono causati dall'interazione con proteine che non sono coinvolte nell'espressione genica.
Come risultato, aumenta l'attività di alcune proteine importanti per il metabolismo cellulare, come alcuni trasportatori ionici (specialmente della pompa di sodio-potassio) e della calmodulina. Sono altri effetti: l'aumento della captazione di glucosio e il controllo della captazione di calcio e della rimodellazione dell'actina, alterando il citoscheletro di molte cellule.
Effetti biologici sistemici
[modifica | modifica wikitesto]Nei singoli tessuti
[modifica | modifica wikitesto]Effetti nel tessuto cardiaco
[modifica | modifica wikitesto]Molti degli effetti della triiodotironina, specialmente nel sistema cardiaco, sono simili a quelli prodotti dalle catecolamine. La T3 presenta grande effetto inotropico e cronotropico nel cuore. L'eccesso di T3 aumenta la responsività adrenergica cardiaca. Gli antagonisti dei recettori β-adrenergici invertono alcuni degli effetti cardiaci dell'ipertiroidismo clinico, come la tachicardia, comunque, non riescono a invertire altri effetti dell'ipertiroidismo. La T3 promuove l'aumento dell'espressione della proteina strutturale miosina MHCα, risultando in una maggiore velocità di contrazione cardiaca.
Come effetto generale di questi fenomeni, si osserva una crescita della gittata cardiaca che garantisce un apporto di ossigeno adatto alla maggiore richiesta da parte dei tessuti che si osserva in presenza della triiodotironina. Questa crescita della gittata cardiaca è causata tanto indirettamente dalla triiodotironina (tramite l'aumento dell'azione delle catecolamine), come direttamente (tramite l'aumento dell'espressione della miosina MHCα, una maggiore captazione di calcio da parte del miocito e l'aumento dell'attività dell'adenilato ciclasi, fenomeni che aumentano la forza di contrazione).
Adeguati livelli di ormoni tiroidei sono necessari per una funzionalità cardiaca normale. Nei casi di deficienza di ormoni tiroidei tanto la gittata cardiaca è più bassa come l'efficienza cardiaca, dato che la frazione di eiezione del ventricolo sinistro è più bassa (rapporto fra la quantità di sangue eiettato alla fine della sistole e la quantità totale di sangue che c'era nel ventricolo all'inizio della sistole).
Effetti nel tessuto nervoso
[modifica | modifica wikitesto]Una deficienza di triiodotironina durante lo sviluppo embrionale e durante l'infanzia causa una riduzione della crescita delle cortecce cerebrale e cerebellare, della proliferazione di assoni, della migrazione cellulare, della mielinizzazione, della ramificazione dei dendriti e della genesi di sinapsi. Come risultato, questa deficienza nelle fasi iniziali della vita causano un ritardo dello sviluppo del sistema nervoso seguito da un deficit cognitivo e motore. Questo quadro clinico è denominato cretinismo.
Immagini del cervello realizzati tramite la tomografia a emissione di positroni hanno dimostrato che, quando i livelli di triiodotironina sono ridotti, anche il flusso sanguigno nel cervello e il metabolismo cerebrale di glucosio sono più bassi. Questi dati possono spiegare il deficit psicomotorio degli individui ipotirotici.[6]
L'ormone tiroideo aumenta anche la velocità e l'ampiezza dei riflessi nervosi periferici, la vigilanza e reattività a diversi stimoli, la memoria e la capacità di apprendimento.
Effetti nel tessuto osseo
[modifica | modifica wikitesto]L'ossificazione endocondrale è stimolata dalla triiodotironina, rendendo il tessuto osseo più lungo linearmente tramite la maturazione dei centri ossei epifisari. Anche se non è necessaria per la crescita lineare dell'osso dopo la nascita, la triiodotironina è essenziale per il corretto sviluppo delle ossa del feto.
La triiodotironina partecipa anche alla rimodellazione ossea negli adulti e il suo eccesso può causare osteoporosi.
Effetti nei tessuti della pelle
[modifica | modifica wikitesto]La triiodotironina partecipa anche alla maturazione dell'epidermide e degli annessi cutanei. Anche il processo di degradazione di queste strutture è promosso dalla triiodotironina. Tanto l'eccesso quanto la deficienza di questo ormone, quindi, possono causare problemi dermatologici.
Anche il derma soffre l'influenza della triiodotironina, che inibisce la sintesi e aumenta la degradazione dei glicosaminoglicani, componenti fondamentali della matrice extracellulare dermale.
Effetti nel sangue
[modifica | modifica wikitesto]La triiodotironina aumenta la produzione di eritropoietina e, quindi, aumenta l'emopoiesi. L'ormone aumenta anche i livelli di 2,3-bisfosfoglicerato negli eritrociti, promuovendo la dissociazione dell'ossigeno dall'emoglobina, elevando quindi la disponibilità di ossigeno libero ai tessuti. Questo è un meccanismo di compensazione per la richiesta più elevata di ossigeno promossa dalla triiodotironina.
Effetti nel tessuto adiposo
[modifica | modifica wikitesto]La maturazione dei pre-adipociti ad adipociti è promossa dalla triiodotironina, che esercita diversi effetti riguardanti il metabolismo di lipidi. Tanto la degradazione quanto la sintesi del colesterolo sono promosse dall'ormone. Comunque, come la degradazione soffre un'azione tiroidea maggiore, negli stati di deficienza di triiodotironina i livelli plasmatici di colesterolo (associato alle lipoproteine a bassa densità - LDL) sono più alti. Il metabolismo del colesterolo è aumentato dall'ormone tiroideo anche grazie alla sintesi più elevata di recettori LDL sulla membrana delle cellule. L'ormone aumenta anche la lipolisi degli acidi grassi nel tessuto adiposo.
Nella termogenesi
[modifica | modifica wikitesto]I mammiferi riescono a mantenere la temperatura corporea costante anche se la temperatura esterna soffre variazioni. Questa capacità coinvolge la generazione interna di calore, un processo denominato termogenesi obbligatoria. Negli ambienti di termoneutralità, la termogenesi obbligatoria è sufficiente. Comunque, negli ambienti più freddi, è necessaria l'attivazione di un altro meccanismo, la termogenesi indotta dal freddo, inclusa nella termogenesi facoltativa. La triiodotironina regola entrambi i meccanismi.
L'azione termogenica obbligatoria della triiodotironina avviene grazie all'attivazione dell'espressione delle proteine UCP. Le proteine UCP promuovono il ritorno di protoni attraverso lo spazio intermembranoso della membrana mitocondriale, senza l'attivazione dell'enzima ATP sintetasi e, quindi, senza produrre ATP. Questo flusso di protoni dissipa l'energia potenziale chimica dei protoni sotto la forma di calore. La triiodotironina aumenta anche la lipolisi, elevando la disponibilità di lipidi, fondamentali anch'essi per questo processo di generazione di calore che è denominato disaccoppiamento. Altro meccanismo di generazione di calore nella termogenesi obbligatoria è l'idrolisi dell'ATP da parte delle ATPasi, la cui attività è promossa dalla triiodotironina.
La termogenesi facoltativa è attivata da parte del sistema nervoso simpatico grazie a stimoli esterni, ma subisce un'influenza importante da parte della triiodotironina. Animali che soffrono di deficienza dell'ormone diventano ipotermici negli ambienti freddi poiché una carenza di triiodotironina rende questi animali incapaci di sostenere la risposta noradrenergica per la generazione di calore supplementare (la triiodotironina e le catecolamine hanno effetti sinergici).
Note
[modifica | modifica wikitesto]- ^ https://www.sciencedirect.com/science?_ob=ArticleURL&_udi=B8JDD-4R1VW2C-5&_user=10&_rdoc=1&_fmt=&_orig=search&_sort=d&view=c&_acct=C000050221&_version=1&_urlVersion=0&_userid=10&md5=b4760fa8ff934d0e0a693e5e2e02dd19
- ^ Effect of Iodide on Nicotinamide Adenine Dinucleotide Phosphate Oxidase Activity and Duox2 Protein Expression in Isolated Porcine Thyroid Follicles, su endo.endojournals.org. URL consultato il 28 aprile 2009 (archiviato dall'url originale il 19 novembre 2007).
- ^ http://www.jbc.org/cgi/reprint/M511530200v1.pdf
- ^ http://www.pnas.org/content/96/5/1959.full.pdf
- ^ Rajhanshealthcare.com : RAJHANS HOSPITAL Archiviato il 6 febbraio 2009 in Internet Archive.
- ^ http://jcem.endojournals.org/cgi/reprint/86/8/3864.pdf[collegamento interrotto]
Bibliografia
[modifica | modifica wikitesto]- Laura Gandola. Sistema endocrino, in Invito alla biologia. 5ª ed. Bologna, Zanichelli, 2004. p. 441. ISBN 8808055450.
- Margarida de Mello Aires. Fisiologia. 3ª ed. São Paulo. Guanabara Koogan, 2008. p. 998-1014. ISBN 978-85-277-1368-9
- Berne, RM; Levy, MN; Koeppen, BM; Stanton, BA. Fisiologia. 5ª ed. Rio de Janeiro. Elsevier, 2004 p. 915-937. ISBN 978-85-352-1367-6
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikizionario contiene il lemma di dizionario «triiodotironina»
Wikizionario contiene il lemma di dizionario «triiodotironina» Wikimedia Commons contiene immagini o altri file su triiodotironina
Wikimedia Commons contiene immagini o altri file su triiodotironina
Collegamenti esterni
[modifica | modifica wikitesto]- Malattie della tiroide, su benessere.com. URL consultato il 28 maggio 2007 (archiviato dall'url originale il 20 maggio 2007).
- [1]











![{\displaystyle K={\frac {[TBG.T_{3}]}{[fT_{3}][TBG]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fd039916e2f0d566b06e30b6344a1ead12adb059)
![{\displaystyle fT_{3}={\frac {[TBG.T_{3}]}{[K][TBG]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c84def8b2ee4d540406a5e38e734d120ce528faa)
