| Acido bromoacetico | |
|---|---|
 | |
 | |
| Nomi alternativi | |
| acido monobromoacetico | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C2H3BrO2 |
| Massa molecolare (u) | 138,95 |
| Aspetto | solido giallo chiaro[1] |
| Numero CAS | |
| Numero EINECS | 201-175-8 |
| PubChem | 6227 |
| DrugBank | DBDB02198 |
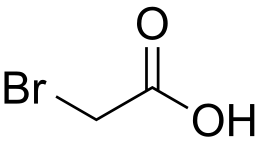
| SMILES | C(C(=O)O)Br |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,93[1] |
| Indice di rifrazione | 1,4804[2] |
| Costante di dissociazione acida (pKa) a 298 K | 2,90[2] |
| Solubilità in acqua | 93,8 g/l a 25 °C[1] |
| Temperatura di fusione | 50 °C (323 K)[1] |
| Temperatura di ebollizione | 208 °C (481 K)[1] |
| Tensione di vapore (Pa) a 298 K | 15,8[1] |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | -383,5 (gas)[2] |
| ΔfG0 (kJ·mol−1) | -338,3 (gas)[2] |
| S0m(J·K−1mol−1) | 337,0 (gas)[2] |
| C0p,m(J·K−1mol−1) | 80,5 (gas)[2] |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | 50 oral rat[1] |
| Indicazioni di sicurezza | |
| Punto di fiamma | 113 °C[1] |
| Simboli di rischio chimico | |
  
| |
| Frasi H | 301+311+331 - 314 - 317 - 400 [1] |
| Consigli P | 273 - 280 - 284 - 303+361+353 - 305+351+338 - 501 [1] |
L'acido bromoacetico o anche acido monobromoacetico è il composto chimico con formula CH2BrCO2H. In condizioni normali è un solido di colore giallo chiaro di odore pungente.[1] È un derivato dell'acido acetico nel quale un atomo di idrogeno del gruppo metile è stato sostituito da un atomo di bromo. L'acido bromoacetico e i suoi esteri vengono utilizzati come materiali di partenza in numerosi processi chimici.[3]
Proprietà fisiche
[modifica | modifica wikitesto]L'acido bromoacetico forma cristalli giallo chiaro facilmente solubili in acqua, etanolo, etere dietilico e altri solventi organici.[2] La soluzione acquosa è fortemente acida, significativamente più acida dell'acido acetico (acido bromoacetico e acetico hanno pKa rispettivamente 2,90 e 4,75). Questa differenza di acidità si osserva normalmente quando si sostituisce un atomo più elettronegativo come il bromo al posto dell'idrogeno. L'anione infatti si forma più facilmente in seguito alla dissociazione perché la carica negativa viene maggiormente delocalizzata (effetto induttivo).[4]
Sintesi
[modifica | modifica wikitesto]L'acido bromoacetico viene preparato in genere dall'acido acetico introducendo un atomo di bromo tramite la alogenazione di Hell-Volhard-Zelinsky; è necessario un catalizzatore tipo PBr3.[3]
Tossicità / Indicazioni di sicurezza
[modifica | modifica wikitesto]Il composto è disponibile in commercio. Il composto è tossico e corrosivo. Non ci sono dati che indichino proprietà cancerogene. Risulta pericoloso per l'ambiente acquatico.
Note
[modifica | modifica wikitesto]Bibliografia
[modifica | modifica wikitesto]- (EN) P. M. Dewick, Essentials of Organic Chemistry, Chichester, Wiley, 2006, ISBN 978-0-470-01665-7.
- GESTIS, Bromoacetic acid, su gestis.dguv.de. URL consultato il 16 marzo 2022. Pagina dell'acido bromoacetico nel data base GESTIS.
- (EN) W. M. Haynes (a cura di), CRC Handbook of Chemistry and Physics, 96ª ed., Boca Raton, CRC Press, 2015, ISBN 978-1-4822-6097-7.
- (EN) D. Yoffe, R. Frim, S. D. Ukeles, M. J. Dagani e altri, Bromine Compounds, in Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, 2013, DOI:10.1002/14356007.a04_405.pub2.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su acido bromoacetico
Wikimedia Commons contiene immagini o altri file su acido bromoacetico









