| Acido 4-idrossicinnamico | |
|---|---|
 | |
| Nome IUPAC | |
| acido (E)-3-(4-idrossifenil)prop-2-enoico | |
| Nomi alternativi | |
| acido trans-p-idrossicinnamico;p-cumarato; acido paracumarico; 4-idrossicinnamato | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C9H8O3 |
| Massa molecolare (u) | 164,16 g/mol |
| Numero CAS | |
| Numero EINECS | 610-511-6 |
| PubChem | 637542 |
| DrugBank | DBDB04066 |
| SMILES | C1=CC(=CC=C1C=CC(=O)O)O |
| Proprietà chimico-fisiche | |
| Solubilità in acqua | 1,02 mg/mL |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
  
| |
| Frasi H | 315 - 317 - 319 - 335 |
| Consigli P | 261 - P260 - P264 - P270 - P271 - P272 - P280 - P301+P310 - P301+P312 - P301+P330+P331 - P302+P352 - P303+P361+P353 - P304+P340 - P305+P351+P338 |
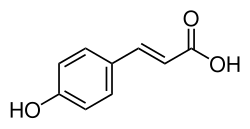
L'acido 4-idrossicinnamico o acido p-cumarico o 4-cumarato, in sigla dall'inglese 4HCA, è un acido fenolico con formula empirica C9H8O3. È il para isomero dell'acido cumarico con la struttura dell'acido cinnamico, in configurazione trans, e un gruppo idrossile sostituente in posizione 4 dell'anello benzenico. Essendo l'isomero dell'acido cumarico più abbondante in natura è spesso indicato impropriamente come acido cumarico. Esiste anche un meno comune stereoisomero cis-4-. L'acido 4-idrossicinnamico esiste in tutte le specie viventi, dai batteri all'uomo; nell'uomo può essere rilevato nel sangue, urina, feci.[1] Per la sua ampia diffusione è nominato con decine di diversi sinonimi compresi: acido naringeninico, acido 3-(4-idrossifenil)acrilico, acido (E)-p-cumarico, ecc..
È un solido cristallino leggermente solubile in acqua, ma ben solubile in etanolo ed etere dietilico.
Occorrenza in natura
[modifica | modifica wikitesto]| Concentrazione (mg/100g)
negli alimenti[2] | |
|---|---|
| Peperoncino | 54,00 |
| Ananas | 53,00 |
| Girasole | 50,55 |
| Curcuma | 34,50 |
| Basilico | 25,33 |
| Timo | 16,05 |
| Spinaci | 13,30 |
| Ossicocco | 13,23 |
| Noce | 12,78 |
| Mirtillo rosso | 9,72 |
| Ravanello | 9,10 |
| Chiodi di garofano | 8,49 |
Presente anche a livello subcellulare nei mitocondri e citoplasma[1], l'acido 4-idrossicinnamico è stato isolato in molte specie di diverse famiglie di piante: Asteraceae (Helianthus tuberosus, Taraxacum formosanum), Brassicaceae ( Wasabia japonica ), Crassulaceae (Rhodiola sachalinensis), Fabaceae ( Medicago sativa, Phaseolus aureus, Pisum sativum ), Labiatae ( Salvia officinalis, Scutellaria albida), Piperaceae (Peperomia duclouxii ), Vittariaceae (Vittaria anguste-elongata).[3]
Il 4HCA è stato isolato in molti funghi: Agaricus Bisporus, Coprinus Comatus, Cordyceps Sinensis, Ganoderma Applanatum, Pleurotus Eryngii, Pleurotus Ostreatus, Sparassis Crispa[4]
In natura il 4HCA si trova più frequentemente legato sotto forma di glicosidi o esteri piuttosto che in forma libera.[5][6]
Ridotto a alcole p-cumarico Insieme all'alcool sinapilico e all'alcool coniferilico, l'acido p-cumarico è un componente importante della lignina.
La presenza in tanti vegetali comporta la presenza anche nelle loro parti o derivati edibili. L'acido 4-idrossicinnamico si trova a concentrazioni significative all'interno di pochi cibi diversi alcuni dei quali riportati nella tabella a fianco.
Si trova anche nell'orzo[7], nel vino e nell'aceto.[8] Può essere trasferito dai pollini al miele.[9] L'acido 4-idrossicinnamico è stato anche rilevato, ma non quantificato, in molti altri alimenti.
Anche l'isomero cis-p-cumarico è stato rilevato in natura, ad esempio a concentrazioni relativamente alte (144 mg/100g) nel coriandolo.[10]
Metabolismo
[modifica | modifica wikitesto]In varie specie viventi, sono state individuate varie reazioni biochimiche di sintesi (anabolismo) e di degradazione (catabolismo) del 4HCA. È inoltre substrato o intermedio in molte reazioni biochimiche che avvengono in natura nella cosiddetta via dei fenilpropanoidi, che porta alla formazione di cumarine, flavonoidi, stilbenoidi, lignani, monolignoli.
| Enzima | Reazione |
|---|---|
| L-tirosina ammonia-liasi[11] | L-tirosina ⇄ 4HCA + ammoniaca |
| 4-cumarato:CoA ligasi[12] | ATP + 4HCA+ CoA ⇄ AMP + difosfato + 4-coumaroil-CoA |
| trans-cinnamato 4-monoossigenasi[13] | trans-cinnamato + [NADPH-emoproteina reduttasi]+ + O2 ⇄ 4HCA+ [NADP+-emoproteina reduttasi] + H2O |
| monofenolo monoossigenasi[14] | 4HCA+ O2 + caffeato ⇄ caffeato + H2O + caffeoquinone |
| idrossicinnamato 4-beta-glucosiltransferasi[15] | UDPG + 4HCA⇄ UDP + 4-O-beta-D-Glucosil-4-idrossicinnamato |
| acido fenilacrilico decarbossilasi[16] | 4HCA⇄ 4-idrossistirene + CO2 |
| 4-cumarato 3-idrossilasi | 4HCA⇄ caffeato[17] |
| idrossicinnamoil glucosiltransferasi[15] | UDPG+ 4HCA⇄ UDP + p-Coumaroil-D-glucosio |
| (E)-4-coumaroil-CoA:(R)-3-(4-idrossifenil)lattato CoA-transferasi[18] | p-Coumaroil-CoA + (R)-3-(4-idrossifenil)lattato ⇄ 4HCA+ (R)-3-(4-idrossifenil)lattoil-CoA |
| 3-(aril)acrilate reduttasi[19] | floretato + flavoproteina (trasferente elettroni)⇄ 4HCA+ flavoproteina (trasferente elettroni) ridotta |

L'acido p- cumarico è il precursore del 4-etilfenolo prodotto dal lievito Brettanomyces nel vino o nella birra. L'enzima fenilacrilato decarbossilasi[16] catalizza la conversione dell'acido p- cumarico in 4-vinilfenolo. Vinil fenolo riduttasi catalizza quindi la riduzione del 4-vinilfenolo a 4-etilfenolo. L'acido cumarico viene talvolta aggiunto ai terreni microbiologici, consentendo l'identificazione positiva di Brettanomyces all'olfatto.
Per saturazione del doppio legame della catena 2-propenoica si forma acido floretico, che si trova nel rumine delle pecore alimentate con erba, mentre per idrossilazione e metossilazione in posizione 3 dell'anello benzenico si formano rispettivamente acido caffeico e ferulico. L'acido caffeico, ferulico, floretico sono precursori di decine di altre reazioni biochimiche. L'isomero cis-p-cumarico prodotto per isomerizzazione trans-cis può essere un intermedio nella ciclizzazione interna da cui derivano le cumarine.
Applicazioni
[modifica | modifica wikitesto]Il 4HCA ha proprietà antiossidanti e può avere un ruolo nel ridurre il rischio di cancro allo stomaco riducendo la formazione di nitrosammine, cancerogene.[20][21]
Note
[modifica | modifica wikitesto]- ^ a b Human Metabolome Database: Showing metabocard for 4-Hydroxycinnamic acid (HMDB0002035), su hmdb.ca. URL consultato il 30 aprile 2021.
- ^ Showing Compound p-Coumaric acid (FDB002593) - FooDB, su foodb.ca. URL consultato il 30 aprile 2021.
- ^ KNApSAcK Metabolite Information - C00000580, su knapsackfamily.com. URL consultato il 30 aprile 2021.
- ^ mVOC 2.0, su bioinformatics.charite.de. URL consultato il 1º maggio 2021 (archiviato dall'url originale il 1º maggio 2021).
- ^ Karl Herrmann e Charles W. Nagel, Occurrence and content of hydroxycinnamic and hydroxybenzoic acid compounds in foods, in Critical Reviews in Food Science and Nutrition, vol. 28, n. 4, 1º gennaio 1989, pp. 315–347, DOI:10.1080/10408398909527504. URL consultato il 1º maggio 2021.
- ^ (EN) Naturally Occurring Hydroxycinnamic Acids, su encyclopedia.pub. URL consultato il 30 aprile 2021.
- ^ (EN) Zory Quinde-Axtell e Byung-Kee Baik, Phenolic Compounds of Barley Grain and Their Implication in Food Product Discoloration, in Journal of Agricultural and Food Chemistry, vol. 54, n. 26, 2006-12-XX, pp. 9978–9984, DOI:10.1021/jf060974w. URL consultato il 4 maggio 2021.
- ^ (EN) Miguel Carrero Gálvez, Carmelo García Barroso e Juan Antonio Pérez-Bustamante, Analysis of polyphenolic compounds of different vinegar samples, in Zeitschrift für Lebensmittel-Untersuchung und Forschung, vol. 199, n. 1, 1º luglio 1994, pp. 29–31, DOI:10.1007/BF01192948. URL consultato il 30 aprile 2021.
- ^ Wenfu Mao, Mary A. Schuler e May R. Berenbaum, Honey constituents up-regulate detoxification and immunity genes in the western honey bee Apis mellifera, in Proceedings of the National Academy of Sciences of the United States of America, vol. 110, n. 22, 28 maggio 2013, pp. 8842–8846, DOI:10.1073/pnas.1303884110. URL consultato il 4 maggio 2021.
- ^ Dr. Duke's Phytochemical and Ethnobotanical Databases at NAL, su phytochem.nal.usda.gov. URL consultato il 5 maggio 2021 (archiviato dall'url originale il 6 maggio 2021).
- ^ KEGG ENZYME: 4.3.1.23, su genome.jp. URL consultato il 4 maggio 2021.
- ^ KEGG ENZYME: 6.2.1.12, su genome.jp. URL consultato il 4 maggio 2021.
- ^ KEGG ENZYME: 1.14.14.91, su genome.jp. URL consultato il 4 maggio 2021.
- ^ KEGG ENZYME: 1.14.18.1, su genome.jp. URL consultato il 4 maggio 2021.
- ^ a b KEGG ENZYME: 2.4.1.126, su genome.jp. URL consultato il 4 maggio 2021.
- ^ a b KEGG ENZYME: 4.1.1.102, su genome.jp. URL consultato il 6 maggio 2021.
- ^ KEGG REACTION: R07826, su genome.jp. URL consultato il 4 maggio 2021.
- ^ KEGG ENZYME: 2.8.3.17, su genome.jp. URL consultato il 4 maggio 2021.
- ^ KEGG ENZYME: 1.3.8.15, su genome.jp. URL consultato il 4 maggio 2021.
- ^ (EN) Lynnette R. Ferguson, Shuo-tun Zhu e Philip J. Harris, Antioxidant and antigenotoxic effects of plant cell wall hydroxycinnamic acids in cultured HT-29 cells, in Molecular Nutrition & Food Research, vol. 49, n. 6, 2005-06-XX, pp. 585–593, DOI:10.1002/mnfr.200500014. URL consultato il 6 maggio 2021.
- ^ (EN) Kiyomi Kikugawa, Tomoko Hakamada e Makiko Hasunuma, Reaction of p-hydroxycinnamic acid derivatives with nitrite and its relevance to nitrosamine formation, in Journal of Agricultural and Food Chemistry, vol. 31, n. 4, 1983-07-XX, pp. 780–785, DOI:10.1021/jf00118a025. URL consultato il 6 maggio 2021.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su acido 4-idrossicinnamico
Wikimedia Commons contiene immagini o altri file su acido 4-idrossicinnamico









