| Iodometano | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| iodometano | |
| Nomi alternativi | |
| ioduro di metile | |
| Caratteristiche generali | |
| Formula bruta o molecolare | CH3I |
| Massa molecolare (u) | 141,94 |
| Aspetto | liquido incolore dall'odore acre |
| Numero CAS | |
| Numero EINECS | 200-819-5 |
| PubChem | 6328 |
| SMILES | CI |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 2,28 |
| Indice di rifrazione | 1,531 |
| Solubilità in acqua | 14 g/L (20 °C) |
| Coefficiente di ripartizione 1-ottanolo/acqua | 1,51 |
| Temperatura di fusione | −66,5 °C (206,65 K) |
| Temperatura di ebollizione | 42,5 °C (315,65 K) |
| Tensione di vapore (Pa) a 293,15 K | 50.000 |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | 76 (orale, ratto) |
| Indicazioni di sicurezza | |
| Punto di fiamma | −28 °C (245,15 K) |
| Temperatura di autoignizione | 355 °C |
| Simboli di rischio chimico | |
 
| |
| pericolo | |
| Frasi H | 301 - 312 - 315 - 331 - 335 - 351 |
| Consigli P | 261 - 280 - 301+310 - 311 [1] |
Lo iodometano, o ioduro di metile,[2] comunemente scritto in chimica in forma simbolica come MeI,[3][4] è un alogenuro alchilico avente formula molecolare CH3−I. Può essere considerato come ottenuto dal metano (CH3−H) per sostituzione di un atomo di idrogeno con un atomo di iodio, oppure dall'acido iodidrico (H−I) per sostituzione di un atomo di idrogeno con un metile (CH3−). In chimica è uno dei più semplici reagenti metilanti di uso generale.[5]
Proprietà
[modifica | modifica wikitesto]Lo ioduro di metile, a differenza degli altri tre alogenuri di metile (MeF, MeCl, MeBr) che a temperatura ambiente sono gassosi, si presenta come un liquido incolore molto volatile, denso, dall'odore etereo pungente, poco solubile in acqua (≈ 14 g/L, o ≈ 0,1 mol/L), ma miscibile nella maggior parte dei solventi organici;[6] in alcool ed etere è solubile in ogni proporzione.[7] Esposto all'aria e alla luce tende a imbrunire.[6] Il liquido ha una costante dielettrica modesta, εr = 7,0, ma in linea con quelle degli altri ioduri alchilici, ed è fotosensibile.[7]
In natura viene emesso in piccole quantità dalle piantagioni di riso.[8] Viene utilizzato nella sintesi organica come agente metilante e ne viene proposto l'utilizzo in agricoltura come agente fumigante in sostituzione del bromometano,[9] bandito dal protocollo di Montréal.
Sintesi
[modifica | modifica wikitesto]Lo iodometano viene sintetizzato facendo reagire il metanolo con triioduro di fosforo, ottenuto in situ utilizzando iodio e fosforo rosso:[10]
Un metodo di sintesi alternativo sfrutta la reazione tra dimetilsolfato e ioduro di potassio in presenza di carbonato di calcio:[10]
Lo iodometano può essere purificato tramite distillazione e successivo lavaggio con tiosolfato di sodio per rimuovere le tracce di iodio.
Un altro metodo di sintesi utilizza metanolo e ioduro di potassio in presenza di acido solforico:
La reazione viene condotta a bassa temperatura e l'acqua prodotta viene assorbita dall'eccesso di acido solforico, spostando in questo modo l'equilibrio verso destra. Lo iodometano ottenuto può essere distillato dalla miscela di reazione.
Reazioni
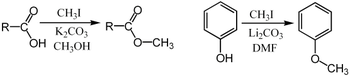
[modifica | modifica wikitesto]Lo iodometano è un eccellente substrato per le reazioni SN2, stericamente poco impedito e con lo iodio che costituisce un buon gruppo uscente in quanto lo ioduro è una base debolissima e molto polarizzabile. Viene utilizzato per metilare nucleofili contenenti atomi di carbonio, ossigeno, zolfo, azoto e fosforo.[11] Per esempio può essere utilizzato per la metilazione di fenoli e acidi carbossilici:[12]
Un altro esempio è rappresentato dalla metilazione dell'ammoniaca e delle ammine, con formazione di metilammine (ioduri di metilammonio come intermedi) e ioduri di ammonio quaternario (ioduro di tetrametilammonio):

Lo iodometano può essere utilizzato come precursore del reattivo di Grignard CH3MgI.
Nel processo Monsanto, lo ioduro di metile si forma in situ per reazione tra metanolo e acido iodidrico. Successivamente CH3I reagisce con il monossido di carbonio in presenza di un complesso del rodio formando CH3COI (ioduro di acetile), che dopo idrolisi produce acido acetico.
Sicurezza
[modifica | modifica wikitesto]Tossicità ed effetti biologici
[modifica | modifica wikitesto]Lo iodometano presenta una tossicità acuta da moderata ad alta per inalazione e ingestione.[13] Il Centers for Disease Control and Prevention (CDC) elenca l'inalazione, l'assorbimento cutaneo, l'ingestione e il contatto con gli occhi come possibili vie di esposizione con gli organi bersaglio degli occhi, della pelle, del sistema respiratorio e del sistema nervoso centrale. I sintomi possono includere irritazione agli occhi, nausea, vomito, vertigini, atassia, linguaggio confuso e dermatite.[14] Nella tossicità acuta ad alte dosi, come può verificarsi in incidenti sul lavoro, la tossicità include disturbi metabolici, insufficienza renale, trombosi venosa e arteriosa ed encefalopatia con convulsioni e coma, con un pattern caratteristico di danno cerebrale.[15]
Lo iodometano ha una LD50 per la somministrazione orale ai ratti di 76 mg/kg e nel fegato subisce una rapida conversione in S-metilglutatione.[16] È classificato come potenzialmente cancerogeno da varie agenzie attive nell'ambito medico e ambientale. Lo IARC lo pone all'interno della categoria 3 (classificazione impossibile riguardo all'azione cancerogena per l'uomo).
La sua tossicità deriva dalla sua potente azione metilante: gli enzimi contenenti gruppi solfidrili -SH risentono particolarmente dell'effetto di questo tipo di sostanze, e vengono inibiti. A risentirne in particolare è il sistema nervoso centrale, dove la mancanza di questi enzimi provoca danni gravi.
Note
[modifica | modifica wikitesto]- ^ Sigma Aldrich; rev. del 13.05.2014
- ^ Michael Smith e Jerry March, March's advanced organic chemistry: reactions, mechanisms, and structure, Eighth edition, John Wiley, 2020, p. 124, ISBN 978-1-119-37179-3.
- ^ Me è il simbolo del metile, CH3–.
- ^ Michael Smith e Jerry March, March's advanced organic chemistry: reactions, mechanisms, and structure, Eighth edition, John Wiley, 2020, p. 358, ISBN 978-1-119-37179-3.
- ^ (EN) Roger W. Alder, Justin G. E. Phillips e Lijun Huang, Methyl Trifluoromethanesulfonate, John Wiley & Sons, Ltd, 15 ottobre 2005, DOI:10.1002/047084289x.rm266m, ISBN 978-0-471-93623-7. URL consultato il 12 ottobre 2024.
- ^ a b (EN) PubChem, Iodomethane, su pubchem.ncbi.nlm.nih.gov. URL consultato il 12 ottobre 2024.
- ^ a b (EN) Iodomethane CAS#: 74-88-4, su chemicalbook.com. URL consultato il 12 ottobre 2024.
- ^ (EN) K.R. Redeker, N.Y. Wang, J.C. Low, A. McMillan, S.C. Tyler e R.J. Cicerone, Emissions of Methyl Halides and Methane from Rice Paddies, in Science, vol. 290, n. 5493, 2000, pp. 966–969, DOI:10.1126/science.290.5493.966.
- ^ (EN) Marla Cone, EPA OKs use of toxic pesticide on fields, in Los Angeles Times, 6 ottobre 2007. URL consultato il 4 marzo 2011.
- ^ a b (EN) King, C.S. e Hartman, W.W., Methyl Iodide, in Org. Synth., vol. 2, 5 giugno 2011, p. 399.
- ^ (EN) Sulikowski, Gary A., Sulikowski, Michelle M., Haukaas, Michael H. e Moon, Bongjin, Iodomethane, 15 ottobre 2005, DOI:10.1002/047084289X.ri029m.pub2.
- ^ (EN) Avila-Zárraga, J.G. e Martínez, R., Efficient methylation of carboxylic acids with potassium hydroxide/methyl sulfoxide and iodomethane, in Synthetic Communications, vol. 31, n. 14, gennaio 2001, pp. 2177–2183, DOI:10.1081/SCC-100104469.
- ^ (EN) Mingxin Guo e Suduan Gao, Degradation of Methyl Iodide in Soil: Effects of Environmental Factors (PDF), in Journal of Environmental Quality, vol. 38, n. 2, 2009, pp. 513-519, DOI:10.2134/jeq2008.0124. URL consultato il 7 gennaio 2022 (archiviato dall'url originale il 14 agosto 2011).
- ^ (EN) CDC - NIOSH Pocket Guide to Chemical Hazards - Methyl iodide, su cdc.gov.
- ^ (EN) Ivan Iniesta, Mark Radon e Colin Pinder, Methyl iodide rhombencephalopathy: clinico-radiological features of a preventable, potentially fatal industrial accident, in Practical Neurology, vol. 13, n. 6, 2013, pp. 393–395, DOI:10.1136/practneurol-2013-000565.
- ^ (EN) Johnson, M.K., Metabolism of iodomethane in the rat, in Biochem. J., vol. 98, n. 1, gennaio 1966, pp. 38–43, DOI:10.1042/bj0980038.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su iodometano
Wikimedia Commons contiene immagini o altri file su iodometano
| Controllo di autorità | LCCN (EN) sh2011000498 · GND (DE) 4298750-7 · J9U (EN, HE) 987007590603505171 |
|---|