Indice
Aloperidolo
| Aloperidolo | |
|---|---|
 | |
 | |
| Nome IUPAC | |
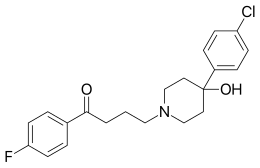
| 4-[4-(4-clorofenil)-4 idrossipiperidin-1-il]-1-(4-fluorofenil)-butan-1-one | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C21H23ClFNO2 |
| Massa molecolare (u) | 375,9 g/mol |
| Numero CAS | |
| Numero EINECS | 200-155-6 |
| Codice ATC | N05 |
| PubChem | 3559 |
| DrugBank | DBDB00502 |
| SMILES | C1CN(CCC1(C2=CC=C(C=C2)Cl)O)CCCC(=O)C3=CC=C(C=C3)F |
| Dati farmacologici | |
| Categoria farmacoterapeutica | Neurolettico |
| Dati farmacocinetici | |
| Biodisponibilità | 60 - 70% |
| Metabolismo | epatico |
| Emivita | 12 - 36 ore |
| Escrezione | Biliare e renale |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 
| |
| pericolo | |
| Frasi H | 301 - 315 - 317 - 319 - 335 - 361 |
| Consigli P | 261 - 280 - 281 - 301+310 - 305+351+338 [1] |
L'aloperidolo è un farmaco antipsicotico di prima generazione (tipico) ad alta potenza ed è uno dei farmaci antipsicotici più utilizzati in tutto il mondo[2] ed è il capostipite della famiglia dei butirrofenoni, i più diffusi antipsicotici tipici. È dotato di effetto antidelirante, sedativo e antiemetico. È il farmaco antidelirante e antiallucinatorio per eccellenza. È venduto con i nomi commerciali di Serenase, Haldol, Bioperidolo, Brotopon, Dozic, Duraperidol.
Storia
[modifica | modifica wikitesto]È stato scoperto in Belgio nel 1958 da Paul Janssen (medico e ricercatore farmaceutico) durante alcune ricerche sugli antidolorifici derivanti dall'oppio. Usato nei pazienti psichiatrici per trattare l'agitazione psicomotoria, si rivelò un potente antipsicotico a dosi di molto inferiori a quelle della clorpromazina, e divenne uno dei farmaci più utilizzati in psichiatria.
Farmacologia
[modifica | modifica wikitesto]Sebbene l'aloperidolo abbia dimostrato attività farmacologica su diversi recettori nel cervello,[3] esercita il suo effetto antipsicotico attraverso una forte antagonizzazione del recettore della dopamina (principalmente D2), in particolare nei sistemi mesolimbico e mesocorticale del cervello. L'aloperidolo è indicato per il trattamento delle manifestazioni di diversi disturbi psicotici, inclusa la schizofrenia, la psicosi acuta, la sindrome di Tourette e altri gravi stati comportamentali.[4] Viene anche utilizzato off-label per il trattamento della corea associata alla malattia di Huntington e per il trattamento dei singhiozzi intrattabili in quanto è un potente antiemetico. Farmaci che antagonizzano la dopamina come l'aloperidolo sono ritenuti migliorare i sintomi psicotici e gli stati causati da una produzione eccessiva di dopamina, come la schizofrenia, che si ipotizza sia causata da uno stato iperdopaminergico nel sistema limbico del cervello.[5]
Indicazioni
[modifica | modifica wikitesto]L'uso degli antipsicotici di prima generazione (come l'aloperidolo) è considerato molto efficace per la gestione dei sintomi "positivi" della schizofrenia, tra cui allucinazioni, udire voci, aggressività/ostilità, disturbi del linguaggio disorganizzato e agitazione psicomotoria. Tuttavia, questa classe di farmaci è limitata dallo sviluppo di disturbi del movimento causati dal blocco della dopamina, come il parkinsonismo indotto da farmaci, l'acatisia, la distonia, la discinesia tardiva, nonché da altri effetti collaterali come sedazione, aumento di peso e modifiche della prolattina. Sebbene ci siano studi di alta qualità limitati che confrontano l'aloperidolo con antipsicotici di prima generazione a potenza inferiore come clorpromazina, zuclopentixolo, flufenazina e metotrimeprazina, l'aloperidolo di solito mostra il minor numero di effetti collaterali in questa classe, ma mostra una maggiore propensione a causare sintomi extrapiramidali (EPS).[6][3][7] Questi altri antipsicotici a bassa potenza sono limitati dalla loro minore affinità per i recettori della dopamina, il che richiede un dosaggio più elevato per trattare efficacemente i sintomi della schizofrenia. Inoltre, bloccano molti recettori diversi dal bersaglio primario (recettori della dopamina), come recettori colinergici o istaminergici, con conseguente maggiore incidenza di effetti collaterali come sedazione, aumento di peso e ipotensione.[4]
Meccanismo d'azione
[modifica | modifica wikitesto]L'ottimale efficacia clinica degli antipsicotici, come l'aloperidolo, è associata al raggiungimento di un blocco dei recettori D2 cerebrali compreso tra il 60% e l'80%.[5]
Sebbene il meccanismo preciso non sia completamente compreso, si è constatato che l'aloperidolo inibisce gli effetti della dopamina e ne aumenta la conversione. Rispetto alla dopamina stessa, gli antipsicotici tradizionali, come il l'aloperidolo, si legano in maniera più stabile al recettore della dopamina D2, con una dissociazione inferiore. Si ritiene che ci sia un blocco competitivo dei recettori post-sinaptici della dopamina (D2) nel cervello, interrompendo la trasmissione dopaminergica e portando al sollievo dei sintomi allucinatori e delle delusioni tipiche della psicosi. Il farmaco agisce principalmente sui recettori D2, ma ha anche un certo effetto sui recettori 5-HT2 e α1, con effetti trascurabili sui recettori della dopamina D1. Inoltre, il farmaco blocca anche i recettori α-adrenergici del sistema autonomo.[8][4]
L'attività antagonistica dei recettori della dopamina D2 nella zona trigger chemorecettiva (CTZ) del cervello conferisce al farmaco la sua azione antiemetica. Tra i tre recettori D2-like, soltanto il recettore D2 viene bloccato dai farmaci antipsicotici in relazione alla loro efficacia clinica.
Le evidenze cliniche ottenute tramite imaging cerebrale indicano che l'aloperidolo rimane fortemente legato ai recettori della dopamina D2 negli esseri umani sottoposti a due scansioni PET separate da 24 ore. Un effetto collaterale comune di questo farmaco è lo sviluppo di sintomi extrapiramidali (EPS), dovuto all'alto grado di affinità tra esso e il recettore della dopamina D2.[8]
A causa del rischio di sintomi extrapiramidali indesiderati e talvolta persistenti, sono stati scoperti e sviluppati farmaci antipsicotici più recenti. L'ipotesi di una rapida dissociazione dei farmaci dai recettori della dopamina D2 offre una spiegazione plausibile per il miglior profilo degli EPS negli antipsicotici atipici come il risperidone. Ciò è anche coerente con la teoria di una minore affinità dei recettori D2 per tali farmaci. Come precedentemente menzionato, l'aloperidolo si lega con maggiore affinità al recettore della dopamina, aumentando il rischio di sintomi extrapiramidali, pertanto dovrebbe essere utilizzato solo quando strettamente necessario.[8]
Farmacocinetica
[modifica | modifica wikitesto]L'aloperidolo è un composto altamente lipofilo e viene ampiamente metabolizzato nell'organismo umano, il che può causare una grande variabilità interindividuale nella sua farmacocinetica.[9]
Studi hanno riscontrato una vasta variazione nei valori farmacocinetici dell'aloperidolo somministrato per via orale, con un tempo di raggiungimento della concentrazione plasmatica massima (tmax) riportato tra 1,7 e 6,1 ore, una emivita (t1⁄2) tra 14,5 e 36,7 ore e un'area sotto la curva (AUC) di 43,73 µg/L•h [intervallo 14,89-120,96 µg/L•h]. L'aloperidolo viene maggiormente assorbito dal tratto gastrointestinale quando assunto per via orale, tuttavia, il suo assorbimento sistemico di primo passaggio riduce la biodisponibilità orale al 40-75%.[9]
Dopo somministrazione intramuscolare, il tempo per raggiungere la concentrazione plasmatica massima (tmax) è di 20 minuti nei soggetti sani o 33,8 minuti nei pazienti affetti da schizofrenia, con una emivita media di 20,7 ore. La biodisponibilità dopo somministrazione intramuscolare è maggiore rispetto a quella orale.[9]
L'uso di aloperidolo decanoato (la formulazione per il trattamento a lungo termine) in olio di sesamo porta al rilascio graduale del farmaco con effetti prolungati. Le concentrazioni plasmatiche di aloperidolo aumentano gradualmente, raggiungendo il picco dopo circa 6 giorni dall'iniezione, con un'emivita apparente di circa 21 giorni. Le concentrazioni plasmatiche allo stato stazionario vengono raggiunte dopo la terza o quarta dose.[4]
Metabolismo
[modifica | modifica wikitesto]L'aloperidolo subisce un ampio processo di metabolizzazione nel fegato, con una quantità di soli circa l'1% della dose somministrata che viene escreta inalterata tramite l'urina.[9]
Nell'uomo, si verificano diverse trasformazioni biotransformative dell'aloperidolo, che danno luogo a vari metaboliti, tra cui l'acido p-fluorobenzoilpropionico, la 4-(4-clorofenil)-4-idrossipiperidina, l'aloperidolo ridotto, i metaboliti piridinici e l'aloperidolo glucuronide. Nei pazienti psichiatrici trattati regolarmente con aloperidolo, la concentrazione più elevata di metaboliti nel plasma è rappresentata dall'aloperidolo glucuronide, seguito, in ordine decrescente, dall'aloperidolo invariato, dall'aloperidolo ridotto e dall'aloperidolo glucuronide ridotto.[4]
Si ritiene che il farmaco venga principalmente metabolizzato attraverso il processo di N-dealchilazione ossidativa dell'azoto piperidinico, che dà origine ad acidi fluorofenilcarbonici e metaboliti piperidinici (che sembrano non avere attività farmacologica). Inoltre, si verifica una riduzione del gruppo carbonilico butirofenone a carbinolo, che porta alla formazione dell'idrossialoperidolo.[4]
Gli enzimi coinvolti nella biotrasformazione dell'aloperidolo includono il citocromo P450 (CYP), in particolare il CYP3A4 e il CYP2D6, nonché la carbonyl reduttasi e gli enzimi uridina di-fosfoglucosio glucuronosiltransferasi. La maggior parte della clearance epatica intrinseca dell'aloperidolo avviene tramite la glucuronidazione, seguita dalla riduzione dell'aloperidolo a forma ridotta e dall'ossidazione mediata dal CYP.[4]
Gli studi in vitro sulla disposizione mediata dal citocromo hanno dimostrato che il CYP3A4 sembra essere l'isoforma predominante dell'enzima responsabile della metabolizzazione dell'aloperidolo negli esseri umani. La velocità di eliminazione intrinseca dell'ossidazione inversa dell'aloperidolo ridotto al composto madre, dell'N-dealchilazione ossidativa e della formazione del piridinio è simile. Ciò suggerisce che lo stesso sistema enzimatico sia coinvolto in queste tre reazioni metaboliche.[4]
Gli studi sul metabolismo dell'aloperidolo condotti sugli esseri umani hanno evidenziato che la glucuronidazione dell'aloperidolo contribuisce al 50-60% della sua biotrasformazione, mentre circa il 23% è attribuibile alla via di riduzione. Il restante 20-30% del metabolismo dell'aloperidolo avviene attraverso l'N-dealchilazione e la formazione del piridinio.[9]
Eliminazione
[modifica | modifica wikitesto]Negli studi effettuati tramite tecnica di radiomarcatura, circa il 30% del valore di radioattività viene rilevato escreto nelle urine dopo una singola somministrazione orale di aloperidolo marcato con isotopo carbonio-14, mentre l'18% viene escreto nelle urine come glucuronide di aloperidolo, dimostrando che il glucuronide di aloperidolo è un importante metabolita presente nelle urine e nel plasma.[9]
Clearance
[modifica | modifica wikitesto]Dopo l'amministrazione intravenosa, è stato osservato che la clearance plasmatica o sierica dell'aloperidolo varia tra 0,39 e 0,708 L/h/kg (equivalente a 6,5-11,8 ml/min/kg). Nel caso della somministrazione per via orale, la clearance è stata misurata a 141,65 L/h (con un intervallo compreso tra 41,34 e 335,80 L/h).[9]
La clearance dell'aloperidolo dopo somministrazione extravascolare si situa nell'intervallo compreso tra 0,9 e 1,5 L/h/kg, ma è importante notare che questa velocità può essere ridotta nei soggetti con una bassa attività dell'enzima CYP2D6. Tale ridotta attività del CYP2D6 può comportare un aumento delle concentrazioni di aloperidolo nel corpo. È stato stimato che la variabilità intersoggettiva (espressa come coefficiente di variazione percentuale) nella clearance dell'aloperidolo è del 44%, basandosi su un'analisi farmacocinetica su una popolazione di pazienti affetti da schizofrenia.[10]
Da evidenze scientifiche, risulta che i polimorfismi genetici del CYP2D6 rappresentano un fattore rilevante nella variabilità interindividuale della farmacocinetica dell'aloperidolo, il quale potrebbe influenzare sia la risposta terapeutica che l'incidenza degli effetti avversi.[9]
Effetti collaterali
[modifica | modifica wikitesto]I principali effetti collaterali sono:
- sintomi Parkinson-simili (denominati disturbi extrapiramidali) per lo più durante la fase iniziale della terapia e generalmente reversibili: rigidità muscolare, povertà di movimenti e tremori
- discinesie motorie tardive, persistenti nel tempo, consistenti in movimenti ritmici involontari della lingua, della faccia, della bocca o della mandibola (protrusione della lingua, gonfiamento delle guance, masticazione) a volte anche delle estremità: questi effetti si verificano spesso negli anziani trattati per lungo tempo e non esiste una terapia specifica risolutiva (sono considerati irreversibili).
- altri effetti indesiderati sul sistema nervoso (irrequietezza, sonnolenza, confusione), sul sistema cardiocircolatorio (tachicardia, ipotensione), effetti ematologici (riduzione del numero delle cellule ematiche), effetti sul fegato, sulla pelle, disordini endocrini e disturbi neurovegetativi (secchezza della bocca, ipersalivazione, turbe visive e altri).
- diarrea.
Come altri farmaci antipsicotici anche l'aloperidolo potrebbe provocare raramente la sindrome neurolettica maligna (SNM), un gruppo di sintomi potenzialmente mortale caratterizzato da febbre elevata, rigidità muscolare, acinesia, elevati livelli di creatinfosfochinasi (CPK) sierica, disturbi neurovegetativi (irregolarità del polso e della pressione arteriosa, sudorazione, tachicardia, aritmie), alterazioni dello stato di coscienza che possono progredire fino al coma. Può provocare anche glaucoma ad angolo chiuso.
In uno studio sui macachi, a cui è stato somministrato aloperidolo e olanzapina, è stata riportata una riduzione del volume cerebrale con la perdita parziale delle funzioni cognitive, con sintomi vicini a quelli della demenza.[11][12] La risonanza magnetica nucleare permette di visualizzare concretamente i cambiamenti irreversibili nel cervello dovuti all'assunzione di neurolettici, in particolare l'aloperidolo.[13]
Note
[modifica | modifica wikitesto]- ^ Sigma Aldrich; rev. del 25.02.2010
- ^ (EN) Markus Dold, Myrto T Samara e Chunbo Li, Haloperidol versus first-generation antipsychotics for the treatment of schizophrenia and other psychotic disorders, in Cochrane Schizophrenia Group (a cura di), Cochrane Database of Systematic Reviews, 16 gennaio 2015, DOI:10.1002/14651858.CD009831.pub2. URL consultato il 16 giugno 2023.
- ^ a b Wesley K. Kroeze, Sandra J. Hufeisen e Beth A. Popadak, H1-histamine receptor affinity predicts short-term weight gain for typical and atypical antipsychotic drugs, in Neuropsychopharmacology: Official Publication of the American College of Neuropsychopharmacology, vol. 28, n. 3, 2003-03, pp. 519–526, DOI:10.1038/sj.npp.1300027. URL consultato il 16 giugno 2023.
- ^ a b c d e f g h Haloperidol, su go.drugbank.com. URL consultato il 16 giugno 2023.
- ^ a b P. Seeman e S. Kapur, Schizophrenia: more dopamine, more D2 receptors, in Proceedings of the National Academy of Sciences of the United States of America, vol. 97, n. 14, 5 luglio 2000, pp. 7673–7675, DOI:10.1073/pnas.97.14.7673. URL consultato il 16 giugno 2023.
- ^ (EN) Magdolna Tardy, Maximilian Huhn e Werner Kissling, Haloperidol versus low-potency first-generation antipsychotic drugs for schizophrenia, in Cochrane Schizophrenia Group (a cura di), Cochrane Database of Systematic Reviews, 9 luglio 2014, DOI:10.1002/14651858.CD009268.pub2. URL consultato il 16 giugno 2023.
- ^ (EN) Cb Joy, Ce Adams e Sm Lawrie, Haloperidol versus placebo for schizophrenia, John Wiley & Sons, Ltd, 23 aprile 2001, DOI:10.1002/14651858.cd003082. URL consultato il 16 giugno 2023.
- ^ a b c Philip Seeman, Atypical antipsychotics: mechanism of action, in Canadian Journal of Psychiatry. Revue Canadienne De Psychiatrie, vol. 47, n. 1, 2002-02, pp. 27–38. URL consultato il 16 giugno 2023.
- ^ a b c d e f g h S. Kudo e T. Ishizaki, Pharmacokinetics of haloperidol: an update, in Clinical Pharmacokinetics, vol. 37, n. 6, 1999-12, pp. 435–456, DOI:10.2165/00003088-199937060-00001. URL consultato il 16 giugno 2023.
- ^ Haldol Decanoate - Summary of Product Characteristics (SmPC) - (emc), su www.medicines.org.uk. URL consultato il 16 giugno 2023.
- ^ The Influence of Chronic Exposure to Antipsychotic Medications on Brain Size before and after Tissue Fixation: A Comparison of Haloperidol and Olanzapine in Macaque Monkeys, su nature.com.
- ^ Neuroleptics shrink brains in monkeys, su mindfreedom.org.
- ^ Dr. Beng-Choon Ho, MRCPsych, Dr. Nancy C. Andreasen, MD, PhD, Messr. Steven Ziebell, BS, Messr. Ronald Pierson, MS, and Dr. Vincent Magnotta, PhD, Long-term Antipsychotic Treatment and Brain Volumes, su ncbi.nlm.nih.gov.
Bibliografia
[modifica | modifica wikitesto]- Janssen PA. The discovery of haloperidol, in Ayd F e Blackwell B (eds), Lippincott, Philadelphia, 1970.
- Janssen PA. From Haloperidol to Risperidone, in Healy (ed) The Psychopharmacologists II, Altman, London, 1998.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su aloperidolo
Wikimedia Commons contiene immagini o altri file su aloperidolo
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) haloperidol, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- Stefano Canali, Luca Pani, Dall'aloperidolo al risperidone: 50 anni di progressi nelle neuroscienze (PDF), su stefanocanali.com. URL consultato il 16 maggio 2009 (archiviato dall'url originale il 12 ottobre 2007).
- L'Aloperidolo può causare prolungamento dell’intervallo QT e torsione di punta [collegamento interrotto], su progettofarmaci.it.
- Rischio di cardiotossicità con il farmaco antipsicotico Aloperidolo [collegamento interrotto], su progettofarmaci.it.
- Risperidone versus Aloperidolo nel primo episodio di psicosi [collegamento interrotto], su progettofarmaci.it.
- L'Olanzapina non ha mostrato vantaggi rispetto all'Aloperidolo nel trattamento dei pazienti con schizofrenia [collegamento interrotto], su progettofarmaci.it.









