| Trifluoruro di bismuto | |
|---|---|
 | |
| Nome IUPAC | |
| Trifluoruro di bismuto | |
| Nomi alternativi | |
| Fluoruro bismutoso Fluoruro di bismuto(III) | |
| Caratteristiche generali | |
| Formula bruta o molecolare | BiF3 |
| Massa molecolare (u) | 265,98 |
| Aspetto | solido bianco |
| Numero CAS | |
| Numero EINECS | 232-124-8 |
| PubChem | 82233 |
| SMILES | [F-].[F-].[F-].[BiH3+3] |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 5,23 g cm-3 |
| Solubilità in acqua | insolubile |
| Temperatura di fusione | 649 °C (922 K) |
| Temperatura di ebollizione | 900 °C (1173 K) |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | -900 |
| S0m(J·K−1mol−1) | 123 |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |

| |
| Frasi H | 314 |
| Consigli P | 280 - 305+351+338 - 310 |
Il trifluoruro di bismuto è il composto binario tra fluoro e bismuto con formula BiF3. Viene utilizzato per la sintesi del pentafluoruro di bismuto, BiF5.
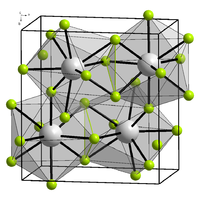
Struttura e proprietà
[modifica | modifica wikitesto]α-BiF3 ha una struttura cristallina cubica (simbolo di Pearson cF16, gruppo spaziale Fm-3m, No. 225). Il β-BiF3 ha una struttura tipo YF3 dove l'atomo di bismuto ha una coordinazione 9 distorta, prisma trigonale tricappata.[1] In genere questa struttura è considerata ionica, in contrasto con i fluoruri dei membri più leggeri del gruppo 15 trifluoruro di fosforo, PF3, trifluoruro di arsenico, AsF3 e trifluoruro di antimonio, SbF3, che nel solido contengono unità molecolari MF3.[1]
Sintesi
[modifica | modifica wikitesto]Il trifluoruro di bismuto si prepara normalmente facendo reagire l'ossido di bismuto con fluoruro di idrogeno:[2]
- Bi2O3 + 6HF → 2BiF3 + 3H2O
Reattività
[modifica | modifica wikitesto]BiF3 non reagisce con l'acqua ed è pressoché insolubile in essa. Presenta scarsa tendenza a formare complessi, ma sono noti BiF3·3HF e BiF4- in NH4BiF4. Il composto di addizione H3BiF6 si idrolizza in acqua formando BiOF.[3]
Precauzioni
[modifica | modifica wikitesto]Il trifluoruro di bismuto è disponibile in commercio. Il composto per contatto provoca gravi ustioni cutanee e gravi lesioni oculari. Se inalato o ingerito provoca ustioni alle mucose. Non ci sono dati che indichino proprietà cancerogene. Non ci sono dati sulla pericolosità ambientale, ma si raccomanda di non disperderlo nell'ambiente.[4]
Note
[modifica | modifica wikitesto]- ^ a b Wells 1984
- ^ Greenwood e Earnshaw 1997, pp. 559-560.
- ^ Norman 1998
- ^ Sigma-Aldrich, scheda dei dati di sicurezza di BiF3.
Bibliografia
[modifica | modifica wikitesto]- (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- (EN) N. C. Norman (a cura di), Chemistry of arsenic, antimony, and bismuth, Springer, 1998, ISBN 978-0-7514-0389-3.
- (EN) A. F. Wells, Structural Inorganic Chemistry, 5ª ed., Oxford Science Publications, 1984, ISBN 0-19-855370-6.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Trifluoruro di bismuto
Wikimedia Commons contiene immagini o altri file su Trifluoruro di bismuto








