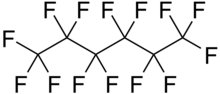

I fluorocarburi sono composti chimici contenenti legami tra fluoro e carbonio. Il legame carbonio–fluoro è il più forte legame singolo in chimica organica.[1] Di conseguenza i fluorocarburi che contengono solo legami singoli (fluoroalcani) hanno una stabilità termica e un'inerzia chimica maggiore dei corrispondenti alcani, e trovano svariate applicazioni, quali: agenti di finissaggio per tessuti, componenti di agenti antincendio, bagni galvanici, oli lubrificanti, trasportatori di ossigeno per ricerche sulla respirazione liquida.[2] I fluoroalcani hanno però lo svantaggio di essere potenti gas serra. I fluorocarburi contenenti doppi o tripli legami (fluoroalcheni e fluoroalchini) sono invece più reattivi dei corrispondenti idrocarburi, essendo composti insaturi, e sono spesso usati come reagenti.
Nomenclatura
[modifica | modifica wikitesto]A rigore, non c'è una definizione univoca del termine fluorocarburi. Secondo la definizione della Unione internazionale di chimica pura e applicata i fluorocarburi sono "composti costituiti interamente da fluoro e carbonio".[3] Secondo altre fonti i fluorocarburi sono definiti come idrocarburi nei quali tutti o parte degli atomi d’idrogeno sono stati sostituiti da atomi di fluoro.[4][5] Usando il termine perfluorocarburi (PFC) non ci sono invece ambiguità: ci si riferisce a composti dove tutti gli idrogeni sono stati sostituiti da atomi di fluoro.[6][7]
Anche altri composti organici fluorurati sono a volte impropriamente chiamati fluorocarburi,[8] perché hanno analoghe proprietà e struttura simile. Tali composti andrebbero più correttamente considerati come derivati dei fluorocarburi, e sono considerati più oltre in una sezione separata.
Proprietà fisiche
[modifica | modifica wikitesto]
I fluorocarburi liquidi sono incolori. Hanno densità elevata, fino ad oltre il doppio dell'acqua, dato che hanno peso molecolare elevato. All'interno del liquido le forze intermolecolari sono deboli e quindi i liquidi hanno bassa viscosità rispetto a liquidi con analogo punto di ebollizione. Anche i valori di tensione superficiale, calore di evaporazione e indice di rifrazione sono bassi. Non sono miscibili con solventi organici come etanolo, acetone, acetato di etile e cloroformio, ma sono miscibili con alcuni idrocarburi saturi (in alcuni casi in esano). Hanno solubilità molto bassa in acqua, e l'acqua vi è pochissimo solubile (nell'ordine di 10 ppm). La maggior parte delle proprietà fisiche è determinata dal numero di atomi di carbonio contenuti nella molecola. Al crescere del numero di atomi di carbonio crescono punto di ebollizione, densità, viscosità, tensione superficiale, pressione di vapore e indice di rifrazione. Per i fluorocarburi gassosi la solubilità cala al crescere del numero di atomi di carbonio, mentre il punto di fusione dipende da altri fattori e non può essere previsto in modo semplice.
Forze di London
[modifica | modifica wikitesto]
A causa dell'alta elettronegatività e delle piccole dimensioni del fluoro, la nuvola elettronica attorno al fluoro è scarsamente polarizzabile nei fluorocarburi e di conseguenza le forze di London sono deboli. Per questo motivo i fluorocarburi sono caratterizzati da deboli forze intermolecolari, e sono sia idrofobici che lipofobici. La debolezza delle forze di London rende untuoso il politetrafluoroetilene, che ha un coefficiente d'attrito molto basso. Le deboli forze intermolecolari rendono compressibili i fluorocarburi liquidi e li rendono capaci di sciogliere grandi quantità di gas, mentre rendono estremamente volatili i fluorocarburi più piccoli.[8] I fluoralcani gassosi sono cinque: tetrafluorometano (Tb = −128 °C), esafluoroetano (Tb = −78,2 °C), ottafluoropropano (Tb = −36,5 °C), perfluoro-n-butano (Tb = −2,2 °C) e perfluoroisobutano (Tb = −1 °C). Quasi tutti gli altri fluoroalcani sono liquidi a temperatura ambiente, con l'eccezione del perfluorocicloesano, che è un solido che sublima a 51 °C.[9]
Proprietà chimiche
[modifica | modifica wikitesto]Stabilità dei fluoroalcani
[modifica | modifica wikitesto]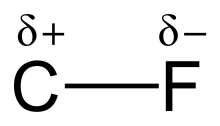
I fluorocarburi contenenti solo legami semplici (fluoroalcani) possiedono una elevata stabilità in virtù della natura e della forza del legame carbonio–fluoro, che è il più forte legame singolo nella chimica organica.[1] La forza di questo legame è dovuta all'elettronegatività del fluoro che provoca una forte polarizzazione del legame carbonio–fluoro impartendovi un parziale carattere ionico.[1] Il legame viene accorciato e rafforzato dall'interazione coulombiana che si instaura tra le cariche parziali formate. Inoltre, ogni legame carbonio–fluoro rafforza e stabilizza gli altri legami carbonio–fluoro connessi allo stesso atomo di carbonio, dato che il carbonio assume una carica parziale sempre più positiva.[8] Per questo motivo i fluorocarburi saturi sono termicamente più stabili e chimicamente più inerti dei corrispondenti idrocarburi: resistono agli attacchi di acidi, basi, agenti ossidanti e riducenti fino a 600 °C.[10]
Reattività di fluoroalcheni e fluoroalchini
[modifica | modifica wikitesto]
I fluorocarburi insaturi sono meno stabili e più reattivi dei fluoroalcani e dei corrispondenti idrocarburi. Alcuni esempi sono i seguenti. Il più semplice fluoroalchino, il difluoroacetilene, polimerizza facilmente.[8] Il fluorofullerene, reagisce con nucleofili e si idrolizza in soluzione, avendo legami carbonio–fluoro più lunghi e più deboli rispetto ai fluorocarburi saturi.[11] La polimerizzazione del tetrafluoroetilene a formare PTFE è energeticamente più favorevole di quella dell'etilene.[8]
Produzione
[modifica | modifica wikitesto]Prima della seconda guerra mondiale i fluorocarburi potevano essere prodotti solo per reazione diretta tra fluoro e idrocarburo. Con questo procedimento altamente esotermico si potevano sintetizzare solo tetrafluorometano, esafluoroetano e ottafluoropropano; idrocarburi più grandi si decompongono in queste condizioni estreme. Il Progetto Manhattan individuò la necessità di ottenere alcune sostanze chimiche particolarmente inattaccabili, tra cui un maggior numero di fluororcarburi. Furono così sviluppati nuovi metodi di sintesi. Il cosiddetto metodo "catalitico" prevedeva la reazione tra fluoro e idrocarburo su un letto di trucioli di rame dorato; il metallo non agiva come catalizzatore, ma serviva a rimuovere il calore sviluppato dalla reazione e permetteva agli idrocarburi più grandi di sopravvivere al processo. Tuttavia, fu il processo Fowler che permise di ottenere fluorocarburi su larga scala come richiesto dal progetto Manhattan.
Fluorurazione con fluoruri metallici
[modifica | modifica wikitesto]In questa tecnica (processo Fowler) si usano fluoruri di cobalto per moderare la reazione. In laboratorio questo prevede due passaggi; il primo è la fluorurazione del difluoruro di cobalto per arrivare a trifluoruro di cobalto:
- 2 CoF2 + F2 → 2 CoF3
Nel secondo passaggio si introduce l'idrocarburo che viene fluorurato da CoF3; quest'ultimo viene riconvertito a CoF2. Entrambi i passaggi vanno condotti a temperatura elevata. Ad esempio per produrre perfluoroesano:
- C6H14 + 28 CoF3 → C6F14 + 14 HF + 28 CoF2
Industrialmente i due passaggi sono combinati, ad esempio usando un reattore verticale: l'idrocarburo è inserito dal fondo, mentre il fluoro è introdotto a metà altezza. Il fluorocarburo è raccolto dalla cima.
Fluorurazione elettrochimica
[modifica | modifica wikitesto]La fluorurazione elettrochimica (nota come processo Simons) è una tecnica alternativa per produrre fluorocarburi; si basa sull'elettrolisi del substrato disciolto in fluoruro di idrogeno anidro. L'elettrolisi del fluoruro di idrogeno produce direttamente fluoro, ma il processo avviene in una cella singola senza liberare fluoro gassoso. La fluorurazione avviene sull'anodo con un meccanismo radicalico. La scelta del substrato è limitata dalla necessità di scioglierlo in fluoruro di idrogeno. In genere si usano eteri e amine terziarie. Ad esempio, per produrre perfluoroesano si usa triesilammina:
- 2 N(C6H13)3 + 90 HF → 6 C6F14 + 2 NF3 + 81 H2
Si forma anche l'ammina perfluorurata:
- N(C6H13)3 + 39 HF → N(C6F13)3 + 39 H2
Questi due composti sono prodotti dalla 3M e commercializzati nella linea Fluorinert.
Derivati dei fluorocarburi
[modifica | modifica wikitesto]I derivati dei fluorocarburi sono quei composti che contengono anche altri elementi oltre a fluoro, carbonio e idrogeno. Sono talvolta impropriamente chiamati fluorocarburi dato che possiedono proprietà anche molto simili a quelle dei fluorocarburi veri e propri, e quindi si prestano ad utili applicazioni di interesse economico. Ad esempio, i surfattanti fluorurati sono più efficaci dei normali tensioattivi idrocarburici nel ridurre la tensione superficiale. Infatti i fluorosurfattanti hanno una parte fluorurata che è sia lipofobica che idrofobica, e una parte idrofila data dal gruppo funzionale polare aggiunto alla catena fluorurata.[12] Altri derivati dei fluorocarburi sono usati come anestetici: possono contenere un atomo di ossigeno in un gruppo etere o atomi di cloro. Il cloro è usato anche nei clorofluorocarburi.
Fluorosurfattanti
[modifica | modifica wikitesto]- Acido perfluoroottansolfonico (PFOS)
- Acido perfluoroottanoico (PFOA)
- Acido perfluorononanoico (PFNA)
Anestetici
[modifica | modifica wikitesto]Derivati alogenati
[modifica | modifica wikitesto]Idrofluorocarburi
[modifica | modifica wikitesto]Problemi per la salute e l'ambiente
[modifica | modifica wikitesto]Alcuni fluorocarburi sono di origine naturale; ad esempio tetrafluorometano e altri idrocarburi fluorurati sono stati trovati in rocce ignee e rocce metamorfiche.[13] Tuttavia i fluorocarburi di sintesi sono potenti gas serra. Per quanto riguarda aspetti ambientali vanno inoltre considerate le caratteristiche di bioaccumulo dei fluorocarburi, che sono sostanze estremamente stabili e possono accumularsi nel corpo di animali e umani.[14]
Note
[modifica | modifica wikitesto]- ^ a b c O'Hagan 2008
- ^ Lewandowski et al. 2006
- ^ IUPAC 2019
- ^ Enciclopedia Treccani
- ^ Collins English Dictionary
- ^ Bruice 2016
- ^ European Environmental Agency
- ^ a b c d e Lemal 2004
- ^ Sigman et al. 2000
- ^ Housecroft e Sharpe 2008
- ^ Kiplinger et al. 1994
- ^ Hu et al. 2010
- ^ Harnisch et al. 2000
- ^ US Environmental Protection Agency.
Bibliografia
[modifica | modifica wikitesto]- (EN) P. Y. Bruice, Organic Chemistry, 8ª ed., Pearson, 2016, ISBN 978-0-13-404228-2.
- Collins English Dictionary, fluorocarbon, su collinsdictionary.com, HarperCollins Publishers. URL consultato il 3 dicembre 2024.
- Enciclopedia Treccani, Fluorocarburi, su Treccani - Enciclopedia on line. URL consultato il 3 dicembre 2024.
- European Environmental Agency, Perfluorocarbons (PFCs), su European Environmental Agency. URL consultato il 3 dicembre 2024.
- J. Harnisch, M. Frische, R. Borchers, A. Eisenhauer, A. Jordan, Natural fluorinated organics in fluorite and rocks, in Geophys. Res. Lett., vol. 27, n. 13, 2000, pp. 1883–1886, DOI:10.1029/2000GL008488. URL consultato il 10 ottobre 2013.
- (EN) C. E. Housecroft e A. G. Sharpe, Inorganic chemistry, 3ª ed., Harlow (England), Pearson Education Limited, 2008, ISBN 978-0-13-175553-6.
- J. Hu, X. Zhang, e Z. Wang, A Review on Progress in QSPR Studies for Surfactants, in Int. J. Mol. Sci., vol. 11, n. 3, 2010, pp. 1020–1047, DOI:10.3390/ijms11031020. URL consultato il 10 ottobre 2013.
- IUPAC, fluorocarbons, su IUPAC Compendium of Chemical Terminology, 3rd ed., International Union of Pure and Applied Chemistry, 2019. URL consultato il 3 dicembre 2024.
- J. L. Kiplinger, T. G. Richmond, C. E. Osterberg, Activation of Carbon-Fluorine Bonds by Metal Complexes, in Chem. Rev., vol. 94, n. 2, 1994, pp. 373–431, DOI:10.1021/cr00026a005. URL consultato il 10 ottobre 2013.
- D. M. Lemal, Perspective on fluorocarbon chemistry, in J. Org. Chem., vol. 69, n. 1, 2004, pp. 1-11, DOI:10.1021/jo0302556. URL consultato il 10 ottobre 2013.
- G. Lewandowski, E. Meissner, E. Milchert, Special applications of fluorinated organic compounds, in J. Hazard. Mater., vol. 136, n. 3, 2006, pp. 385–391, DOI:10.1016/j.jhazmat.2006.04.017. URL consultato il 10 ottobre 2013.
- D. O'Hagan, Understanding organofluorine chemistry. An introduction to the C–F bond, in Chem. Soc. Rev., vol. 37, n. 2, 2008, pp. 308–319, DOI:10.1039/b711844a. URL consultato il 10 ottobre 2013.
- M. E. Sigman, M. B. Wise, M. R. Guerin, Perfluoro(methylcyclohexane) tracer tagging test and demonstration (PDF), su web.ornl.gov, Oak Ridge National Laboratory, 2000. URL consultato il 10 ottobre 2013 (archiviato dall'url originale il 28 luglio 2013).
- US Environmental Protection Agency, FAQ, su Perfluorooctanoic Acid (PFOA) and Fluorinated Telomers, 2012. URL consultato il 10 ottobre 2013.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su perfluorocarburi
Wikimedia Commons contiene immagini o altri file su perfluorocarburi
Collegamenti esterni
[modifica | modifica wikitesto]- fluorocarburo, su sapere.it, De Agostini.
- (EN) fluorocarbon, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 21007 · LCCN (EN) sh85049435 · BNF (FR) cb122887965 (data) · J9U (EN, HE) 987007538443005171 · NDL (EN, JA) 00575245 |
|---|








