| Tetracloruro di osmio | |
|---|---|
 | |
| Nome IUPAC | |
| tetracloruro di osmio, cloruro di osmio(IV) | |
| Caratteristiche generali | |
| Formula bruta o molecolare | Cl4Os |
| Aspetto |
|
| Numero CAS | |
| Numero EINECS | 622-467-5 |
| PubChem | 4070891 e 91617916 |
| SMILES | Cl[Os](Cl)(Cl)Cl |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | |
| Solubilità in acqua | reagisce |
| Temperatura di fusione | 450 °C (723 K)[3] |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |

| |
| pericolo | |
| Frasi H | 301 - 311 - 315 - 319 - 331 - 335 [3] |
| Consigli P | 261 - 280 - 305+351+338 - 311 [3] |
Il tetracloruro di osmio o cloruro di osmio(IV) è il composto binario con formula OsCl4. In condizioni normali è un solido che dà luogo a due polimorfi: una forma ottenibile a bassa temperatura di colore marrone scuro, e una forma ottenibile ad alta temperatura di colore nero.[4][5] In questo composto l'osmio ha stato di ossidazione +4.
Struttura
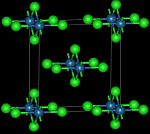
[modifica | modifica wikitesto]Il tetracloruro di osmio si può ottenere in due forme differenti a seconda della procedura usata per la sintesi. Entrambe le forme risultano paramagnetiche.[4] La forma ad alta temperatura è un solido nero con struttura cristallina ortorombica, gruppo spaziale Cmmm, con costanti di reticolo a = 792,9 pm, b = 832,6 pm e c = 356,0 pm, due unità di formula per cella elementare. La struttura è composta da catene infinite di ottaedri OsCl6 uniti sui lati opposti, come illustrato nella figura iniziale. La distanza Os-Os risulta 356,0 pm.[2]
La forma a bassa temperatura è un solido marrone scuro con struttura cristallina cubica, gruppo spaziale P4332 o P4132.[2][6]
Sintesi
[modifica | modifica wikitesto]Il composto fu sintetizzato per la prima volta nel 1909 da Otto Ruff trattando osmio metallico con cloro a circa 700 ºC.[7] Per questa via si ottiene la forma nera:
Alternativamente la forma nera si può ricavare facendo reagire osmio metallico con cloruro di solforile o con tetracloruro di carbonio a 400-600 ºC.[2] La forma marrone si ottiene invece dalla reazione a 80 ºC tra tetrossido di osmio e cloruro di tionile:[6]
Reattività
[modifica | modifica wikitesto]Il tetracloruro di osmio è un composto insolubile in solventi organici. In acqua e in acido cloridrico si idrolizza. Riscaldato oltre 400 ºC in presenza di ossigeno viene ossidato a OsOCl4.[4]
Note
[modifica | modifica wikitesto]Bibliografia
[modifica | modifica wikitesto]- (EN) F. A. Cotton e C. E. Rice, Structure of the high-temperature form of osmium(IV) chloride, in Inorg. Chem., vol. 16, n. 8, 1977, pp. 1865-1867, DOI:10.1021/ic50174a008.
- (EN) C. E. Housecroft e A. G. Sharpe, Inorganic chemistry, 3ª ed., Harlow (England), Pearson Education Limited, 2008, ISBN 978-0-13-175553-6.
- (EN) P. Machmer, On the polymorphism of osmium tetrachloride, in Chem. Commun. (London), 1967, pp. 610a-610a, DOI:10.1039/C1967000610A.
- (EN) J. E. Macintyre (a cura di), Dictionary of Inorganic Compounds, CRC Press, 1992, ISBN 9780412301209.
- (DE) O. Ruff e F. Bornemann, über das Osmium, seine analytische Bestimmung, seine Oxyde und seine Chloride, in Z. Anorg. Chem., vol. 65, n. 1, 1909, pp. 429-456, DOI:10.1002/zaac.19100650126.
- Sigma-Aldrich, Scheda di dati di sicurezza del tetracloruro di osmio, su sigmaaldrich.com, 2018. URL consultato il 3 febbraio 2020.
- (EN) C. L. Yaws, The Yaws Handbook of Physical Properties for Hydrocarbons and Chemicals, Gulf Professional Publishing, 2015, ISBN 978-0-12-801146-1.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su cloruro di osmio(IV)
Wikimedia Commons contiene immagini o altri file su cloruro di osmio(IV)










