| Acido citrico | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| acido 3-carbossil-3-idrossi-1,5-pentandioico | |
| Nomi alternativi | |
| acido 2-idrossi-1,2,3-propantricarbossilico | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C6H8O7 |
| Massa molecolare (u) | 192,12 |
| Aspetto | solido incolore |
| Numero CAS | |
| Numero EINECS | 201-069-1 |
| PubChem | 311, 19782904 e 88113319 |
| DrugBank | DBDB04272 |
| SMILES | C(C(=O)O)C(CC(=O)O)(C(=O)O)O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,665 |
| Costante di dissociazione acida (pKa) a 293 K | 3,1; 4,8; 6,4 |
| Solubilità in acqua | 750 g/l a 293 K |
| Temperatura di fusione | 153 °C |
| Temperatura di ebollizione | Decompone |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −1543,8 |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | 3000 mg/kg (ratto, orale) |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |

| |
| attenzione | |
| Frasi H | 319 |
| Consigli P | 280 - 305+351+338 - 337+313 [1] |

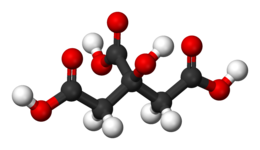
L'acido citrico è un composto organico avente formula bruta C6H8O7.[2] È acido tricarbossilico solubile in acqua.
Sebbene l’acido citrico sia uno degli acidi più diffusi negli organismi vegetali ed un prodotto metabolico degli organismi aerobici, quando è solido oppure in soluzione concentrata deve essere maneggiato con cautela. Si trova in tracce nella frutta, soprattutto del genere Citrus: il succo di limone ne può contenere sino al 3-4% e l'arancia l'1%. È presente anche nei legni, nei funghi, nel tabacco, nel vino e persino nel latte.
Ogni anno vengono prodotti più di un milione di tonnellate di acido citrico. È ampiamente utilizzato come anticalcare, acidificante, acido per il restauro e chelante.[3]
I derivati dell'acido citrico vengono chiamati citrati, che comprendono sia i sali e gli esteri sia l'anione poliatomico in soluzione. Un esempio di citrato è il citrato di sodio, un esempio di estere è il trietilcitrato. È presente in piccola quantità anche in bevande zuccherate.
Biosintesi e produzione industriale
[modifica | modifica wikitesto]L'acido citrico si può trovare in una grande varietà di frutta e verdura, in particolare negli agrumi. I limoni e il lime hanno concentrazioni particolarmente elevate dell'acido, che può costituire fino al 3% del peso secco.[4] Le concentrazioni di acido citrico negli agrumi vanno da 0,005 mol/L nelle arance e pompelmi a 0,30 mol/L nei limoni e lime. All'interno delle specie, questi valori variano a seconda della cultivar e dell'ambiente in cui il frutto viene coltivato.
Nel 1784 Carl Wilhelm Scheele, isolò per la prima volta l'acido citrico dal succo di limone per cristallizzazione.[5][6] La produzione di acido citrico su scala industriale è invece iniziata nel 1890, in Italia, dove si ricavava dal succo di limone (Citrus × limon), attraverso un complesso processo con soluzione di ammoniaca, cloruro di calcio e acido solforico.[5] Nel 1893, Carl Whemer scoprì che la muffa Penicillium, poteva produrre acido citrico dallo zucchero. Tuttavia, la produzione microbica di acido citrico non divenne industrialmente importante fino a quando a causa della prima guerra mondiale non si interruppero le esportazioni di agrumi dall'Italia.
Nel 1917, il chimico americano James Currie scoprì che alcuni ceppi di Aspergillus niger potevano produrre efficientemente l'acido citrico. La società farmaceutica Pfizer iniziò la produzione a livello industriale usando questa tecnica due anni dopo, seguita da Citrique Belge nel 1929.
Anche oggi l'acido citrico viene prodotto attraverso fermentazioni su scala industriale utilizzando funghi (come l'Aspergillus niger) o lieviti in bioreattori ad ambiente a basso pH (acidulato) e bassa concentrazione di ferro; a tale scopo si utilizzano chelanti degli ioni ferro come l'EDTA. In questo modo il ciclo di Krebs viene interrotto all'acido citrico che può essere estratto dalla cellula e purificato.
Nel 2007, la produzione annuale mondiale dell'acido citrico era di circa 1.600.000 tonnellate.[7] Più del 50% di questo volume è stato prodotto in Cina. La metà è stata utilizzata come igienizzante e disincrostante, circa il 20/25% per le correzioni di pH in preparazioni chimiche. Il restante 20/25% trova impiego in prodotti farmaceutici e nell'industria chimica.
Proprietà chimiche
[modifica | modifica wikitesto]L'acido citrico è un acido carbossilico, triprotico, con pKa 3,13, 4,76 e 6,34. Può esistere in forma anidra (senza acqua), o monoidrato. La forma anidra cristallizza dall'acqua calda, mentre il monoidrato si forma quando l'acido citrico viene cristallizzato dall'acqua fredda. Il monoidrato può essere convertito in forma anidra a circa 78 °C. Allo stato anidro l'acido citrico è in forma di cristalli rombici, molto solubili in acqua.
I tre gruppi carbossilici (-COOH) si ionizzano progressivamente passando progressivamente da un pH moderatamente acido a un pH vicino alla neutralità, fino a un pH nettamente basico. La forchetta è pertanto ampia.
Lo ione citrato forma complessi con cationi metallici, compresi quelli alcalini. I complessi chelati formati da tutti e tre i gruppi carbossilato, hanno anelli con 7 e 8 membri, e risultano meno stabili rispetto agli anelli di chelati più piccoli.
Biochimica
[modifica | modifica wikitesto]L'acido citrico è un importante prodotto intermedio nel catabolismo dei carboidrati, una via metabolica fondamentale per gli esseri viventi aerobici, sia piante, che batteri e animali, incluso l'uomo. Il relativo processo biochimico prende il nome di ciclo di Krebs. Durante questa serie di reazioni metaboliche, la citrato sintasi catalizza la condensazione dell'ossalacetato con l'acetil CoA per formare il citrato. Il citrato agisce come substrato dell'aconitasi e viene convertito in acido aconitico. Il ciclo termina con la rigenerazione dell'ossalacetato. Negli organismi superiori due terzi dell'energia derivata dal cibo viene prodotta con questo sistema. Il citrato può essere trasportato fuori dai mitocondri, nel citoplasma, per essere usato per la sintesi degli acidi grassi e dell'ossalacetato. L'acido citrico è anche un componente importante delle ossa: circa 1/6 della superficie dei cristalli di apatite ossea è coperta da molecole di citrato, che hanno un effetto stabilizzante[8].
Funzioni e applicazioni
[modifica | modifica wikitesto]Cosmetici e detergenti
[modifica | modifica wikitesto]L'acido citrico ha la proprietà di ridurre la durezza dell'acqua, e per la sua azione anticalcare viene utilizzato in ammorbidenti eco-sostenibili per il lavaggio in lavatrice e come disincrostante per le tubazioni. In cosmesi può essere utilizzato come correttore di pH.
Per le sue capacità disincrostanti e corrosive è ampiamente utilizzato in prodotti per la pulizia di ambienti industriali professionali.
Alimenti, bevande e limone
[modifica | modifica wikitesto]Poiché è uno degli acidi commestibili più forti, l'acido citrico è utilizzato come aroma e un conservante nei cibi e nelle bevande, specialmente nelle bibite e nelle caramelle.[5] Nell'industria alimentare è usato, con la denominazione E330, come acidulante e per correggere il pH di coloranti basici, come emulsionante, ad esempio nei gelati, come sostituto del succo di limone oppure per evitare la precipitazione dello zucchero nel caramello. È molto usato anche in bibite, prodotti di confetteria, gelatine, marmellate, birre, conserve di pomodori pelati e, congiuntamente al sodio bicarbonato, in preparazioni effervescenti. L'acido citrico ha 247 kcal per ogni 100 g.[9]
Farmacologia
[modifica | modifica wikitesto]In campo farmacologico viene usato come anticoagulante nella conservazione del sangue estratto e come conservante in preparati farmaceutici (medicinali). I sali di citrato dei metalli sono usati per fornire i minerali in forma biologicamente più disponibile in molti integratori alimentari.
Sicurezza
[modifica | modifica wikitesto]È irritante per contatto con la pelle e gli occhi per cui va utilizzato abbigliamento protettivo quando si manipola. Un consumo eccessivo può intaccare lo smalto dentale.
Note
[modifica | modifica wikitesto]- ^ (EN) GESTIS Substance Database Information system on hazardous substances of the German Social Accident Insurance, Space GESTIS Substance Database - Citric acid, su gestis-en.itrust.de. URL consultato il 27 gennaio 2019 (archiviato dall'url originale l'11 novembre 2016).
- ^ (EN) PubChem, Citric Acid, su pubchem.ncbi.nlm.nih.gov. URL consultato il 6 marzo 2023.
- ^ Apelblat, Alexander,, Citric acid, ISBN 978-3-319-11232-9, OCLC 897810338.
- ^ Kristina L. Penniston, Stephen Y. Nakada e Ross P. Holmes, Quantitative assessment of citric acid in lemon juice, lime juice, and commercially-available fruit juice products, in Journal of Endourology, vol. 22, n. 3, March 2008, pp. 567–570, DOI:10.1089/end.2007.0304. URL consultato il 17 febbraio 2018.
- ^ a b c Frank H. Verhoff (2005), "Citric Acid", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH
- ^ (EN) Thomas Graham, Elements of Chemistry,: Including the Applications of the Science in the Arts, Hippolyte Baillière, foreign bookseller to the Royal College of Surgeons, and to the Royal Society, 219, Regent Street., 1842. URL consultato il 23 febbraio 2018.
- ^ Marin Berovic e Matic Legisa, Citric acid production, in Biotechnology Annual Review, vol. 13, 2007, pp. 303–343, DOI:10.1016/S1387-2656(07)13011-8. URL consultato il 17 febbraio 2018.
- ^ (EN) Y.- Y. Hu, A. Rawal, K. Schmidt-Rohr, Strongly bound citrate stabilizes the apatite nanocrystals in bone, in Proc Natl Acad Sci U S A, vol. 107, n. 52, 2010, pp. 22425-22429, DOI:10.1073/pnas.1009219107.
- ^ Greenfield, Heather. e Food and Agriculture Organization of the United Nations., Food composition data : production, management, and use, 2nd ed, Food and Agriculture Organization of the United Nations, 2003, ISBN 978-92-5-104949-5, OCLC 54831428.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file sull'acido citrico
Wikimedia Commons contiene immagini o altri file sull'acido citrico
Collegamenti esterni
[modifica | modifica wikitesto]- citrico, acido, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- (EN) citric acid, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- FEM2 - Ambiente Sito ufficiale dello spin-off del Dipartimento di Biotecnologie e Bioscienze dell'Università degli Studi di Milano-Bicocca
- I molteplici usi dell’acido citrico
| Controllo di autorità | Thesaurus BNCF 32566 · LCCN (EN) sh85026216 · GND (DE) 4148057-0 · J9U (EN, HE) 987007283821905171 |
|---|








