| Fluoruro di zirconio | |
|---|---|
 | |
| Nome IUPAC | |
| tetrafluoruro di zirconio | |
| Caratteristiche generali | |
| Formula bruta o molecolare | ZrF4 |
| Massa molecolare (u) | 167,22 g/mol |
| Aspetto | solido bianco |
| Numero CAS | |
| Numero EINECS | 232-018-1 |
| PubChem | 82216 e 10197871 |
| SMILES | F[Zr](F)(F)F |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 4,54 |
| Solubilità in acqua | 13,20 g/l (20 °C) |
| Temperatura di fusione | 920 °C (1.193 K) (sublimazione) |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |

| |
| pericolo | |
| Frasi H | 314 |
| Consigli P | 280 - 305+351+338 - 310 [1] |
Il fluoruro di zirconio (ZrF4) è il sale di zirconio dell'acido fluoridrico.
A temperatura ambiente si presenta come un solido bianco inodore, insolubile in acqua. È il principale componente dei vetri fluorozirconati.
È un composto irritante.
Struttura cristallina
[modifica | modifica wikitesto]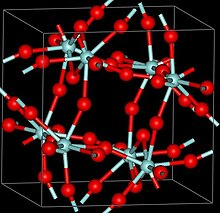
Sono conosciute tre fasi cristalline dello ZrF4, α (monoclina, β (tetragonale, simbolo di Pearson tP40, gruppo spaziale P42/m, No 84) e γ (struttura sconosciuta). Le fasi β e γ sono instabili e tendono a trasformarsi in modo irreversibile nella fase α a 400 °C.[2]
Preparazione
[modifica | modifica wikitesto]Il fluoruro di zirconio può essere ottenuto:
- per reazione tra il cloruro di zirconio e l'acido fluoridrico.[3]
- facendo reagire l'ossido di zirconio con l'acido fluoridrico.[3]
- per decomposizione termica di (NH4)2ZrF6.[3]
Il fluoruro di zirconio così ottenuto può essere poi purificato per distillazione o sublimazione.[4]
Applicazioni
[modifica | modifica wikitesto]Il fluoruro di zirconio viene utilizzato come fonte di zirconio nelle applicazioni sensibili all'ossigeno, come ad esempio nella produzione del metallo.[5]
È sensibile all'umidità, ai metalli attivi, agli acidi e agli agenti ossidanti. In miscela con altri fluoruri viene usato come refrigerante nei reattori nucleari a sali fusi ed è uno dei refrigeranti ipotizzati per il reattore nucleare a temperatura molto alta assieme al fluoruro di sodio.[6]
Note
[modifica | modifica wikitesto]- ^ Sigma Aldrich; rev. del 07.07.2011
- ^ Paul L. Brown, Federico J. Mompean, Jane Perrone, Myriam Illemassène, Chemical thermodynamics of zirconium, Gulf Professional Publishing, 2005, p. 144, ISBN 0-444-51803-7.
- ^ a b c Georg Brauer: Handbuch der Präparativen Anorganischen Chemie. 3., vol I, Enke, Stuttgart 1975, ISBN 3-432-02328-6, p. 260.
- ^ Method for preparing ultra-pure zirconium and hafnium tetrafluorides. United States Patent 4578252, su freepatentsonline.com. URL consultato il 7 luglio 2009.
- ^ Zirconium fluoride, su americanelements.com, American Elements. URL consultato il 7 luglio 2009 (archiviato dall'url originale il 27 dicembre 2008).
- ^ ORNL/TM-2006/12 Assessment of Candidate Molten Salt Coolants for the Advanced High-Temperature Reactor (AHTR), March 2006 (Accessed 2008/9/18)
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Fluoruro di zirconio
Wikimedia Commons contiene immagini o altri file su Fluoruro di zirconio










