Malattia di Chagas
| Malattia di Chagas | |
|---|---|
 | |
| Specialità | infettivologia e parassitologia |
| Eziologia | Trypanosoma cruzi |
| Classificazione e risorse esterne (EN) | |
| MeSH | D014355 |
| MedlinePlus | 001372 |
| eMedicine | 214581 |
| Sinonimi | |
| Tripanosomiasi americana | |
| Eponimi | |
| Carlos Chagas | |
La malattia di Chagas, nota anche come tripanosomiasi americana, è una malattia infettiva. Appartenente alla categoria delle parassitosi, presenta forme cliniche acute e forme croniche, ed è causata dal protozoo Trypanosoma cruzi. Il serbatoio del parassita sono gli individui infettati cronicamente. I vettori sono cimici ematofaghe di generi diversi.[1]
Si trasmette principalmente per mezzo di insetti noti come Triatominae.[1] I sintomi cambiano nel corso dell'infezione. Nella fase iniziale, generalmente essi non sono presenti o si rivelano lievi, come febbre, ingrossamento dei linfonodi, mal di testa e gonfiore locale sul sito di puntura.[1] Dopo 8-12 settimane, gli individui entrano nella fase cronica della malattia e nel 60%-70% non si presentano altri sintomi.[2][3] Nel restante 30%-40% si sviluppano ulteriori sintomi in un periodo tra i 10 e i 30 anni dopo l'infezione iniziale,[3] compreso l'allargamento dei ventricoli del cuore nel 20%-30% dei casi, portando a insufficienza cardiaca.[1] Nel 10% dei pazienti si può osservare anche un allargamento dell'esofago o del colon.[1]
T. cruzi è comunemente diffuso tra gli esseri umani e gli altri mammiferi attraverso ematofagia di insetti succhiatori sottofamiglia delle Triatominae.[4] Questi insetti sono conosciuti anche con un certo numero di nomi locali, tra cui: vinchuca in Argentina, Bolivia, Cile e Paraguay, barbeiro (barbiere) in Brasile, pito in Colombia, chinche in America centrale e chipo in Venezuela.[5] La malattia può essere trasmessa anche attraverso le trasfusioni di sangue, i trapianti di organi, l'alimentarsi con cibo contaminato dai parassiti e per trasmissione verticale (da una madre al feto).[1] La diagnosi precoce della malattia consiste nel trovare il parassita nel sangue utilizzando un microscopio.[3] La malattia cronica viene diagnosticata grazie alla ricerca di anticorpi per T. cruzi nel sangue.[3]
La prevenzione consiste principalmente nell'eliminazione dell'insetto e nell'evitare la puntura.[1] Altri interventi di prevenzione includono lo screening del sangue utilizzato per le trasfusioni.[1] Al 2015, un vaccino non è ancora stato sviluppato.[1] Le infezioni precoci sono curabili con il farmaco benzindazole o con il nifurtimox.[1] Il trattamento farmacologico si traduce quasi sempre in una guarigione, se somministrato precocemente, ma diventa sempre meno efficace con lo svilupparsi dall'infezione.[1] Quando i farmaci vengono utilizzati durante la fase di malattia cronica, essi possono ritardare o impedire lo sviluppo dei sintomi iniziali.[1] Il benznidazole e il nifurtimox possono causare effetti collaterali temporanei nel 40% dei casi[1], tra cui disturbi della cute, tossicità al cervello e irritazioni dell'apparato digerente.[2][6][7]
Si stima che, nel 2015, da 7 a 8 milioni di persone, per lo più residenti in Messico, America centrale e Sud America, abbiano la malattia di Chagas.[1] Nel 2006, è stato calcolato che la condizione provochi 12 500 morti l'anno.[1] La maggior parte delle persone con la malattia appartengono a una fascia povera della popolazione[2] e la maggior parte di essi non si rende nemmeno conto di essere infetto.[8] Gli spostamenti della popolazione su larga scala hanno incrementato le aree geografiche in cui la malattia di Chagas si può trovare e includendo molti paesi europei e gli Stati Uniti.[1] Queste aree hanno visto un aumento dei casi negli anni.[9].
La malattia è stata descritta per la prima volta nel 1909 da Carlos Chagas, da cui prese il nome[1], e colpisce più di 150 specie animali.[2]
Storia
[modifica | modifica wikitesto]
Nel 1907 Carlos Chagas, grande malariologo mineiro, fu inviato dall'Instituto Bacteriológico Oswaldo Cruz di Rio de Janeiro, insieme all'amico e collega Belisário Penna, a Lassance, nel Minas Gerais, nei pressi del Rio São Francisco, per studiare un'epidemia di malaria che affliggeva l'accampamento degli operai che stavano costruendo la ferrovia della compagnia E.F. Central do Brasil. Chagas allora arrangiò un laboratorio da campo in una carrozza di treno. La gente del luogo gli raccontò dell'esistenza di alcune cimici dette barbeiros che di notte uscivano dalle crepe nelle pareti delle case e si arrampicavano sui volti degli abitanti per succhiarne il sangue. Ne catturò alcune rosse e nere (del genere Panstrongylus) e scoprì, nell'intestino e nelle feci di questi emitteri, numerosi protozoi con le caratteristiche morfologiche dei tripanosomi. All'inizio pensò a uno stadio evolutivo di un qualche protozoo emoflagellato dell'insetto o di qualche altro vertebrato.
In seguito, tornò a Rio de Janeiro e fece pungere alcune scimmie dagli insetti che aveva raccolto e nel sangue periferico di una di queste ritrovò poi i tripanosomi. Chiamò il parassita Schizotrypanum cruzi poi Trypanosoma cruzi, in onore del suo maestro Oswaldo Cruz. Scoprì anche delle forme tissutali del parassita, gli amastigoti, che si dividevano per fissione binaria e formavano nidi e pseudocisti nelle fibre muscolari e cardiache. A Lassance successivamente Chagas segnalò il primo caso di forma acuta di una nuova malattia: trovò lo stesso parassita che aveva scoperto nel sangue di una bambina con febbre, anemia, epatosplenomegalia (poi questa bimba visse fino a veneranda età senza problemi). Dimostrò che quel parassita era la causa di una malattia molto comune nelle regioni rurali del Brasile: la tripanosomiasi americana.
Nell'aprile del 1909, a 29 anni, Chagas segnalò sulla Revista Brasil-Médico l'esistenza di una nuova entità morbosa nell'uomo: la tripanosomiasi americana che prese il nome di malattia di Chagas. Fu l'unico caso nella storia della medicina nel quale un unico ricercatore descrisse completamente una nuova malattia infettiva, il suo agente eziologico, il vettore, l'ospite definitivo, il quadro clinico e l'epidemiologia.
Il giovane anatomo-patologo paraense Gaspar Vianna scrisse i primi fondamentali lavori sulla patogenesi della tripanosomiasi americana. Nel 1911 mostrò come la forma infettante di trypanosoma cruzi invade l'organismo dei vertebrati, penetra i tessuti, si riproduce e ritorna nel sangue, dove non si moltiplica. Vianna descrisse anche le lesioni provocate dalla malattia a carico del sistema nervoso autonomo e compì le prime osservazioni sui danni a carico del miocardio.
Negli anni venti del XX secolo, il radiologo e cardiologo Evandro Chagas, figlio di Carlos Chagas, fece i primi e più importanti studi sulla cardiopatia "chagasica" e fu il primo a studiare i segni elettrocardiografici della malattia.
Nel 1926 Salvador Mazza e Cecilio Romaña in Argentina diedero un grande contributo alla studio della clinica della malattia e alla sensibilizzazione di governi e popolazioni dei paesi endemici riguardo al problema, tanto che nel loro Stato la patologia viene chiamata malattia di Chagas-Mazza. Negli anni cinquanta l'anatomo-patologo austro-brasiliano Fritz Köberle fece importanti scoperte sulla patogenesi del danno al sistema nervoso intrinseco dell'apparato digerente e dell'apparato cardiaco.
Alcuni autori ipotizzano che lo stesso Charles Darwin possa essere stato affetto dalla tripanosomiasi americana, conseguenza della puntura di una triatomina durante il suo soggiorno in Argentina. L'episodio è riportato nei diari di viaggio della HMS Beagle e sarebbe avvenuto nel marzo del 1835, vicino a Mendoza. Charles Darwin allora era giovane e in buone condizioni generali, ma nel 1837, quasi un anno dopo il suo ritorno in Inghilterra, cominciò a soffrire in modo intermittente di una strana forma di malessere, che lo rese inabile per il resto della sua vita. Tentativi di esaminare le spoglie di Charles Darwin con i moderni test di amplificazione genica (PCR) sono sempre stati impediti dal responsabile dell'Abbazia di Westminster dove il naturalista è sepolto.
Agente eziologico
[modifica | modifica wikitesto]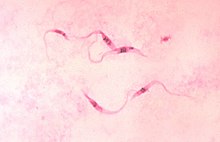
Trypanosoma cruzi è causa di una zoonosi diffusa in ambienti rurali dell'America Latina. L'uomo è parassitato da varie specie di Trypanosomatidae, protozoi emoflagellati asessuati e dixeni (con due ospiti), che gli sono trasmessi da insetti ematofagi (eterotteri ematofagi). Trypanosoma cruzi è l'unico tripanosoma umano che viene trasmesso attraverso le feci del vettore invertebrato, a differenza dei tripanosomi africani (responsabili della malattia del sonno) e del Trypanosoma rangeli (non patogeno), che vengono trasmessi all'uomo attraverso la saliva dell'insetto. L'uomo è ospite accidentale.
I protozoi emoflagellati si chiamano così perché possiedono un flagello, che funge da mezzo di locomozione e che permette loro di muoversi nel circolo sanguigno. Sono creature monocellulari diploidi, con un accumulo discoidale di DNA, detto cinetoplasto. La loro moltiplicazione avviene per divisione binaria. Gli emoflagellati possiedono varie forme:
- L'amastigote di T. cruzi è la forma replicativa intracellulare (nelle cellule del sistema reticolo-endoteliale e nelle fibre muscolari) nell'ospite vertebrato. Ha forma sferica (del diametro di 2-4 µm). Quando la cellula è piena di amastigoti, si rompe e questi diventano tripomastigoti e passano nel sangue per invadere altre cellule, soprattutto fibre muscolari striate e cardiache, dove si moltiplicano a centinaia, formando nidi allungati longitudinalmente nel senso della fibra.
- I tripomastigoti sono la forma infettante. Lunghi 15-20 µm e larghi 1 µm, lunghi e sottili o tozzi e curvati a falce, con flagello emergente lateralmente con una evidente membrana ondulante, partendo accanto al cinetoplasto posteriore al nucleo. Non si moltiplicano nel sangue.
- L'epimastigote è la forma riproduttiva nell'insetto e nel medium acellulare. Corpo allungato, flagello emergente lateralmente con una piccola membrana ondulante, partendo accanto al cinetoplasto paranucleare. La forma dell'epimastigote (lungo 15-35 µm) viene assunta nell'ampolla rettale dell'insetto ematofago: qui avviene una riproduzione per divisione binaria e una parte degli epimastigoti, regolarmente, si trasforma in tripomastigoti metaciclici, molto più infettanti di quelli del sangue. L'insetto rimane serbatoio per tutta la sua vita. Il ciclo nel vettore si compie in 2-4 settimane.
I ceppi di T. cruzi non sono geneticamente omogenei; recentemente sono stati distinti in due sottospecie:
- T. cruzi I è associato alla trasmissione silvestre e probabilmente è la forma originaria di T. cruzi; non si trova spesso nei paesi meridionali del Sudamerica ed è l'unica forma di T. cruzi che dia malattia a nord dell'Amazzonia.
- T. cruzi II è associato alla trasmissione domestica.
Entrambi sono associati alle lesioni cardiache ma sembra che solo T. cruzi II provochi la patologia digestiva.
Epidemiologia
[modifica | modifica wikitesto]Distribuzione geografica
[modifica | modifica wikitesto]
Si stima che 16-18 milioni di persone siano infettati dal T. cruzi, endemico in 18 paesi dell'America Latina, con sensibili differenze tra paese e paese.
Circa il 20% della popolazione boliviana è infetta (1 200 000 di individui, circa), mentre in Brasile la prevalenza complessiva è dell'1,3% (5 milioni di persone), ma raggiunge il 4% nelle aree rurali.
La malattia è tipica delle zone povere rurali, tuttavia i fenomeni migratori verso le aree urbane, verificatesi negli anni settanta e ottanta ne hanno mutato il classico pattern epidemiologico. Col tempo tende a diventare una malattia delle aree urbane e periurbane degradate.
Il mancato controllo, in passato, dei prodotti emoderivati ha creato una seconda via di trasmissione: tra il 1960 e il 1989 la prevalenza di sangue infetto nei centri trasfusionali delle città sudamericane variava tra l'1,7% di São Paulo al 53% di Santa Cruz, Bolivia, percentuali queste molto maggiori di quelle di presenza di epatiti virali o di HIV.
Attualmente c'è una costante diminuzione della prevalenza dell'infestazione domiciliare da parte dei vettori (Triatoma infestans) e dell'incidenza dell'infezione umana nei bimbi e nei giovani nei paesi del cosiddetto Cono Sur (Argentina, Uruguay, Cile) dove in questi ultimi anni è stata organizzata una grande campagna di disinfestazione.
Ora il problema della tripanosomiasi americana preoccupa anche gli USA, dove si stima ci siano tra i 100 000 e i 700 000 individui immigrati dall'America Latina e infettati da T. cruzi.
Riassumendo, il tipico paziente “chagasico” è:
- maschio di origini sudamericane tra i 30 e 40 anni,
- di origine rurale,
- che vive nelle periferie delle grandi città sudamericane,
- di basso livello culturale,
- che esercita un lavoro di tipo manuale,
- che giunge all'osservazione del medico per sieropositività per T. cruzi, per anomalie all'esame elettrocardiografico (ECG) o per sintomatologia cardiaca o digestiva.
Mortalità
[modifica | modifica wikitesto]La malattia di Chagas provoca 45 000-50 000 morti all'anno, principalmente per la forma cardiaca cronica. Un'aritmia fatale (fibrillazione ventricolare) è la causa di morte cardiaca improvvisa nel 60% dei casi. Altre cause sono rappresentate da bradiaritmie, fenomeni tromboembolici, o, eccezionalmente, la rottura di un aneurisma cardiaco. L'insufficienza cardiaca congestizia è la causa di morte nel 25-30% dei casi, un'embolia cerebrale o un'embolia polmonare nel 10-15% dei casi. Cause meno frequenti sono volvoli di megacolon sigmoidei dilatati, gravi miocarditi o meningoencefaliti acute nei neonati (infezioni congenite). Miocarditi acute o meningoencefaliti possono essere complicanze opportunistiche in corso di malattia da HIV. La malattia acuta sintomatica si verifica principalmente nei neonati con infezione congenita o nei bimbi piccoli. Il megaesofago colpisce più spesso nella II decade di vita, la cardiopatia chagasica cronica e il megacolon più tardi (III-IV-V decade di vita).
Il vettore
[modifica | modifica wikitesto]
Vettori sono le cimici triatomine (ordine degli Emitteri, sottofamiglie Reduviidae e Triatominae) che prendono nomi diversi a seconda dei luoghi:
- Barbeiros in Brasile
- Vinchucas in Argentina, Uruguay, Paraguay, Bolivia, Cile
- Chipos in Perù, Venezuela, Colombia
- Chinches in America centrale e Messico
- Kissing bugs negli USA
Appartengono sostanzialmente a tre generi:
- Triatoma spp.
- Rhodnius spp.
- Panstrongylus spp.
Le triatomine possono essere classificate secondo le caratteristiche comportamentali in:
- specie esclusivamente domiciliari (Triatoma infestans, Triatoma rubrofasciata, Rhodnius prolixus)
- specie per lo più domiciliari e peridomiciliari che si possono incontrare in ambiente silvestre (Triatoma dimidiata, Panstrongylus megistus e altre)
- specie prevalentemente silvestri con incursioni peridomiciliari (R. neglectus e altre)
- specie fondamentalmente silvestri, accidentalmente incontrate in ambiente peridomiciliare (P. geniculatus e altre)
- specie esclusivamente silvestri (Psammolestes spp., Cavernicola spp. e altre).
Le tre specie di vettore più importanti sono:
Triatoma infestans è responsabile di più della metà delle infezioni a sud del bacino amazzonico. È molto bene adattata all'ambiente domestico rurale del Sudamerica.
Rhodnius prolixus si trova in Centro America e a nord del bacino amazzonico (Venezuela e Colombia).
Triatoma dimidiata si trova dal Messico al Perù, alla Colombia, all'Ecuador e lungo la costa del Pacifico.
Le altre specie domestiche e quelle selvatiche sono meno importanti.
Ciclo vitale del tripanosoma
[modifica | modifica wikitesto]
Le triatomine si annidano nelle crepe e negli interstizi delle pareti delle abitazioni rustiche, di capanne costruite con fango e legname. Stanno nascoste durante il giorno ed escono la notte per nutrirsi di sangue umano o di altri mammiferi.
Durante il pasto ematico defecano sulla pelle dell'uomo (in Brasile vengono chiamate barbeiros perché prediligono il volto delle persone come zona di attacco). I tripomastigoti metaciclici, presenti nelle feci e frutto dell'infezione precedentemente contratta, passano facilmente attraverso le mucose (es. congiuntiva), oppure attraverso soluzioni di continuità della pelle prodotte del grattamento in seguito al prurito provocato dalla puntura dell'insetto.
Nel circolo ematico, i tripomastigoti invadono le cellule del sistema reticolo-endoteliale (i macrofagi), perdono il flagello e diventano amastigoti intracellulari. Dopo una latenza di 20-35 ore, gli amastigoti cominciano una divisione binaria che si ripete ogni 12-14 ore, invadendo cellule adipose e muscolari vicine al sito di penetrazione. Quando le cellule sono sature di parassiti, gli amastigoti rompono la cellula e si differenziano in tripomastigoti che, muovendosi con il flagello e la membrana ondulante vengono rilasciati in circolo, liberi di invadere altre cellule. Prediligono quelle del sistema reticolo-endoteliale, quelle muscolari striate (in particolare del miocardio) e quelle del sistema nervoso autonomo e centrale. In esse penetrano attivamente mediante recettori porino-simili, tornano al morfotipo di amastigote intracellulare e si moltiplicano con formazione di pseudo cisti, provocando la distruzione degli elementi cellulari parassitari. I tripomastigoti non si moltiplicano nel circolo ematico, a differenza dei tripanosomi africani. I tripomastigoti presenti nel sangue possono essere assunti dal vettore (sono ematofagi sia le femmine sia i maschi e le ninfe delle triatomine) durante la puntura. Giunti nell'ampolla rettale dell'insetto si trasformano in epimastigoti metaciclici infettanti che, attraverso le feci, arrivano al nuovo ospite. L'infezione dell'insetto continua per tutta la vita e può essere trasmessa anche ad altre triatomine per coprofagia e per cannibalismo.
Modalità di trasmissione
[modifica | modifica wikitesto]- Vettoriale: la più importante, dalla triatomina, responsabile dell'80% circa delle infezioni con un meccanismo contaminativo, dal momento che l'insetto è solito defecare mentre assume il pasto di sangue.
- Trasfusionale: responsabile del 15% circa delle infezioni, soprattutto nelle città (il rischio di infezione dopo essere stato trasfuso con sangue infetto è del 20% circa).
- Verticale (materno-fetale): si verifica nel 2-10% dei casi di donne gravide infette (a differenza che nella toxoplasmosi, il passaggio si può verificare a ogni gravidanza, sia nella fase acuta sia nella fase cronica dell'infezione), per via trans-placentare, quasi sempre dopo il terzo mese di gestazione, nella maggior parte dei casi senza conseguenze sull'evoluzione della gravidanza. Si può avere una forma clinica di malattia di Chagas congenita, che, senza trattamento, porta a morte nel 5-10% dei casi. La trasmissione attraverso il latte è possibile ma è rara.
- Alimentare: rara, si verifica in Amazzonia, con l'ingestione di alimenti contaminati dalle feci delle triatomine (carne poco cotta di animali selvatici, succo di canna da zucchero contaminato).
- Post-trapianto (rene, cuore, midollo osseo).
- Accidentale (incidenti di laboratorio).
Serbatoi animali
[modifica | modifica wikitesto]Solo i mammiferi sono suscettibili all'infezione da T. cruzi e sono ospiti definitivi.
- Il ciclo selvatico è mantenuto da circa 150 specie di mammiferi appartenenti a 7 ordini diversi, tra i quali il gambà (Didelphis marsupialis), il bradipo (tatù o bicho preguiça), i piccoli formichieri del genere tamandua, l'armadillo, i pipistrelli, felini selvatici, i conigli venezuelani, vari piccoli roditori e varie piccole scimmie. Sembra che tra i serbatoi selvatici ci siano anche opossum e procioni, che si possono trovare in Nord America.
- Nel ciclo domestico possono essere serbatoio cani, gatti, topi, criceti e conigli.
Suini, ovini, bovini ed equini hanno parassitemie transitorie e non hanno un ruolo importante nel mantenimento del ciclo. Benché non vengano infettati, i polli rappresentano un'importante fonte di pasti ematici per le triatomine, che abbondano nei dintorni dei pollai.
Clinica
[modifica | modifica wikitesto]Incubazione
[modifica | modifica wikitesto]La malattia segue un periodo di incubazione di una settimana circa nella trasmissione vettoriale e di 20-40 giorni circa nella trasmissione post-trasfusionale, che è più lunga perché i tripanosomi circolanti sono meno infettanti delle forme metacicliche dell'insetto.
Forme acute
[modifica | modifica wikitesto]Forma acuta classica
[modifica | modifica wikitesto]
La fase acuta di disseminazione della malattia nella maggior parte dei casi decorre in modo inapparente o paucisintomatico e si manifesta più spesso nei bambini.
Il parassita si moltiplica nei macrofagi presenti nel punto di entrata e poi si propaga a tutto l'organismo per via ematica e linfatica, con un periodo di alta parassitemia che dura 1-2 mesi.
Nel punto di entrata del protozoo compare il cosiddetto chagoma, una lesione cutanea rosso-violacea, foruncoloide, edematosa, ricca di tripanosomi in moltiplicazione attiva all'interno dei macrofagi. Il parassita si propaga per via linfatica locale con comparsa di linfoadenite satellite.
Se la porta di entrata è la mucosa congiuntivale si ha il cosiddetto segno di Romaña o complesso oftalmo-linfonodale, che consiste in un edema bipalpebrale monolaterale, indolore, con congestione ed edema congiuntivale e linfoadenite pre-auricolare. È presente nel 20-50% dei casi e persiste per 30-60 giorni. Si può avere contemporaneamente una dacrioadenite (infiammazione della ghiandole lacrimali), detta segno di Mazza-Benìtez.
Possono aversi sintomi e segni di una tipica malattia infiammatoria sistemica:
- febbre
- mialgie
- linfoadenopatia generalizzata
- epato-splenomegalia
- ipertermia (intermittente, remittente o continua)
- rash eritematosi
- insonnia
- dispnea
- disturbi gastroenterici (anoressia, nausea, diarrea)
- disturbi respiratori (bronchite)
La forma acuta è raramente fatale (<5% sotto i 2 anni): i decessi si hanno più comunemente nei lattanti e negli immunodepressi che si infettano dopo trapianto di organi solidi (altra via di contagio), per la comparsa di una meningoencefalite diffusa o di una miocardite fulminante.
Cardiopatia chagasica acuta
[modifica | modifica wikitesto]È una miocardite acuta che è clinicamente evidente in meno del 5% dei casi, di solito nei casi pediatrici in aree endemiche. La maggior parte delle volte è lieve e reversibile. Si hanno tachicardia e turbe della ripolarizzazione ventricolare, basso voltaggio del complesso QRS, ischemia sub-epicardica, blocchi atrio ventricolari di vario grado. Si possono avere anche altre manifestazioni cardiache, conseguenza di una vera e propria pancardite (epicardite, miocardite ed endocardite), che può evolvere in insufficienza cardiaca congestizia; la morte può anche sopravvenire in pieno benessere per fibrillazione ventricolare o tromboembolia acuta. Le più comuni anomalie elettrocardiografiche nella fase acuta sono la tachicardia sinusale, l'allungamento del tratto P-R, il sottoslivellamento del tratto S-T e l'inversione dell'onda T, il basso voltaggio del complesso QRS, e l'allungamento del tratto Q-T (segni di miocardite acuta).
Forme congenite
[modifica | modifica wikitesto]L'infezione intrauterina può dare aborto spontaneo o parto prematuro. Nella forma acuta, la malattia di Chagas congenita ricorda la malattia acquisita: insorge alla nascita o qualche mese dopo. Il neonato può presentare basso peso alla nascita, epato-splenomegalia, ittero, anemia, febbre o meningoencefalite con convulsioni, ipotonia muscolare, iporiflessia e tremori. Alcuni presentano chagomi metastatici emorragici, su cute e mucose. Sono state descritte calcificazioni intracraniche e lesioni oculari. Il coinvolgimento cardiaco è raro, mentre anomalie gastrintestinali (megaesofago) possono causare morte per polmonite ab ingestis. La morte spesso si verifica nelle prime settimane di vita e quelli che sopravvivono presentano gravi sequele neurologiche, deficit mentale, comportamentale e difficoltà nell'apprendimento.
Forme croniche
[modifica | modifica wikitesto]In meno del 5% dei casi c'è un passaggio diretto dalla forma acuta a una forma cronica sintomatica.
Forma indeterminata
[modifica | modifica wikitesto]La forma acuta di malattia di Chagas di solito regredisce spontaneamente dopo 3-8 settimane e viene seguita da un periodo asintomatico che, nel 50-70% circa dei casi, dura tutta la vita e durante il quale il parassita sparisce dal circolo ematico o vi permane a bassissima parassitemia. Questo periodo corrisponde alla forma cronica di malattia di Chagas detta indeterminata. La guarigione definitiva spontanea è eccezionale: i pazienti restano sieropositivi, infetti e contagiosi ma non hanno alcun segno manifesto di malattia, né clinico, né elettrocardiografico, né radiologico.
La forma indeterminata è la forma cronica più comune nelle popolazioni endemiche e pone importanti problemi di salute pubblica, di diagnosi e di prognosi, poiché gli individui affetti sono asintomatici e possono condurre una vita del tutto normale, ma, pur essendo apparentemente sani, possono sviluppare forme croniche clinicamente evidenti in qualsiasi momento e, pertanto, vanno sottoposti a regolare monitoraggio clinico e strumentale. Ogni anno circa il 3% di questi pazienti sviluppa una patologia chagasica clinicamente determinata; inoltre questi sono individui ancora contagiosi, quindi vanno indiscutibilmente esclusi dalla donazione di sangue ed emoderivati.
Una forma cronica determinata clinicamente evidente di solito si manifesta dopo 10-20 anni dall'infezione.
Cardiopatia chagasica cronica
[modifica | modifica wikitesto]La più comune delle forme determinate insorge nel 30% circa degli individui infetti, soprattutto maschi. È la forma con la maggiore morbidità e mortalità ed è quella che influisce più pesantemente sulla qualità della vita del paziente. Si ha un progressivo deterioramento del tessuto miocardico, con evoluzione inesorabile verso l'insufficienza di pompa, a volte anticipata dalla morte cardiaca improvvisa del paziente per l'insorgenza di un'aritmia fatale. In Brasile la cardiopatia cronica colpisce il 25-30% degli individui infetti, 1/5 dei quali (il 5% del totale) sono destinati a morirne.
L'insufficienza cardiaca congestizia, quando si manifesta, è solitamente difficile da trattare e da controllare. Prevalgono le manifestazioni congestizie (cuore destro) su quelle da insufficienza di pompa (cuore sinistro). Si hanno dispnea da sforzo, edema periferico, ascite, fegato da stasi, dolore toracico, e palpitazioni. Di solito non evolve in edema polmonare acuto. Le complicazioni più frequenti sono l'embolizzazione sistemica e polmonare e la morte cardiaca improvvisa, per aritmie fatali. Pertanto rispetto ai pazienti affetti da cardiomiopatia dilatativa di altra natura (ipertensiva, ischemica, idiopatica), quelli affetti dalla forma chagasica hanno una prognosi peggiore.
Le più comuni anomalie elettrocardiografiche nella fase cronica sono i blocchi intraventricolari (blocco di branca destra ed emiblocco anteriore sinistro), bradicardia sinusale, blocchi atrio-ventricolari di vario grado, blocco seno-atriale, fibrillazione atriale, aritmie ventricolari (extrasistoli polimorfe, tachicardia ventricolare fino alla fibrillazione ventricolare), conseguenze del danno al tessuto di conduzione.
Patogenesi
[modifica | modifica wikitesto]Durante la fase acuta della malattia si ha un'imponente moltiplicazione del tripanosoma nelle fibre muscolari cardiache, soprattutto nelle fibre del sistema di conduzione atrio-ventricolare a formare nidi di cellule amastigoti. Le alterazioni comprendono ispessimento delle pareti ventricolari, dilatazione biventricolare, aneurismi apicali e trombi murali. La patogenesi della conseguente miocardite acuta è da attribuire alla reazione cellulo-mediata nei confronti delle fibre muscolari cardiache, sia contro quelle parassitate sia contro quelle sane, contro le cellule degli endoteli capillari del miocardio e contro le fibre del sistema nervoso autonomo intracardiaco. La localizzazione degli amastigoti nel miocardio e la liberazione in questa sede di antigeni protozoari, che si legano alle cellule vicine e diventano bersaglio della risposta immunitaria umorale e cellulare contro T. cruzi, provocano una miocardite interstiziale autoimmune. L'organismo diventa incapace di controllare le risposte antiself e i danni che ne derivano sono proporzionali alla concentrazione di autoanticorpi prodotti (tachicardia, insufficienza cardiaca, che può portare all'arresto cardiaco in poche settimane o mesi dall'infezione). Incomincia anche un processo di distruzione dei gangli del SNA e, talvolta, di quello centrale, responsabile delle sindromi che si possono osservare successivamente, durante la fase cronica. La flogosi regredisce quasi del tutto quando il sistema immunitario giunge a controllare la replicazione del protozoo e a ridurne drasticamente la carica.
Nella fase di malattia cronica, anche asintomatica, persiste uno stato di minima infiammazione con foci di flogosi miocardica che poi regrediscono, ma che sono seguiti dalla comparsa di nuovi altri focolai. Si mantiene un equilibrio dinamico tra il sistema immunitario dell'ospite e il parassita, in virtuale assenza di segni e sintomi. Tuttavia persiste una miocardite diffusa con un danno progressivo, più o meno rapido, ma sostanzialmente inarrestabile, che può precipitare in qualsiasi momento in una forma clinicamente sintomatica, che evolve verso la cardiomiopatia dilatativa e l'insufficienza cardiaca.
È stato anche ipotizzato un meccanismo patogenetico di tipo autoimmune umorale con produzione di anticorpi diretti contro antigeni del tessuto cardiaco: T. cruzi condividerebbe antigeni con il miocardio. Il fatto spiegherebbe il continuo danno alle fibre muscolari del miocardio anche nella fase cronica quando i nidi di amastigoti sono pochissimi. L'entità del danno miocardico rende conto dei disturbi della conduzione atrio-ventricolare e intra-ventricolare e delle aritmie atriali e ventricolari.
Anatomia patologica
[modifica | modifica wikitesto]Si ha il reperto istopatologico di miocardite cronica e attiva, con necrosi microfocale e disseminata, con densi focolai di fibrosi interstiziale confluente che tende a disorganizzare la struttura delle fibre muscolari cardiache e a coinvolgere il sistema contrattile e di conduzione. Nello spazio interstiziale è presente un infiltrato cellulare infiammatorio misto di granulociti, linfociti, monociti, macrofagi, mastocellule e plasmacellule. Durante la fase cronica le cellule ganglionari del sistema di conduzione e le fibre miocardiche vengono progressivamente distrutte; la funzionalità cardiaca comincia a essere compromessa quando il 20% circa dei neuroni vengono distrutti, mentre la funzionalità esofagea è sufficiente anche con l'80% dei neuroni non funzionanti.
Nelle fasi precoci della cardiopatia cronica, il cuore può essere di dimensioni normali o solo lievemente aumentate, ma successivamente si può raggiungere una notevole cardiomegalia. Macroscopicamente il cuore chagasico cronico è ipotonico con pareti assottigliate, soprattutto a livello dell'atrio destro. In più della metà dei casi si forma un aneurisma del segmento apicale del ventricolo sinistro (aneurisma vorticoso della punta), oppure del setto interventricolare, che raramente si rompe: è un reperto patognomonico e un segno prognostico sfavorevole di malattia di Chagas nelle zone endemiche. Non è responsabile dell'insorgenza dell'insufficienza ventricolare, ma può provocare aritmie e fenomeni tromboembolici anche fatali. Si formano trombi murali nelle camere cardiache soprattutto in presenza di fibrillazione atriale e si possono avere embolie cerebrali, spleniche, renali, e polmonari.
Malattia chagasica digestiva cronica
[modifica | modifica wikitesto]Il 10% circa dei pazienti chagasici sviluppa una forma cronica digestiva, che consiste in una disfunzione motoria che può coinvolgere virtualmente qualsiasi segmento del tubo digerente, ma colpisce soprattutto esofago e colon.
- Patogenesi
La forma digestiva consegue alla distruzione dei plessi nervosi intrinseci (sottomucoso di Meissner e mioenterico di Auerbach) del sistema autonomo del tubo digerente, con un meccanismo autoimmunitario di tipo cellulo-mediato simile a quello responsabile del danno cardiaco con conseguente denervazione e fibrosi. Si ha una discinesia del segmento denervato, con scoordinamento motorio e acalasia, per ipertonia degli sfinteri che non si rilasciano più e provocano dilatazioni, allungamento e ipertrofia dei visceri a monte, soprattutto nei segmenti dove si sviluppano le pressioni maggiori e nei quali il contenuto è più solido (esofago e colon). Il transito esofageo e intestinale viene rallentato fino all'arresto.
- Megaesofago
Più spesso è colpito l'esofago (megaesofago) con disfagia, odinofagia, rigurgito, singhiozzo, tosse, dolore toracico e addominale, disturbi della deglutizione. Si possono avere complicazioni: severa malnutrizione, bronchiti irritative da aspirazione, polmoniti ab ingestis. Il 25% dei pazienti con megaesofago chagasico sviluppano un'ipertrofia delle ghiandole salivari (soprattutto le parotidi), con scialorrea. Il decorso della malattia è tipicamente lento; si può complicare con neoplasie esofagee e gastriche.
- Megacolon
La colopatia e il megacolon sono a insorgenza più tardiva. Il sigma è il tratto più spesso colpito. Il sintomo principale è una lenta e progressiva stitichezza. La maggior parte dei pazienti con megacolon vanno di corpo una volta alla settimana circa.
- Megavisceri
Possono aversi anche megacolecisti e megacoledoco, con particolare tendenza alla colelitiasi. Il megaduodeno di solito è asintomatico, ma può provocare dispepsia, nausea e vomito, e, raramente, malnutrizione.
Malattia chagasica dell'immunodepresso
[modifica | modifica wikitesto]Nell'immunodepresso e nel paziente affetto dall'AIDS, la malattia di Chagas cronica si può riattivare in forma di:
- Meningoecefalite acuta diffusa.
- Lesione ascessuale encefalica, radiologicamente indistinguibile dalla neuro-toxoplasmosi o dal linfoma cerebrale primitivo.
- Forme flogistiche digestive.
- Miocardite acuta con ricomparsa di parassitemia.
Diagnosi
[modifica | modifica wikitesto]Esami bioumorali
[modifica | modifica wikitesto]Nella forma acuta si possono avere leucocitosi con linfocitosi relativa. La transaminasemia è spesso elevata. La rachicentesi mostra pleocitosi con una prevalenza di linfociti, aumento della protidorrachia e spesso si può incontrare il T. cruzi.
Esami microbiologici
[modifica | modifica wikitesto]
Nelle prime 6-12 settimane (fase acuta), si possono vedere i tripomastigoti nell'esame a fresco della goccia di sangue (ingrandimento x400): si vedono i rapidi movimenti dei tripomastigoti. Al microscopio si devono valutare almeno 100 campi prima di dare per negativo l'esame. Lo striscio sottile e la goccia spessa di sangue periferico colorati (colorazione di Giemsa) hanno minore sensibilità, ma permettono una migliore distinzione tra T. cruzi e T. rangeli, infatti quest'ultimo è più lungo (25–35 μm) e ha un cinetoplasto più piccolo. L'esame QBC dopo concentrazione con centrifugazione dopo lisi degli eritrociti o defibrinizzazione aumenta la sensibilità fino al 90-100%.
Nella fase cronica la parassitemia è bassissima, perciò gli esami emoscopici risultano quasi sempre negativi. Per confermare la diagnosi si esegue la xenodiagnosi oppure l'emocoltura. I parassiti nel sangue vanno coltivati su un terreno speciale (liver infusion tryptose, LIT) mantenuto a 28 °C e osservato mensilmente per 4-6 mesi. Le emocolture hanno una sensibilità del 100% nella fase acuta ma solo del 20-70% nelle fasi croniche.
Xenodiagnosi
[modifica | modifica wikitesto]La xenodiagnosi è il miglior sistema di diagnosi parassitologica nelle fasi indeterminata e cronica. Si lascia che una quarantina di ninfe di triatomine al III-IV stadio, allevate in laboratorio e pertanto sane, chiuse in 4 scatole (10 per scatola), succhino il sangue dal braccio del paziente. Ultimamente si è adottata la xenodiagnosi artificiale: 10 mL di sangue nel paziente in un contenitore coperto da una membrana attraverso la quale viene succhiato dalle ninfe. Le feci e l'intestino delle ninfe vengono sacrificate ed esaminate 30-45-60 giorni dopo, per la ricerca dei tripomastigoti metaciclici. Il test ha una sensibilità del 50%.
Diagnosi sierologica
[modifica | modifica wikitesto]I test sierologici che ricercano IgM anti–T. cruzi sono attualmente di impiego limitato nella diagnosi perché non sono facilmente disponibili e non sono standardizzati. Nelle infezioni recenti, le IgM compaiono in circolo 15 giorni dopo l'infezione, con un picco dopo 17-45 giorni e persistono per anni. Le IgM prevalgono nella fase acuta. Nelle fasi indeterminata e cronica prevalgono le IgG e le IgA.
Tra gli esami disponibili, il test di fissazione del complemento (CF) di Machado-Guerreiro è considerato il più fattibile. L'immunofluorescenza indiretta (IFA) è rapida e facile da eseguire, molto sensibile e può distinguere IgM da IgG: è la più precoce nell'evidenziare la positività per IgM dopo l'infezione iniziale seguita dall'emagglutinazione diretta (DA). Questi test hanno una sensibilità superiore al 95%. Per la diagnosi delle forme congenite è stato introdotto un test di immunofluorescenza indiretta per la ricerca delle IgM.
L'Enzyme-linked immunosorbent assay (ELISA) è come l'IFA molto sensibile e può distinguere IgM da IgG. I test di agglutinazione sono l'emagglutinazione indiretta (IHA), l'emagglutinazione diretta (DA), l'agglutinazione al lattice (Latex Agglutination, LA) e il test di flocculazione.
Un problema notevole è quello dei falsi positivi, che possono aversi in caso di leishmaniosi, malaria, sifilide, mononucleosi infettiva, tubercolosi, lebbra, connettiviti e vasculiti o in caso di infezione da T. rangeli.
È sempre consigliato l'impiego di almeno due tecniche sierologiche differenti per la conferma della diagnosi di infezione.
Biologia molecolare
[modifica | modifica wikitesto]Il test di ricerca del DNA dal cinetoplasto di T. cruzi con l'amplificazione mediante reazione a catena della polimerasi (polymerase chain reaction o PCR), può evidenziare la presenza di 1 tripanosoma in 20 mL di sangue con una sensibilità del 96-100%.
Diagnosi delle forme congenite
[modifica | modifica wikitesto]La madre deve essere sieropositiva per T. cruzi. Deve essere reperibile il T. cruzi nel sangue del cordone ombelicale. Presenza di IgM specifiche nel siero subito dopo la nascita, o di IgG dopo 6 mesi, in assenza di trasmissione vettoriale, trasfusionale od orale.
Diagnostica per immagine
[modifica | modifica wikitesto]Radiologia tradizionale
[modifica | modifica wikitesto]La radiografia standard del torace, nella cardiopatia chagasica può evidenziare la cardiomegalia; nei pazienti con patologia esofagea avanzata può mostrare una formazione tubulare vicino all'aorta toracica, con livello idroaereo (megaesofago).
L'esame contrastografico dell'esofago con pasto di bario mostra la dilatazione esofagea, che termina con un notevole restringimento a livello dello sfintere esofageo inferiore (lower esophageal sphincter - LES) che risulta contratto (aspetto a coda di topo). La radioscopia mostra le contrazioni terziarie e l'accumulo del mezzo di contrasto a monte del LES.
La classificazione radiografica della patologia esofagea distingue diversi stadi:
- Stadio I: il lume esofageo è di diametro normale; il riempimento è ritardato. L'esofago può essere ipercinetico.
- Stadio II: il lume esofageo è dilatato (megaesofago) e la motilità è irregolare. Il LES è ipertonico.
- Stadio III: la dilatazione e la ritenzione somo importanti e la motilità è chiaramente ridotta.
- Stadio IV: l'esofago è chiaramente dilatato e allungato (dolicomegaesofago) e atonico.
Nella patologia colica il clisma opaco mostra la dilatazione e l'allungamento del sigma in quasi tutti i casi (dolico-megasigma), e la dilatazione del retto nell'80% dei casi.
Ecocardiografia
[modifica | modifica wikitesto]È una metodica utile nello studio anche precoce della cardiopatia. Evidenzia la presenza degli aneurismi ventricolari, delle trombosi intarcardiache, delle ipocinesie e delle disfunzioni ventricolari. In fase acuta possono vedersi versamenti pericardici.
Prognosi
[modifica | modifica wikitesto]La prognosi dipende dalla forma della malattia, dal suo stadio e dalle sue complicanze. La fase acuta è più pericolosa nei bimbi < 2 anni, quando la malattia è quasi sempre fatale nei casi di miocardite e meningoencefalite. La cardiopatia cronica clinicamente manifesta ha una prognosi scarsa e di solito la morte sopravviene entro 5 anni per scompenso cardiaco o embolia polmonare. Il blocco di branca destra è un pessimo segno nella fase acuta. La prognosi delle forme digestive è per lo più benigna.
Terapia
[modifica | modifica wikitesto]Terapia eziologica
[modifica | modifica wikitesto]Sono discussi i benefici del trattamento eziologico delle forme indeterminate o croniche. Attualmente si consiglia di trattare i bambini e tutti i pazienti con infezione che dura da meno di 10 anni. Le percentuali di guarigione in questo gruppo di pazienti raggiunge il 50-60%, mentre nei pazienti con infezione che dura da più di 10 anni le percentuali di guarigione raggiungerebbero l'8-25%. Le forme acute e congenite della malattia di Chagas si possono trattare con due farmaci antiprotozoari:
Benznidazolo
[modifica | modifica wikitesto]Il benznidazolo cura praticamente il 100% dei bimbi con meno di 2 anni e il 60-70% dei pazienti con infezione acuta. Gli insuccessi sono dovuti alla eventuale resistenza al benznidazolo, alla carica parassitaria, o a cause ignote. È un composto imidazolico che inibisce la sintesi degli acidi nucleici ed è più tripanocida del nifurtimox. Agisce sulle forme circolanti e su quelle intracellulari.
Dose nell'adulto: 5–10 mg/kg/die per os diviso bid per 60 giorni. Dose pediatrica: come per l'adulto.
Un follow-up a lungo termine di pazienti con malattia di Chagas cronico, trattati con benznidazolo, avrebbe rivelato una significativa riduzione nell'incidenza di anomalie elettrocardiografiche, del peggioramento clinico e dei titoli sierologici.
Il farmaco non va impiegato in gravidanza ed è relativamente controindicato nelle insufficienze epatiche e renali, nelle malattie neurologiche o ematologiche.
Gli effetti collaterali più comuni comprendono fotosensibilizzazione cutanea, cefalea, polineuriti periferiche, anoressia, nausea, calo ponderale, astenia, alterazioni ematologiche (es. neutropenia, agranulocitosi, trombocitopenia). Alcuni autori hanno inoltre descritto potenziali effetti cancerogeni. Le reazioni cutanee (dermatiti da ipersensibilità immediata) compaiono 5-18 giorni dopo il trattamento, a volte con edema generalizzato, febbre, linfadeniti, artralgie, e mialgie; la terapia con corticosteroidi permette la prosecuzione del trattamento antiprotozoario. Le polineuriti periferiche (a volte irreversibili, a meccanismo ignoto) appaiono tardivamente, dopo almeno 30 giorni di trattamento.
Nifurtimox
[modifica | modifica wikitesto]Il nifurtimox accorcia la durata della fase acuta e riduce la mortalità della miocardite e della meningoencefalite. Interferisce con il metabolismo glucidico del tripanosoma inibendo la sintesi dell'acido piruvico. Per il nifurtimox è riportata un'efficacia del 75-90%; tuttavia in Brasile non sembra essere altrettanto efficace.
Dose nell'adulto: 8–10 mg/kg/die per os diviso tid/qid per 120 giorni Dose pediatrica: <10 anni: 15–20 mg/kg/ die per os diviso tid/qid per 90-120 giorni 11-16 anni: 12,5–15 mg/kg/ die per os diviso tid/qid per 90-120 giorni Non va impiegato in gravidanza. Gli effetti collaterali più comuni comprendono astenia, anoressia, nausea, vomito, dolore addominale. Meno comuni rash cutanei, epatiti tossiche, disturbi neurologici centrali e periferici (es. perdita di memoria, tremori, insonnia, disorientamento, polineuriti, parestesie, convulsioni). Può aversi emolisi nei pazienti con deficienza di glucosio 6-fosfato-deidrogenasi (favismo). I bambini tollerano il farmaco meglio degli adulti. Nifurtimox e l'alfa-interferone ricombinante sono stati impiegati con successo in bambini infettati con trasfusioni e in tecnici di laboratorio infettati accidentalmente. L'alfa-interferone potrebbe migliorare l'attivazione dei macrofagi che uccidono il protozoo.
Antifungini
[modifica | modifica wikitesto]Il ketoconazolo (400 mg/die per 70 giorni) sembra essere efficace nella cura delle riattivazioni della malattia negli immunodepressi. In questi casi sono stati impiegati anche l'itraconazolo (400 mg/die) e il fluconazolo (400 mg/die).
Monitoraggio terapeutico
[modifica | modifica wikitesto]La terapia in fase acuta ottiene quasi immediatamente la soppressione della parassitemia. La guarigione parassitologica è quasi impossibile da accertare: alcuni autori richiedono una completa negativizzazione parassitologica e sierologica, altri ammettono bassissimi titoli sierologici e puntano alla guarigione clinica, valutabile con esame obiettivo, ECG e diagnostica per immagini.
Infezione accidentale
[modifica | modifica wikitesto]Il personale di laboratorio che lavora con T. cruzi e si punge con aghi infetti, ingerisce materiale infetto o ha un contatto attraverso lesioni cutanee o mucose, è da considerare potenzialmente infetto. In questi casi si eseguono test sierologici e si inizia il trattamento per 10-15 giorni, ripetendo le sierologie 15, 30, e 60 giorni dopo l'incidente.
Terapia cardiologica
[modifica | modifica wikitesto]Le aritmie si controllano con farmaci antiaritmici. Le bradiaritmie e la fibrillazione atriale con bassa risposta ventricolare possono richiedere un pacemaker permanente se sono sintomatiche. Nel trattamento dello scompenso cardiaco sembrano non essere ben tollerati la digitale e i farmaci vasoattivi, che vanno somministrati con cautela. I diuretici sono più efficaci. La problematica principale è però legata alle aritmie ventricolari. La malattia di Chagas sviluppa frequentemente un substrato aritmogeno a livello della parete inferobasale del ventricolo sinistro, tipicamente nella zona di watershed tra circolazione terminale della coronaria destra e della arteria circonflessa. Il substrato è caratterizzato da un circuito di rientro che si viene a formare tra il tessuto miocardico anisotropo e dalla fibrosi/scar densa. Spesso una porzione dell'anulus mitralico ne è coinvolta comportandosi da barriera anatomica. L'istmo critico e l'exit-point del circuito sono spesso a livello epicardico, questo è dimostrato anche dal fatto che la tachicardia ventricolare (TV) tipica della malattia di Chagas presenta morfologia a blocco di branca destra ed asse inferiore (suggestivo di localizzazione infero-basasale del ventricolo sinistro) e slargamento del QRS (suggestivo di exit-point epicardico). La ablazione transcatetere con accesso epicardico, introdotta dal Professor Edoardo Sosa nel 1996, si è rivelata efficace nel trattare la maggior parte di aritmie ventricolari della malattia di Chagas. Questo è stato anche dimostrato da un trial randomizzato pubblicato su Heart Rhythm nel 2020, dove sono stati randomizzati 30 pazienti a mappaggio ed ablazione esclusivamente endocardica versus mappaggio ed ablazione sia endo- che epicardica. I pazienti randomizzati al secondo gruppo avevano nella maggior parte dei casi risoluzione della TV e significativamente un minor numero di recidive. In alcuni casi il substrato contrae rapporti anatomici con l'arteria circonflessa o la coronaria destra che non ne permettono una procedura di ablazione. Questi pazienti sperimentano frequentemente recidive di TV refrattarie alla terapia antiaritmica. Sono in corso di studio alcuni approcci di bailout come la denervazione delle arterie renali e la simpatectomia cardiaca bilaterale come meccanismi per ridurre/abolire le recidive di eventi aritmici.
Terapia gastroenterologica
[modifica | modifica wikitesto]La terapia della malattia esofagea è la stessa dell'acalasia idiopatica. Lo scopo è di facilitare il transito di cibo e liquidi attraverso il LES acalasico. Dieta ristretta a cibi soffici o terapia con anticolinergici sono di scarsa utilità. Nifedipina o isosorbide dinitrato sublinguale preso prima dei pasti può dare sollievo nei pazienti con esofago non dilatato. La maggior parte dei pazienti con megaesofago sintomatico hanno beneficio dalla dilatazione meccanica del LES. Si hanno recidive nel 26% dei pazienti, che possono essere di nuovo trattati con altre dilatazioni. La terapia chirurgica è riservata per i casi più gravi, quando la dilatazione meccanica non ha più effetto e consiste in una esofago-cardiomiotomia secondo Thal[non chiaro], a livello della giunzione gastroesofagea anteriore, seguita da valvuloplastica per il controllo del reflusso gastrico.
I pazienti nelle prime fasi della malattia colica possono essere controllati con diete ricche di fibre e liquidi o con lassativi, occasionalmente con clisteri. L'ingombro fecale può richiedere la disostruzione manuale. I fecalomi si trattano con clisteri e lavaggi. Nei casi più gravi è necessario lo svuotamento manuale in anestesia generale. Lo svuotamento endoscopico si può fare nei pazienti che non abbiano segni di ischemia intestinale. I casi più gravi richiedono l'intervento chirurgico (es. frequente ingombro fecale, volvolo del sigma), che consiste nella resezione del sigma o di parte del retto (necessaria per prevenire recidive di megacolon nella porzione anastomizzata con il retto).
Profilassi
[modifica | modifica wikitesto]Non esiste vaccino attualmente impiegabile su larga scala e non si fa chemioprofilassi (tossicità farmacologica).
Profilassi ambientale
[modifica | modifica wikitesto]Disinfestazione domiciliare e peridomiciliare dalle triatomine, con insetticidi piretroidi o benzene esacloride. Chiudere le crepe nelle pareti e controllare porte e finestre delle case rurali, per limitare la penetrazione delle triatomine. Miglioramento delle condizioni socio-economiche delle popolazioni a rischio.
Profilassi su donatori e sugli emoderivati
[modifica | modifica wikitesto]Controllo dei donatori di sangue nelle aree endemiche con test sierologici. Trattamento del sangue e degli emoderivati con il violetto di genziana: 250 mg/L di sangue, diluito 1:4000 per 24 ore a 4 °C).
Profilassi negli immunodepressi
[modifica | modifica wikitesto]La chemioprofilassi secondaria può essere consigliata, per prevenire la riattivazione delle forme croniche, nei pazienti chagasici co-infettati con HIV o in terapia immunosuppressiva (leucemia, linfomi, neoplasie solide, trapianti) o corticosteroidea. In tal caso si impiega il benznidazole a 5 mg/kg/die 3 volte/settimana. È stata proposta anche una profilassi a lungo termine nei pazienti che rispondono alla terapia della riattivazione di malattia, ma la questione è ancora discussa.
Note
[modifica | modifica wikitesto]- ^ a b c d e f g h i j k l m n o p q Chagas disease (American trypanosomiasis) Fact sheet N°340, su World Health Organization, marzo 2013. URL consultato il 23 febbraio 2014.
- ^ a b c d Rassi A, Rassi A, Marin-Neto JA, Chagas disease, in Lancet, vol. 375, n. 9723, aprile 2010, pp. 1388-402, DOI:10.1016/S0140-6736(10)60061-X, PMID 20399979.
- ^ a b c d Rassi A Jr, Rassi A, Marcondes de Rezende J, American trypanosomiasis (Chagas disease), in Infectious disease clinics of North America, vol. 26, n. 2, giugno 2012, pp. 275-91, DOI:10.1016/j.idc.2012.03.002, PMID 22632639.
- ^ DPDx – Trypanosomiasis, American. Fact Sheet, su cdc.gov, Centers for Disease Control (CDC). URL consultato il 12 maggio 2010.
- ^ Maudlin I, Holmes PH, Miles MA (a cura di), The Trypanosomiases, Wallingford, CAB International, 2004, p. 184, ISBN 978-0-85199-034-7.
- ^ Bern C, Montgomery SP, Herwaldt BL, etal, Evaluation and treatment of chagas disease in the United States: a systematic review, in JAMA, vol. 298, n. 18, novembre 2007, pp. 2171-81, DOI:10.1001/jama.298.18.2171, PMID 18000201.
- ^ Rassi A, Dias JC, Marin-Neto JA, Rassi A, Challenges and opportunities for primary, secondary, and tertiary prevention of Chagas' disease, in Heart, vol. 95, n. 7, aprile 2009, pp. 524-34, DOI:10.1136/hrt.2008.159624, PMID 19131444.
- ^ Capinera JL (a cura di), Encyclopedia of entomology, 2nd, Dordrecht, Springer, 2008, p. 824, ISBN 978-1-4020-6242-1.
- ^ Bonney KM, Chagas disease in the 21st Century: a public health success or an emerging threat?, in Parasite, vol. 21, 2014, p. 11, DOI:10.1051/parasite/2014012, PMC 3952655, PMID 24626257.
Bibliografia
[modifica | modifica wikitesto]- Adler D. Darwin's illness. Isr J Med Sci. 1989 Apr;25(4):218-21. (Abstract)
- Kirchhoff, LV. American Trypanosomiasis (Chagas' Disease) -- A Tropical Disease Now in the United States. N Engl J Med. 329 (9):639-644, August 26, 1993 (Abstract Archiviato il 21 dicembre 2007 in Internet Archive.)
- Hofflin JM, et al. Laboratory-acquired Chagas disease. Trans R Soc Trop Med Hyg. 1987;81:437-40.
- Coutinho M. Ninety years of Chagas disease: a success story at the periphery. Soc Stud Sci. 1999 Aug;29(4):519-49. Medline abstract
- Dias JC, Silveira AC, Schofield CJ. The impact of Chagas disease control in Latin America: a review. Mem Inst Oswaldo Cruz. 2002 Jul;97(5):603-12 Full text Archiviato il 4 aprile 2015 in Internet Archive.
- Moncayo A. Progress towards Interruption of Transmission of Chagas Disease, 1999, Mem Inst Oswaldo Cruz. 1999; 94(Sup I) 401-404.
- Prata A. Evolution of the clinical and epidemiological knowledge about Chagas disease 90 years after its discovery. Mem Inst Oswaldo Cruz. 1999;94 Suppl 1:81-8. Medline abstract
- Simposio Internazionale per il 90º anniversario della scoperta della malattia di Chagas (Rio de Janeiro, 11-16 aprile, 1999) in Memórias do Instituto Oswaldo Cruz, Vol. 94, Suppl. I, 1999
(Indice del volume, con articoli integrali disponibili in formato PDF)
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su malattia di Chagas
Wikimedia Commons contiene immagini o altri file su malattia di Chagas
Collegamenti esterni
[modifica | modifica wikitesto]- Chagas: the disease. World Health Organization.
- American Trypanosomyasis. CDC Disease Information (US Federal Government public domain).
- Chagas Disease. PanAmerican Health Organization.
- Chagas disease. The UNDP-UNICEF-WHO-World Bank Special Programme of Research (TDR).
- Chagas disease. Medline Plus.
- Disease Information. American Trypanosomiasis or Chagas Disease. Travel Medicine Program. Health Canada.
- Chagas Disease (American Trypanosomiasis. eMedicine.
- Chagas Control in the Southern Cone Countries: History of an International Initiative, 1991/2001, PAHO. (Full text e-book)
- Tropical Medicine Central Resource USUHS [1]
| Controllo di autorità | Thesaurus BNCF 76191 · LCCN (EN) sh85022320 · BNE (ES) XX539884 (data) · J9U (EN, HE) 987007284797905171 · NDL (EN, JA) 00561175 |
|---|









