
La storia dell'industria chimica, in ogni sua fase, dimostra la complessità dell'interazione fra conoscenza e produzione materiale.
I risultati ottenuti dal chimico nell'attività sperimentale, o nella riflessione teorica, richiesero (e richiedono) un'intricata, spesso imprevedibile, mediazione fra il bancone di laboratorio e la realtà industriale.
L'industria chimica inizialmente si è appoggiata alle conoscenze che erano proprie del chimico di laboratorio, ma la successiva industrializzazione dei processi chimici più disparati, mossa dalle continue esigenze del mercato, che richiedevano un quantitativo sempre maggiore di prodotti, ha fatto sì che la figura del chimico si sia successivamente affiancata a quella dell'ingegnere, dell'agronomo, del medico, con un campo di intervento sterminato, che nel corso di due secoli è giunto a pervadere interamente la civiltà industriale, sia negli aspetti produttivi, sia in quelli del vivere quotidiano.
La chimica è per definizione la scienza della trasformazione delle sostanze. La flessibilità dell'industria chimica, pur mantenendo il limite costante della mole degli investimenti immobilizzata negli impianti, è andata crescendo con lo sviluppo stesso delle conoscenze, e si è pienamente dispiegata durante i conflitti economici e militari del XX secolo.
La storia del rapporto fra scienza, chimica, e industria, dimostra che è possibile ottenere i prodotti più disparati a partire da una certa base di materie prime, e che al tempo stesso è possibile giungere agli stessi prodotti utilizzando differenti materie prime; bisogna quindi operare delle scelte sulla tipologia del processo industriale da seguire per ottenere un determinato prodotto, ponderate sulla base di vari fattori, tra cui il fattore economico, il fattore della sicurezza, e il fattore ambientale. Inoltre, l'industria chimica può fornire ad altri settori produttivi, o al consumatore finale, prodotti intrinsecamente "diversi", capaci però di svolgere lo stesso "ruolo" chimico (solventi, detergenti), meccanico (leghe, fibre, colle), energetico (combustibili), estetico (coloranti, cosmetici) o fisiologico (medicinali).
La crescente pervasività dei prodotti chimici nella civiltà industriale ha differenziato la produzione in numerosi settori, caratterizzati da una propria "storia", con stadi di sviluppo e di maturità distanziati nel tempo.
Si possono tracciare alcune linee distintive nella storia dell'industria chimica:
- la grande industria chimica inorganica, nata dalla rivoluzione industriale;
- l'industria chimica organica dei prodotti "fini" (fine chemicals), fiorita fra la metà dell'Ottocento e la metà del Novecento;
- il rinnovamento delle tecnologie di sintesi, con la ricerca di condizioni di reazione estreme (nei primi decenni del XX secolo);
- l'affermarsi dell'industria organica pesante dei nostri giorni;
- il moderno affermarsi di tecniche sintetiche legate alle biotecnologie.
Origini e sviluppo dell'industria chimica (1750 - 1900)
[modifica | modifica wikitesto]Il settore dell'industria chimica che per primo realizzò una produzione economicamente cospicua fu quello degli alcali. Esso giunse a maturità tecnologica negli ultimi decenni dell'Ottocento.
Per tutto l'Ottocento con il termine "industria degli alcali" si intendeva un sistema di produzioni diverse, che comprendeva soda, soda caustica e, in modo linguisticamente improprio, acido solforico. A queste produzioni si aggiunse dopo il 1870 la fabbricazione della polvere da sbianca, un prodotto essenziale per l'epoca. L'industria degli alcali si pose al servizio di altri settori: in primo luogo il settore tessile, trainante dell'intera rivoluzione industriale, poi quelli del sapone, del vetro, della carta, tutti legati a consumi civili in grande crescita con il diffondersi di modesti livelli di benessere.
Alcuni "alcali" erano stati preparati e utilizzati già da tempo. In particolare la soda (carbonato di sodio) era stata ricavata per lisciviazione delle ceneri di alcune alghe e di specie vegetali presenti in paludi salmastre, mentre la potassa (carbonato di potassio) poteva essere ottenuta ovunque vi fossero foreste da incenerire. I derivati caustici della soda e della potassa si avevano mediante trattamento con calce viva (caustificazione del carbonato). La soda caustica era particolarmente apprezzata nei saponifici, in quanto permetteva la produzione di saponi solidi, di più alto valore commerciale di quelli liquidi (ottenuti trattando i grassi con potassa caustica).
La soda Leblanc
[modifica | modifica wikitesto]
A causa della crescita della domanda, il prezzo degli alcali aumentò notevolmente durante tutta la prima metà del Settecento, fino a quando non si intravide la produzione da altre materie prime che non fossero i vegetali. Nel 1736 il francese Henri Louis Duhamel du Monceau provò che il sale comune era un composto di base della soda e dello spirito di sale (acido cloridrico). Quando il chimico inglese Joseph Black stabilì che soda e potassa non erano altro che i corrispondenti composti caustici combinati con aria fissa (anidride carbonica), apparve anche il nesso fra materie prime facilmente accessibili, quali il salmarino, il calcare e la soda, ma occorsero tre decenni di proposte e di tentativi pratici prima di giungere ad una "soluzione" accettabile.
Nel 1775 l'Accademia delle Scienze di Parigi aveva offerto un ingente premio in danaro per chi fosse riuscito ad ottenere la soda dal salmarino. Nicolas Leblanc modificò alcuni procedimenti noti, realizzando un processo in due stadi: nel primo stadio il salmarino era convertito in solfato di sodio, nel secondo il solfato era mescolato con carbone e carbonato di calcio, e per riscaldamento si otteneva la soda e solfuro di calcio. La soda veniva lisciviata e rimaneva una fanghiglia contenente carbone incombusto, soda non lisciviata e solfuro di calcio, facilmente decomponibile con esalazioni di idrogeno solforato. È evidente come in questa versione primordiale due componenti essenziali andassero completamente perduti: il cloro del sale si disperdeva nell'aria sotto forma di cloruro di idrogeno, lo zolfo dell'acido solforico rimaneva "bloccato" in un caput mortuum pestilenziale. A parte questi punti a sfavore, il processo per quei tempi era davvero vantaggioso.
Leblanc fu travolto dalle vicende della Rivoluzione francese, che ghigliottinò il duca d'Orléans (suo finanziatore) nel 1793 e rese nulli i brevetti del processo. Dopo la sua morte per suicidio (nel 1806), si dovette aspettare la rivoluzione industriale perché il processo Leblanc fosse rivalutato. Charles Tennant introdusse il processo Leblanc a St. Rollox fin dal 1818, ma un'imposta pesantissima che gravava sul sale ne impedì lo sviluppo e la diffusione. Nel 1825 l'ostacolo fu rimosso e il prezzo del sale scese a un cinquantesimo del valore precedente. Nello stesso anno James Muspratt avviò il processo in larga scala a St. Helens, migliorando la qualità del prodotto venduto. La sua black-ash conteneva già una percentuale in peso di soda doppia rispetto allo standard precedente (40% contro il 20%), accanto a impurezze di cloruri e solfuri, ma nel 1830 iniziò a commercializzare la white-ash, e cioè carbonato sodico anidro.
La soda caustica fu preparata dagli utilizzatori finali fino ai primi anni 1850, quando William Gossage ne iniziò la preparazione a partire dalla parte più impura delle liscivie Leblanc, e la mise in commercio in recipienti di ferro.
La soda Solvay e la questione ambientale
[modifica | modifica wikitesto]
II sistema tecnico della soda Leblanc rimase sostanzialmente invariato fino al 1863, quando per una singolare coincidenza esso si trovò sottoposto ad una duplice pressione: economica e politica. La prima veniva dalla proposta di un processo alternativo da parte del belga Ernest Solvay, la seconda era costituita dall'inedita legge anti-inquinamento inglese, la Alkali Act.
Le nozioni scientifiche alla base del nuovo processo erano note fin dagli anni 1820: se in una soluzione di sale saturata con ammoniaca veniva fatta gorgogliare anidride carbonica, si otteneva un precipitato di bicarbonato di sodio, poco solubile, da cui per riscaldamento si aveva facilmente la sospirata soda. Il metodo nella pratica aveva posto problemi di ingegneria insuperabili, fin quando nelle mani di Ernest Solvay e del fratello Alfred - dopo anni di tentativi - era diventato praticabile. Il passo decisivo era stato compiuto con la messa a punto di una particolare torre di carbonatazione; ulteriori perfezionamenti si ebbero nei forni per la produzione dell'anidride carbonica e per la calcinazione del bicarbonato. La Société Solvay et Cie fu fondata nel 1863 e i diritti di produzione per l'Inghilterra furono acquistati da Ludwig Mond nel 1872.
Da quel momento la concorrenza fra i due processi divenne spietata. Nel 1874 solo 30.000 t di soda Solvay partecipavano al totale di 525.000 t prodotte in tutto il mondo; undici anni dopo su 800.000 t di soda 365.000 erano dovute al processo Solvay. Il "sorpasso" avvenne poco dopo e nel 1902 gli impianti Solvay producevano 1.650.000 t, e al processo Leblanc veniva lasciato un margine "residuo" di 150.000 t. Queste cifre dimostrano da una parte l'imponenza delle produzioni chimiche di base alla fine dell'Ottocento, e dall'altra l'ostinata resistenza dei produttori Leblanc.
Questa resistenza era stata agevolata - dialetticamente - dagli effetti dell'Alkali Act. Per ogni tonnellata di soda prodotta con il metodo Leblanc, 0,75 t di cloruro di idrogeno venivano scaricate nell'aria. Da questa incuria aberrante erano stati letteralmente devastati interi distretti industriali inglesi, come quello di Widnes, in cui era concentrata l'industria degli alcali. Sotto la pressione delle proteste degli agricoltori, alcuni produttori di soda avevano cercato di porre rimedio agli effluenti acidi; Gossage, in particolare, aveva brevettato nel 1836 una torre in cui i gas provenienti dal primo stadio del processo venivano lavati con acqua prima di essere immessi nell'atmosfera. La soluzione molto diluita di acido cloridrico veniva scaricata nei fiumi. Questo sistema rimase opzionale fino al 1863, quando fu imposto un radicale abbattimento dei fumi acidi. Anche il "rimedio" di gettare tutto nei fiumi venne bloccato dopo qualche anno dal Rivers Pollution Act di Benjamin Disraeli[1]: per un insieme di ragioni politiche, sociali ed economiche era diventato indispensabile utilizzare il cloro contenuto nel salmarino.
La polvere da sbianca e gli sviluppi del processo Leblanc
[modifica | modifica wikitesto]
Le proprietà sbiancanti del cloro gassoso erano state notate nel 1774 dal suo scopritore, lo svedese Karl Scheele, e il savoiardo Claude Louis Berthollet aveva condotto esperimenti pratici per la sbianca dei tessuti (1785). L'innovazione si era diffusa rapidamente in quanto il processo di sbianca era fra i più laboriosi dell'epoca; nei paesi nordici poteva durare per tutto il periodo da marzo a settembre con il sole come agente decolorante, e il ben più attivo (e nocivo) cloro fu benvenuto malgrado la sua pericolosità.
Ma proprio al volgere fra Settecento e Ottocento Tennant e Charles Macintosh riuscirono a preparare una polvere (il cloruro di calce) da cui si otteneva facilmente per acidificazione una potente soluzione sbiancante. Per la preparazione della polvere di Tennant era essenziale il cloro, e questo era ottenuto a sua volta secondo il metodo del suo scopritore: trattamento di pirolusite (biossido di manganese) con acido cloridrico. Poiché anche la domanda di polvere da sbianca era enormemente cresciuta, il problema tecnico-scientifico che nel 1863 si presentava ai chimici inglesi era di trovare un percorso economicamente valido verso il cloro a partire dalla soluzione di acido cloridrico (che scorreva a fiumi dalle torri di Gossage). I tecnici inglesi seppero dare due risposte, entrambe valide.
Walter Weldon modificò il processo di preparazione del cloro a partire dalla pirolusite trovando un modo ingegnoso di recuperare il manganese, che al termine di ogni ciclo di ossidazione si ritrovava sotto forma di cloruro manganoso. Weldon trattò la massa di cloruro con calcare e calce, e vi fece passare potenti getti d'aria a 50 °C; il manganese veniva così quasi totalmente riossidato ed era pronto per un ulteriore ciclo (1866). La proposta di Henry Deacon era tecnologicamente più innovativa. Deacon progettò un sistema in cui il cloruro rameoso permetteva di "bruciare" l'acido cloridrico con aria a 500 °C, dando cloro e acqua (1868). La corrente di cloro ottenuta era invero molto diluita, ma nel 1870 Deacon superò anche questo limite, riuscendo a ottenere della polvere da sbianca molto attiva.
Con il recupero del cloro il processo Leblanc migliorava nettamente le sue prestazioni economiche, però ancora un elemento fra quelli che intervenivano nel primo stadio era completamente perduto. Lo zolfo del solfuro di calcio, inutilizzabile, si accumulava nelle montagne di rifiuti che circondavano le officine Leblanc. Anche in questo caso il successo giunse solo dopo molti tentativi: Gossage aveva mostrato come fosse possibile liberare idrogeno solforato dal solfuro di calcio, insufflando anidride carbonica nei residui della produzione Leblanc, ma fu Alexander Chance a trarre vantaggio da questa proposta, trovando il modo di arricchire il gas ottenuto e ossidandolo ad acqua e zolfo in un forno progettato da Carl Friedrich Claus (processo Claus).
I metodi di produzione dell'acido solforico
[modifica | modifica wikitesto]Nei primi decenni del Settecento la produzione di acido solforico era ancora a uno stadio del tutto artigianale, in quanto lo zolfo veniva semplicemente bruciato sotto campane di vetro o in grossi palloni, e andava quasi tutto perso sotto forma di anidride solforosa. Il primo miglioramento fu introdotto in Inghilterra nel 1749 da Joshua Ward, che aggiunse alle cariche di zolfo del salnitro (zolfo e salnitro erano da secoli associati nella polvere da sparo), migliorando enormemente la resa in acido solforico. Nello stesso lasso di tempo John Roebuck superò il limite di scala imposto dall'uso del vetro e cominciò ad utilizzare per la combustione dello zolfo camere rivestite di piombo[2] di circa 8 m³ di cubatura. Dal punto di vista della gestione della reazione vera e propria, si ebbero dei progressi fondamentali solo verso la fine del secolo con Nicolas Clément e Charles Bernard Desormes nel 1793. Nel 1806 ancora questi due ricercatori scoprirono la funzione catalitica (la parola non era ancora in uso) degli ossidi di azoto, che quindi potevano essere mantenuti su un livello limitato. I vapori nitrosi furono comunque lasciati disperdere all'aria, fin quando un altro chimico francese, Joseph Louis Gay-Lussac, non propose di farli assorbire nelle camere da un acido che era fatto piovere dall'alto di una torre di lavaggio posta prima dello scarico finale dei gas. La torre di Gay-Lussac (1827) stentò alquanto ad affermarsi, perché il metodo per il recupero degli ossidi d'azoto, basato sulla diluizione della miscela nitrosa raccolta alla base della torre, era economicamente oneroso in termini di acido. Essa entrò veramente in uso solo dopo il 1859, quando l'inglese John Glover inventò una torre di denitrazione, dove la miscela nitrosa, proveniente dalla torre di Gay-Lussac, era fortemente riscaldata dai gas diretti alle camere di piombo, ed era costretta a rilasciare gli ossidi d'azoto, che così tornavano in ciclo.
La longevità del metodo delle camere di piombo è stata straordinaria, in quanto un certo numero di esse funzionava ancora negli anni 1970, più di due secoli dopo l'introduzione del processo. Oltre alle innovazioni già descritte, la loro conduzione era stata resa più economica dall'arrostimento delle piriti al posto della combustione dello zolfo come fonte di anidride solforosa, e dalla continua crescita delle dimensioni delle camere di piombo, che giungevano fino a 10.000 m³ già negli anni 1830. La lunga durata del processo fu anche favorita dall'uso dell'acido nelle camere della produzione di superfosfati; questa fu avviata in larga scala in Inghilterra nel 1843 da John Bennet Lawes, una eccellente figura di imprenditore e di scienziato (fu uno dei fondatori della sperimentazione agraria). Tuttavia la crescente richiesta di acido solforico fumante da parte dell'industria degli esplosivi e dei coloranti sintetici forzò la messa a punto di un nuovo processo per la sintesi dell'anidride solforica, basato sulla catalisi eterogenea, processo che nacque per la preparazione di un prodotto speciale (specialty chemical), ma che man mano soppiantò quello tradizionale anche nella produzione di massa.
La preparazione di oleum (una soluzione di anidride solforica in acido solforico) era da decenni monopolio della famiglia Starck, che lo otteneva nei suoi 12 stabilimenti boemi con metodi plurisecolari. In queste condizioni, non c'è da stupirsi se si cercò attivamente di spezzare questo monopolio tutt'altro che naturale, impiegando tecniche più moderne della distillazione di miscele di solfati.
La strada da battere era già stata indicata da tempo con brevetti e articoli, che fin dai primi anni del 1830 avevano sottolineato l'attività catalitica della spugna di platino. Dopo la solita miriade di tentativi infruttuosi, nel 1875 Rudolf Messel in Inghilterra e Clemens Winkler in Germania giunsero indipendentemente ad una prima soluzione: ossidazione catalitica dell'anidride solforosa a solforica, e suo assorbimento in acido solforico concentrato. Bloccato in Inghilterra dal brevetto di Messel, il processo si diffuse nei diversi paesi germanici, in quanto Winkler aveva semplicemente pubblicato le sue ricerche. Il metodo di contatto divenne realmente efficiente sotto la cura intelligente di Rudolf Knietsch. Era questi uno dei molti ricercatori che operavano nei laboratori della Badischen Anilin und Soda Fabrik (BASF), la società tedesca che più di ogni altra si era impegnata nello studio scientifico delle tecnologie produttive dell'industria chimica. Questo tecnico della BASF diede alle stampe nel 1901 un articolo in cui veniva resa pubblica una quantità immensa di conoscenze sul processo catalitico e sulla catalisi, accumulatesi in lunghi anni di ricerche. L'articolo indicava come la sede stessa del processo di produzione materiale, l'impresa, fosse diventata in grado di rivaleggiare nella produzione di conoscenza con l'istituzione scientifica per eccellenza, l'università.
I coloranti sintetici (1850 - 1950)
[modifica | modifica wikitesto]La nascita di una nuova industria: Perkin e la porpora d'anilina
[modifica | modifica wikitesto]
La storia dei coloranti di sintesi inizia da un'intenzione "farmaceutica". Nel 1855 il diciassettenne William Henry Perkin era entrato nel Royal College of Chemistry; rapidamente introdotto alle tecniche della chimica organica, gli era stato indicato come tema di ricerca un'impresa ambiziosa: la sintesi della chinina, una sostanza vegetale impiegata nella cura della malaria. Nel suo laboratorio casalingo, Perkin prese alla lettera le indicazioni ricevute, seguendo la via di ossidare una serie di ammine aromatiche; su questa via, impraticabile per il suo scopo, si imbatté più volte in precipitati di incerta composizione, ma di spiccata colorazione. Forse perché non era ancora ben condizionato da una lunga pratica di ricerca, forse perché era naturalmente deviante, Perkin ignorò l'avviso di studiare solo sostanze purificate e cristallizzate, e accentrò il suo interesse sui risultati della reazione fra dicromato potassico e anilina.[3] Il giovanissimo ricercatore si convinse subito delle ottime capacità tintorie del nuovo prodotto, e ne sottopose un campione all'attenzione dei Pullar, titolari di una grande tintoria di Perth. Ottenutane una risposta positiva (12 giugno 1856), dopo una prima esperienza condotta su un impianto pilota di tipo familiare, depositò il 26 agosto 1856 il brevetto del nuovo colorante[4], la porpora di anilina (o mauveina[5] o CI 50245[6]).
È interessante notare che fin da questo primissimo inizio, la struttura stessa del sistema di conoscenze della chimica organica dimostrò la sua ricchezza e la sua flessibilità in funzione della produzione materiale. Secondo le procedure di laboratorio, Perkin aveva a disposizione tutto ciò che poteva rendere concreta la linea produttiva:

Il benzene era accessibile attraverso la distillazione frazionata del catrame, messa a punto da un altro allievo del Royal College, Charles Mansfield. Il nitrobenzene era stato ottenuto da un chimico tedesco, Eilhard Mitscherlich fin dal 1834; la riduzione di questo composto ad anilina era stata studiata dal russo Nikolaj Nikolajevic Zinin nel 1842.
Il piano scientifico della produzione era facile da approntare, altra cosa era però affrontare la realizzazione del processo su larga scala e la commercializzazione del prodotto. Perkin fu molto efficace in questo, così come lo era stato nell'intravedere le possibilità economiche dei suoi strani precipitati: egli "inventò" un'intera nuova industria, dall'acquisizione delle materie prime, alle diverse fasi della produzione, all'applicazione della tintura, all'introduzione del prodotto sul mercato. In questa impresa egli dovette affrontare molte difficoltà, fra cui vanno ricordate almeno due, paradigmatiche del nuovo tipo di produzione materiale. L'operazione di nitrazione, necessaria per passare dal benzene al nitrobenzene, diventava estremamente pericolosa non appena portata su scala industriale e si dovettero studiare attentamente le condizioni pratiche con cui condurla in una situazione di relativa sicurezza. Questo passaggio dalla situazione di laboratorio a quella della fabbrica costituì sempre un'incognita in tutti i progetti di ingegneria chimica, però la necessità di uno stretto controllo della qualità dei reagenti e delle condizioni di reazione era sorprendente per chi era abituato alla conduzione piuttosto grossolana degli impianti Leblanc o delle camere di piombo.
Il secondo aspetto tipico dell'innovazione di Perkin fu la necessità di innovare anche l'uso finale del prodotto. Il nuovo colorante non dava risultati soddisfacenti con il cotone e solo quando Perkin usò l'acido tannico come mordente riuscì a ottenere delle stoffe di cotone commerciabili. A questo punto il successo fu immenso, immortalato nella leggenda dalla comparsa della regina Vittoria all'Esposizione Universale del 1862 interamente vestita in mauve, secondo il nome francese del colorante di Perkin.
Il nuovo arcobaleno chimico
[modifica | modifica wikitesto]
Dopo il lancio commerciale del mauve, le scoperte nel nuovo campo furono innumerevoli: a partire dal magenta (o fucsina) di François-Emmanuel Verguin (1859), un completo arcobaleno di colori fu messo a disposizione dell'industria tessile, con un andamento che andò accelerandosi in seguito alle sempre maggiori conoscenze sulla reattività organica, e quindi nell'analisi strutturale. I colori di questo arcobaleno furono in gran parte sintetizzati da chimici tedeschi; ricordiamo il blu di metilene, scoperto da Heinrich Caro nel 1876, e tuttora usato per il cotone, il verde malachite (1878) di Otto Fischer, e il rosso Congo di Paul Böttiger (1884), il primo colorante diretto per cotone. Ma il passaggio più evidente dall'empirismo all'intenzione costruttiva della chimica strutturale si ebbe già con la sintesi dell'alizarina di Carl Liebermann e Carl Graebe nel 1869. Per giungere alla loro sintesi i due ricercatori avevano utilizzato le conoscenze più avanzate sui chinoni e sui composti aromatici, nonché sulle reazioni che permettevano di passare da una classe di composti organici ad un'altra. La richiesta del brevetto inglese fu presentata dalla BASF un giorno prima di Perkin, un biglietto da visita della nuova potenza industriale tedesca. L'alizarina era il principio attivo della radice della robbia (Rubia tinctorum), nella cui coltivazione erano impegnati 175.000 ettari in mezza Europa. Anche l'inevitabile rovina di queste culture diventava un segno dei tempi, presagio di altre sostituzioni, più difficili e, talvolta, più radicali.

Effettivamente grandi difficoltà incontrarono le ricerche che portarono alla sintesi industriale dell'indaco, e che costituirono uno dei maggiori successi imprenditoriali della fine dell'Ottocento. La struttura della molecola dell'indaco richiese quasi venti anni di studi per essere delucidata da Adolf von Baeyer, che fra il 1880 e il 1883 propose quattro distinte vie di sintesi del composto. Nessuna di queste si dimostrò tale da rendere la sintesi industriale competitiva con il prodotto naturale, e la pressione della BASF su Baeyer (che ne era divenuto un consulente) fu tale da portare a una rottura nel 1885. Da quel momento in poi le decisioni sulla strategia di sintesi in grande rimasero nelle mani dei dirigenti dell'impresa renana, che finalmente ebbero aperta la strada commercialmente giusta dalle ricerche di Karl Heumann. Per la traduzione industriale della sintesi di Heumann occorsero ancora diversi anni di messa a punto, in quanto si articolava in otto reazioni diverse, ciascuna con i suoi particolari problemi di resa, di velocità o di rifornimento degli intermedi. La più restia a dare risultati accettabili fu proprio la prima di queste reazioni, che riguardava la trasformazione del naftalene in anidride ftalica mediante l'azione di acido solforico concentrato e caldo. Solo un provvidenziale incidente di laboratorio (la rottura di un termometro) permise di individuare il catalizzatore adatto ad accelerare la reazione.
L'indaco sintetico fu commercializzato dalla BASF a partire dal 1897; l'esportazione di indaco naturale dall'India, che era stata di 19.000 t nel 1897, scese a 1.100 t nel 1914, con la conseguente rovina economica di molti produttori. Lo sviluppo del processo aveva richiesto l'investimento enorme di un milione di marchi, pari al costo di un incrociatore da battaglia. Inoltre era stato necessario trovare il modo di produrre grandi quantità di oleum e di cloro, indispensabili per la conduzione della sintesi e la preparazione di intermedi. Queste nuove produzioni, indotte dalla scelta strategica della sintesi dell'indaco, arricchirono il patrimonio conoscitivo interno della BASF, con effetti sinergici che si avvertirono con forza pochi anni dopo anche nel settore lontano della sintesi dell'ammoniaca.
L'industria farmaceutica (1850 - 1950)
[modifica | modifica wikitesto]Chimica farmaceutica e sintesi organica
[modifica | modifica wikitesto]
All'industria chimica organica si era intanto aperto un nuovo settore di intervento, quello dei prodotti farmaceutici. Anche in questo caso il concetto di struttura molecolare giocò un ruolo fondamentale nell'articolare la metodologia di ricerca. Non solo la struttura di un composto naturale riconosciuto attivo poteva (in via di principio) essere replicata in laboratorio, ma le capacità costruttive e permutative dei chimici potevano generare illimitate variazioni, da cui attendere effetti fisiologici più efficaci e/o diversi.
Questo modello di produzione di conoscenza si andò formando negli ultimi due decenni del XIX secolo, ed è ancora oggi attivo e fecondo. Uno dei primi tentativi fu di "mimare" gli effetti terapeutici della chinina, un principio attivo contro la malaria e quindi benefico per milioni di pazienti in tutto il mondo. La molecola della chinina è assai complessa e resistette a una sintesi completa fino agli anni quaranta, ma per una parte di essa, la chinolina, fu proposta una preparazione piuttosto facile dal ceco Zdenko Skraup nel 1880. Su questa molecola iniziò a lavorare Otto Fischer, producendone numerosi derivati: uno di essi si dimostrò attivo come febbrifugo, ma non aveva alcun effetto contro la malaria. Con lo stesso metodo di indagine un successo in un certo senso definitivo fu colto da Felix Hoffmann, con la ripresa della sintesi dell'estere acetilico dell'acido salicilico, già preparato nel 1853 dal grande chimico francese Charles Gerhardt. L'uso dell'acido salicilico come febbrifugo e antireumatico era stato spinto con vigore da Hermann Kolbe, che ne aveva realizzato la sintesi nel 1853, ma la sua azione irritante sul sistema digestivo ne aveva limitato l'impiego. Il composto di Gerhardt e Hoffmann non aveva effetti collaterali così vistosi, e fu messo in commercio dalla Bayer nel 1899, sotto il nome commerciale di aspirina. Una variante importante di questo modello di ricerca venne alla luce fra il 1886 e il 1889 nei lavori del tedesco Eugen Baumann (1848-1896) sugli ipnotici solfonici. Durante ricerche sul metabolismo di composti contenenti zolfo i due scienziati si imbatterono nell'effetto soporifero di certi composti solfonici, la cui stessa struttura, con almeno quattro possibili "sostituzioni", invitava all'attività di trial-and-error.

Il modello di ricerca chimico-farmaceutica si strutturò in quattro stadi: scoperta più o meno intenzionale dell'attività fisiologica di una certa sostanza chimica; determinazione della struttura (se non nota) e preparazione di varianti; prove cliniche prima su animali e poi sull'uomo; produzione su larga scala e lancio sul mercato. I risultati di questo modello operarono (e operano) sul margine più oscuro dell'esistenza, la malattia e la morte, è evidente quindi il suo impatto sociale, e il suo permanente interesse storico. Importanti tappe di queste ricerche sono la prima vittoria contro la sifilide (1910), la scoperta dei sulfamidici (1935), e lo sviluppo degli antibiotici.
La teoria eziologica di Louis Pasteur e Robert Koch indicava nei microorganismi responsabili di specifiche malattie gli intrusi da eliminare dall'organismo malato. Paul Ehrlich, medico, batteriologo e chimico, si pose con chiarezza l'obiettivo di colpire i microorganismi con molecole mirate, partendo dall'osservazione dell'assorbimento differenziato dei coloranti di sintesi nei vari tessuti e nei diversi batteri. Il suo progetto fu di trovare molecole in grado di attaccare il parassita e non l'ospite (1891). I primi grandi successi vennero contro i tripanosomi, protozoi che minavano anche l'uomo con la terribile malattia del sonno: i "proiettili" (la metafora è di Ehrlich) erano due derivati azoici della benzidina, il rosso Trypan (1904) e il blu Trypan (1909). Al momento della scoperta dell'agente della sifilide, il Treponema pallidum, Fritz Schaudinn sottolineò che esso era più vicino ai protozoi che ai batteri. Questa quasi-analogia accese le speranze di Ehrlich, che sulla base di una precisa analogia chimica sostituì al gruppo azoico -N=N-, così attivo contro i tripanosomi, il gruppo -As=As-, con l'arsenico trivalente efficace contro la malattia del sonno. Dopo prove condotte con centinaia di sostanze sintetizzate ad hoc, nel 1909 Ehrlich e il suo assistente giapponese Sahachiro Hata scoprirono che il composto 606 (il salvarsan) era attivissimo contro le spirochete della sifilide. La tossicità di questo prodotto venne attenuata nel 1912, con la produzione del composto 914 (il neosalvarsan). Malgrado gli effetti secondari, le molecole di Ehrlich rimasero l'unico rimedio efficace contro la sifilide fino all'avvento degli antibiotici.
Con la cura della sifilide si raggiunse un limite che per molto tempo apparve insuperabile. Fino al 1935 la totalità dei prodotti farmaceutici di sintesi era attiva solo contro le malattie causate da protozoi (con l'eccezione importante della sifilide). Si trattava di malattie per lo più tropicali, e i batteri nocivi, presenti nelle zone temperate parevano richiedere l'intervento di molecole che si dimostravano invariabilmente troppo pericolose per il malato. Ma la tradizione di ricerca instaurata da Ehrlich, e mantenuta con granitica determinazione nei laboratori dell'industria tedesca, doveva dare i suoi frutti migliori negli anni trenta del Novecento.
Nel 1932 Fritz Mietzsch e Josef Klarer sintetizzarono un colorante diazoico rosso che conteneva il gruppo -SO2. NH2; Gerhard Domagk, direttore dei laboratori di patologia sperimentale e di batteriologia della IG Farben, ne determinò la forte attività contro infezioni da streptococchi e da stafilococchi. Il lancio del prontosil, il primo sulfamidico, avvenne nel 1935. Questa nuova "molecola magica" attirò subito l'attenzione di un gruppo di ricercatori dell'Istituto Pasteur di Parigi, e nello stesso anno 1935 i coniugi francesi Tréfouël, Daniel Bovet e Federico Nitti pubblicarono un articolo in cui si dimostrava che il principio attivo era in realtà un metabolita del prontosil. I sulfamidici si dimostrarono straordinariamente efficaci contro malattie mortali come la febbre puerperale e la meningite da streptococchi.
Gli antibiotici e il cortisone
[modifica | modifica wikitesto]
Il batteriologo inglese Alexander Fleming aveva osservato nel 1928 che una muffa blu aveva parzialmente invaso una capsula Petri e aveva causato tutto intorno a sé una lisi delle colonie preesistenti di stafilococchi. Fleming aveva provato sperimentalmente che il Penicillum notatum produceva una sostanza (incognita e allora non isolata) con proprietà antibatteriche, e non tossica per gli animali. Tuttavia anche negli anni seguenti Fleming non riuscì a superare le estreme difficoltà sperimentali connesse all'isolamento del principio attivo, da lui chiamato penicillina. Nel 1936 il problema fu ripreso da un gruppo di Oxford, di cui facevano parte Howard Walter Florey e Ernst Chain, e dal 1940, sotto la spinta delle esigenze belliche, le ricerche si intensificarono. Il metodo di purificazione, assai complesso per l'instabilità del composto attivo, fu messo a punto da Chain, e un primo chiarimento della struttura si ebbe nel 1943. La chimica di sintesi, appoggiata dall'industria farmaceutica, aveva colto grandi successi nel campo delle vitamine e degli ormoni, ma i tempi ristretti della guerra non permisero di attendere la sintesi di laboratorio (che venne per la penicillina solo nel 1957), e si scelse la via biochimica.
Le tecniche di fermentazione industriale erano progredite vistosamente durante la prima guerra mondiale ad opera di Chaim Weizmann, che aveva asservito il Clostridium acetobutylicum alla produzione di massa dell'acetone dall'amido. L'acetone era indispensabile per la fabbricazione della cordite, l'esplosivo prediletto dall'esercito inglese, e il nuovo processo si diffuse in tutto il Commonwealth. Ma la produzione di penicillina per via biotecnologica presentava difficoltà di ben diverso ordine, per la già citata sensibilità del prodotto ai cambiamenti di pH e alle tracce di metalli pesanti. L'era degli antibiotici era comunque iniziata, e la preparazione della penicillina raggiunse rapidamente livelli utili per lo sforzo bellico. Nel 1948 il monopolio anglo-americano della penicillina fu infranto da Domenico Marotta, che chiamò Chain a dirigere il Centro internazionale di chimica microbiologica, costituito presso l'Istituto Superiore di Sanità a Roma. D'altra parte fin dai primi anni del 1940 tutte le maggiori case farmaceutiche avevano scatenato una vera e propria caccia ai microorganismi utili: nel 1943 Selman Abraham Waksman isolò la streptomicina, attiva in diverse infezioni che non rispondevano al trattamento con penicillina, e nel 1948 Benjamin Duggar ottenne l'aureomicina. Negli anni cinquanta si dimostrò che questa era un derivato della tetraciclina, sostanza madre di una classe di antibiotici a largo spettro.
Oltre al "fiorire" degli antibiotici il secondo dopoguerra vide anche la commercializzazione del cortisone (1949), frutto delle laboriosissime ricerche di Edward Calvin Kendall. Nei quindici anni precedenti Kendall, che lavorava alla Mayo Clinic di Rochester, alimentò le sue indagini sulla porzione corticale delle ghiandole surrenali, barattando i rifornimenti di ghiandole surrenali di bue (150 t in tutto) con l'adrenalina pura che isolava dalla porzione midollare. Lo scienziato americano chiamò con le lettere dell'alfabeto i composti cristallini che man mano andava isolando; il composto E (chiamato poi cortisone) si dimostrò essere un potente antinfiammatorio. Lewis Hastings Sarett, dei laboratori della Merck, mise a punto nel 1944 una prima sintesi che necessitava di 37 passaggi prima di giungere al prodotto finale; pur semplificato, al momento della commercializzazione il processo era ancora il più complesso mai portato nelle condizioni di produzione industriale. Al primo cortisone commerciale contribuì anche un prodotto semisintetico, a cui si giungeva impiegando come materiale di partenza un composto della famiglia degli steroidi, presente nella bile bovina, l'acido desossicolico.
L'industria degli esplosivi (1850 - 1950)
[modifica | modifica wikitesto]Gli esplosivi ad alto potenziale
[modifica | modifica wikitesto]
La storia degli esplosivi comincia verso la fine degli anni 1840, quando si cercava di nitrare qualunque composto organico per ottenere sostanze esplosive. Particolare successo ebbero il tedesco Christian Friedrich Schönbein con la preparazione del fulmicotone (1846) e l'italiano Ascanio Sobrero con la sintesi della nitroglicerina (1847). La produzione di fulmicotone a scopi militari, che seguì immediatamente la scoperta, fu sospesa quando una terribile esplosione distrusse la prima fabbrica inglese il 14 luglio 1847. La produzione riprese solo dopo che il ricercatore inglese Frederick Abel dimostrò che il fulmicotone poteva essere stabilizzato mediante un processo di purificazione completa da ogni traccia di acido, lasciata nella massa dopo l'operazione di nitrazione.

Ancora più drammatica e avventurosa la vicenda dell'impiego pratico della nitroglicerina. Alfred Nobel ne iniziò lo studio nel 1859 e, dopo la scoperta che l'esplosione poteva essere innescata con polvere da sparo, ne iniziò la commercializzazione sotto il nome di "olio esplodente". Un'esplosione distrusse la prima fabbrica svedese, uccidendo il fratello di Alfred. Il commercio di nitroglicerina continuò fino al 1867, anno in cui Nobel adottò il fulminato di mercurio come detonatore e stabilizzò la nitroglicerina, facendola assorbire da farina fossile (una diatomite), ottenendo una pasta morbida che chiamò dinamite. Il tecnico-imprenditore svedese brevettò nel 1875 la cosiddetta "gelatina esplosiva", a base di cotone collodio e nitroglicerina[7], con un potere esplosivo maggiore della dinamite.
I nuovi esplosivi erano tutti dirompenti, e quindi non adatti a un uso balistico. Qui la prima innovazione avvenne in Francia, con la Poudre B di Paul Vieille prodotta nel 1886, cui seguì la balistite di Nobel nel 1887, e la cordite di Abel nel 1889. In tutti questi casi si trattava di miscele particolari di composti già noti; la rivoluzione delle tecniche costruttive delle armi fu profonda, e i massacri della prima guerra mondiale resero consapevoli le grandi potenze dell'efficacia mortale di queste armi. D'altro canto, gli esplosivi moderni resero più sicuro il lavoro in miniera, e permisero la realizzazione di grandi opere civili come il canale di Panama.
Elettrochimica, alte temperature e pressioni, catalisi (1890 - 1940)
[modifica | modifica wikitesto]Molte delle produzioni descritte nella sezione precedente non erano tecnologicamente dissimili da quelle usuali in un laboratorio di chimica organica: temperature poco elevate, pressione atmosferica. L'industria chimica però aveva cercato condizioni estreme, creandosi essa stessa i materiali più adatti per realizzarle, non appena l'industria elettromeccanica mise a disposizione generatori abbastanza potenti.
L'industria elettrochimica
[modifica | modifica wikitesto]
La data di nascita della grande industria elettrochimica può essere posta nel 1886, quando Paul-Louis-Toussaint Héroult in Francia e Charles Martin Hall negli Stati Uniti brevettarono un processo per la preparazione dell'alluminio (chiamato appunto "processo di Hall-Héroult"), che si basava sull'elettrolisi di una soluzione di allumina in criolite fusa. La produzione di alluminio a basso costo, già rilevante di per sé, venne valorizzata a pieno da Hans Goldschmidt, che dopo aver studiato a fondo la riduzione termica degli ossidi metallici mediante polvere di alluminio, ne propose l'uso industriale nel 1898. Nei primi anni del XX secolo il processo alluminotermico permise la produzione a costi ragionevoli di metalli altrimenti inaccessibili, come cromo, manganese, tungsteno, molibdeno. Ogni ossido metallico richiedeva particolari accorgimenti, ma la temperatura doveva raggiungere in ogni caso almeno i 2200 °C. I metalli ottenuti allargarono la produzione di acciai speciali, ampliando ancora l'induzione tecnologica indiretta dell'innovazione di Héroult e Hall.
Un chimico statunitense, Hamilton Young Castner (1858-1899), aveva progettato un metodo per ottenere il sodio, con il quale intendeva ridurre l'allumina e ricavare l'alluminio, ed era emigrato in Inghilterra alla ricerca di capitali. Dopo qualche sperimentazione limitata, aveva aperto un'officina nel 1888, ma presto la concorrenza del processo elettrolitico rese non remunerativa la sua produzione di alluminio. A questo punto si impegnò a trovare uno sbocco per il sodio, di cui invero c'era una scarsa domanda; dopo un tentativo verso il perossido si concentrò nella produzione del cianuro di sodio. La corsa all'oro in varie parti del mondo e il metodo al cianuro per l'estrazione dei metalli preziosi (brevettato nel 1887) fecero la sua fortuna, così che per stare dietro alla domanda di cianuro cercò un nuovo processo per la preparazione del sodio, trovando conveniente l'elettrolisi della soda caustica. Ma il mercato offriva soda caustica troppo impura per i suoi scopi, e Castner si accinse a prepararla in proprio, mediante un secondo processo elettrolitico, basato su una cella particolare con catodo di mercurio (1894). Il prodotto, puro al 100%, era inedito e trovò un grande mercato esterno all'impresa di Castner nella produzione di carta, tessuti, oli e saponi, infliggendo un ulteriore colpo all'agonizzante industria Leblanc inglese.
La disponibilità di energia elettrica a basso costo, aprì una strada diversa dai processi elettrolitici appena descritti. Le fornaci impiegate prima degli anni 1880 erano riscaldate mediante combustibili che bruciavano all'aria, e una parte cospicua dell'energia emessa era perduta per aumentare la temperatura dei prodotti di combustione e dell'azoto inerte dell'aria stessa. Con questo metodo tradizionale era difficile superare i 1200 °C. Con la fornace riscaldata da un arco elettrico, o dalla corrente fatta passare attraverso un reagente che fosse conduttore, si poteva lavorare con temperature fino a 2000 °C, e il limite era dato essenzialmente dai refrattari impiegati. Il primo composto a essere preparato su larga scala con questo metodo fu il carburo di calcio, con un processo proposto ancora una volta contemporaneamente in Francia e negli Stati Uniti nel 1892. Il metodo impiegava come materie prime calce viva e antracite, e si stimava che la temperatura raggiungesse i 2000 °C. Il carburo di calcio serviva per la produzione di acetilene, impiegato per l'illuminazione fino all'introduzione del filamento di tungsteno nelle lampade a incandescenza (1910), ma a partire dal 1905 venne impiegato anche per "fissare" l'azoto atmosferico sotto forma di calciocianamide. Questo composto poteva essere venduto direttamente come fertilizzante, oppure convertito in ammoniaca o in cianuri.
La fissazione dell'azoto
[modifica | modifica wikitesto]
La parte più avanzata dell'agricoltura europea utilizzava come fertilizzante ingenti quantità di nitrato di sodio, estratto dai depositi naturali del Cile; nell'industria chimica la produzione di coloranti e di esplosivi ne dipendeva totalmente, in quanto era materia prima indispensabile per la preparazione dell'acido nitrico. L'attacco al problema della sostituzione del nitro cileno fu condotto in diverse direzioni, non tutte legate alla fissazione diretta dell'azoto. Da una rapida selezione dei diversi processi emerse una nuova industria, detta appunto industria dell'azoto.
Il primo metodo di fissazione dell'azoto operativo su scala industriale fu quello dei norvegesi Kristian Birkeland e Samuel Eyde, che riuscirono a rendere praticabile la reazione dell'azoto con l'ossigeno alla temperatura dell'arco voltaico, espandendo l'arco per azione di un campo magnetico. Il processo Birkeland-Eyde fu avviato nel 1903 e nel 1905 era pienamente operativo a Notodden; la sua convenienza era legata al bassissimo costo dell'energia elettrica.
Un altro processo importante apparve agli inizi del secolo: l'ossidazione catalitica dell'ammoniaca, e la sua trasformazione in acido nitrico. Le reazioni erano note da tempo, ma non erano note, fino al 1900, le condizioni con cui ottenere un'alta resa in acido nitrico. Fu allora che uno dei fondatori della teoria della catalisi, Wilhelm Ostwald, ne iniziò lo studio. Nel 1902 vennero presi i brevetti, e il primo impianto fu eretto nel 1908 nella cokeria di Gerthe[8] nella Ruhr; alla vigilia della guerra forniva circa 250 t di acido nitrico al giorno. La posizione di questo processo nel problema della fissazione dell'azoto fu assolutamente centrale: da una parte apriva la strada verso l'acido nitrico ai metodi sintetici che, come quello della calciocianamide, davano azoto fissato sotto forma di ammoniaca; dall'altra permetteva una parziale rimozione del problema stesso della fissazione, in quanto ovunque nel mondo civilizzato erano potenzialmente disponibili enormi quantità di ammoniaca, di solito fermata come solfato d'ammonio nelle acque di lavaggio del gas di cokeria. Quale delle due strade dovesse essere seguita dipendeva evidentemente dai costi di produzione dell'ammoniaca. Solo le necessità belliche riuscirono comunque a imporre il processo Ostwald, in quanto la disponibilità del nitro del Cile lo rendeva poco appetibile in tempo di pace. Una verifica si ha nel fatto che inizialmente la BASF, partendo dal metodo Haber-Bosch, produsse solo ammoniaca sintetica e solfato d'ammonio.
Il metodo fondamentale di fissazione dell'azoto, quello della sintesi diretta dell'ammoniaca dagli elementi, divenne una realtà scientifica, tecnica e industriale nello specialissimo clima culturale della Germania imperiale, dove nessuno scienziato era in effetti disinteressato alle applicazioni pratiche delle sue idee. I tentativi di laboratorio di sintetizzare ammoniaca da idrogeno e azoto nacquero infatti da una dura polemica fra Walther Nernst e Fritz Haber sul valore da assegnare alle costanti d'equilibrio della reazione. Entrambi i contendenti erano perfettamente consci del senso economico della loro discussione, e dal loro sforzo congiunto Haber fu trascinato a mettere a punto nel 1908 un apparecchio dimostrativo che, con un catalizzatore a base di uranio e operando a 550 °C e 200 atm, permetteva di ottenere una miscela gassosa così ricca in ammoniaca che questa poteva essere liquefatta per semplice raffreddamento. La BASF fu subito contattata ma i dirigenti della grande impresa, che si recarono a Karlsruhe per assistere a una dimostrazione di Haber, rimasero alquanto scettici. Carl Bosch non si fermò nemmeno abbastanza a lungo per vedere funzionare l'apparecchio di Haber, ma Alwin Mittasch rimase, e poté constatare la "facilità" della sintesi. Nel 1910 cominciò a funzionare un impianto pilota a Ludwigshafen, e nel 1913, con il superamento di grandi difficoltà ingegneristiche e dopo l'esplorazione di centinaia di catalizzatori da parte di Mittasch, fu aperto lo stabilimento di Oppau, in cui operavano giganteschi reattori del peso di 8 tonnellate. Durante la guerra la BASF costruì un secondo impianto a Leuna, con una produzione complessiva al termine del conflitto di 95.000 t di azoto fissato, circa la metà del consumo tedesco.
La diffusione delle sintesi ad alta pressione
[modifica | modifica wikitesto]Al momento dell'armistizio gli ufficiali alleati visitarono l'impianto di Oppau con il meravigliato rispetto che imponeva questo tempio della tecnologia chimica, ma intanto altri scienziati-tecnici in Francia e in Italia mettevano a punto nuove varianti del processo. Georges Claude, uno dei massimi esperti di reazioni in fase gassosa, faceva operare i suoi impianti in condizioni estremamente severe, mentre condizioni un po' più blande erano ammesse da Luigi Casale, un tecnico-imprenditore indipendente, il cui processo ebbe ampia diffusione negli anni venti. Nel 1923 entrò in funzione il primo impianto (quasi artigianale) di Giacomo Fauser, che aveva introdotto modifiche sostanziali rispetto al processo Haber-Bosch. Il primo impianto su grande scala che lavorava con i brevetti Fauser-Montecatini fu inaugurato a Merano nel 1926, e da allora questo processo si diffuse in tutto il mondo.

Le tecniche acquisite nel trattamento di gas ad alte pressioni trovarono sbocchi imprevedibili, in settori molto lontani da quello originale. Il punto di partenza di questi sviluppi va individuato nelle ricerche di Paul Sabatier sull'idrogenazione di composti organici insaturi mediante l'azione catalitica di metalli finemente suddivisi, in particolare nichel (1897). Nel 1902 in Germania Wilhelm Normann brevettò un processo che permetteva la preparazione di grassi solidi per uso alimentare a partire da oli (indurimento); l'idrogeno veniva fatto gorgogliare in olio caldo in cui era stato sospeso nichel finemente suddiviso. Il metodo permetteva di commercializzare sotto forma di margarina l'olio di semi di cotone (Stati Uniti) o gli oli di pesce (Europa). Il processo di Normann lavorava a pressione atmosferica, ma il russo Vladimir N. Ipatieff si era fatto da tempo assertore dell'impiego delle alte pressioni anche nelle sintesi organiche, e all'inizio degli anni 1910 questa tecnica fu impiegata nell'idrogenazione dei grassi. Nella stessa direzione si mosse Friedrich Bergius; allievo di Nernst e di Haber nel 1913 brevettò un procedimento per l'idrogenazione del carbon fossile, adatto a produrre idrocarburi volatili. Nel 1925 Bergius cedette i suoi diritti alla BASF; le connessioni con le tecniche sviluppate in funzione della sintesi dell'ammoniaca erano evidenti: uso di grandi quantità di idrogeno e impiego di alte pressioni. Il processo fu perfezionato da Bosch, che per questo condivise con Bergius il premio Nobel per la chimica nel 1931. Il Nobel sanzionava l'acuto interesse economico e strategico che il processo suscitava, in quanto durante la seconda guerra mondiale partecipò allo sforzo bellico della Germania e dell'Inghilterra.
È da ricordare inoltre un altro processo volto alla produzione di carburanti sintetici, dovuto ad altri due tedeschi, Franz Fischer e Hans Tropsch. Secondo questi due ricercatori il gas d'acqua (una miscela di idrogeno e ossido di carbonio) veniva fatto passare a 200 °C e a pressioni moderate su opportuni catalizzatori; si ottenevano idrocarburi adatti all'impiego come combustibile per il motore a combustione interna. La produzione commerciale iniziò nel 1935, e si sviluppò velocemente durante la guerra. Agli inizi degli anni settanta l'unico impianto di questo tipo era mantenuto in funzione in Sudafrica nel periodo dell'apartheid, a salvaguardia delle conseguenze di un embargo petrolifero.
Dal carbone al petrolio (1870 - 1970)
[modifica | modifica wikitesto]
Lo sviluppo dell'industria petrolifera e i processi di cracking
[modifica | modifica wikitesto]Le vicende dell'industria petrolifera e di quella chimica rimasero a lungo separate. Fino ai primi anni del XX secolo le raffinerie di petrolio avevano il compito esclusivo di distillare il greggio per separare le varie frazioni di idrocarburi e commercializzarle per i diversi usi. Questi usi non avevano affatto domande bilanciate: fra il 1890 e il 1900 vi fu penuria della frazione a 10-15 atomi di carbonio (cherosene) ed eccesso di quella a 6-10 atomi di carbonio (benzina). Il cherosene era richiestissimo per le lampade a petrolio, mentre la benzina era ritenuta troppo pericolosa per la sua infiammabilità ed era in genere scaricata nei fiumi.
Con l'"avvento" dell'automobile e la diffusione dell'illuminazione elettrica la situazione mutò radicalmente, e ritornò d'attualità una proposta fatta molti anni prima: spezzare termicamente le catene degli idrocarburi più pesanti per ottenere frazioni più leggere, a catena più corta. Il primo processo di cracking termico che diede ottimi risultati commerciali fu realizzato negli Stati Uniti da W.M. Burton (1865-1954), direttore di una raffineria della Standard Oil. Gli impianti pilota, che operavano a 4-5 atmosfere, presentarono grandi difficoltà costruttive ed erano piuttosto pericolosi, così che nel 1910 la direzione della Standard rifiutò di autorizzare la spesa per un impianto commerciale. Tuttavia nel 1911 la legge antitrust americana scisse la Standard Oil in diversi tronconi, e la nuova direzione aziendale favorì l'investimento. Il processo fu avviato nel 1913, ed è stato calcolato che i costi di sviluppo (236.000 $) furono ripagati 10 volte nel primo anno operativo dell'impianto.
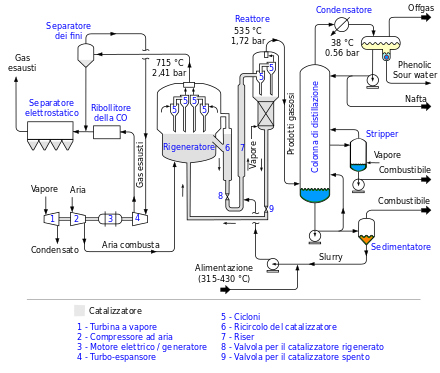
Il metodo Burton dominò il settore fino al 1921, periodo in cui furono proposti ben nove processi, fra cui risultò importantissimo quello di C. P. Dubbs. Dubbs era figlio d'arte (le iniziali del nome corrispondono a Carbon Petroleum), e da un facoltoso finanziatore fece acquistare alcuni brevetti di suo padre, che allora dirigeva una piccola raffineria californiana. I brevetti erano stati presi per il trattamento del greggio californiano, ma Dubbs junior vi aveva visto la possibilità di migliorare il processo Burton, in particolare rendendolo continuo. I cinque anni che furono necessari per la messa a punto del processo richiesero 6 milioni di dollari di spese di sviluppo (mandando in rovina il finanziatore di Dubbs), tuttavia il nuovo metodo, funzionante a partire dal 1923, era effettivamente molto più efficiente di quello di Burton.
Negli anni venti diverse compagnie petrolifere incominciarono a interessarsi delle potenzialità che la catalisi offriva al processo di cracking, ma lo fecero senza entusiasmo e con magrissimi risultati. Nel 1925 un ingegnere francese, Eugene Houdry, intraprese una ricerca sistematica dell'effetto sul cracking di centinaia di catalizzatori, e nel 1927 ottenne i primi risultati positivi. Houdry aveva investito nella ricerca una parte ingente della sua fortuna personale, ma presto la scala delle ricerche di sviluppo divenne tale da richiedere l'esperienza impiantistica e i capitali di una grande impresa. Privo di appoggi in Francia, emigrò negli Stati Uniti, dove costituì una società con la Socony Vacuum Oil (1930), cui si aggiunse più tardi la Sun Oil (1932). Il processo cominciò a funzionare a livello industriale fra il 1936 e il 1937, dopo che erano stati investiti circa 11 milioni di dollari (3 provenienti dal patrimonio privato di Houdry).
Fin dagli inizi fu chiaro che lo stesso processo Houdry poteva essere perfezionato, in quanto era semi-continuo e con catalizzatore a letto fisso, e la "minaccia" di questa innovazione era tale che nel 1938 fu formato un gruppo, denominato Catalytic Research Associates, che coordinava gli sforzi di ricerca di giganti quali l'Indiana Standard, la Jersey Standard, la Shell e la Texaco. Il processo a letto fluido divenne operativo nel 1942; al termine di una serie di perfezionamenti nel 1952 era costato 30 milioni di dollari di investimenti in ricerca e sviluppo.
La transizione dal carbone al petrolio
[modifica | modifica wikitesto]
Come si è visto si trattò di una (costosa) vicenda interna all'industria petrolifera, e tale rimase il suo risultato tecnicamente più valido, il cracking catalitico, ancora migliorato dal punto di vista della produzione di combustibili con l'introduzione dei catalizzatori zeolitici (1965). Il cracking termico invece ha permesso una svolta radicale nei rifornimenti di materie prime all'industria chimica, e ha dato un impeto violento alla produzione di materie plastiche.
L'accessibilità alle materie prime è stata sempre la prima comprensibilissima preoccupazione in tutti i settori produttivi, ma in quello chimico questa preoccupazione è esasperata dal fatto che un singolo nuovo processo può esaurire - di colpo - tutte le risorse disponibili in un certo settore di "intermedi". Così la IG Farben affidò a un chimico di genio, Walter Reppe, il compito di sintetizzare a partire dall'acetilene il butadiene, necessario per il Buna-S. Fra il 1926 ed il 1930 Reppe risolse il problema con un metodo basato su quattro reazioni successive, di cui una era un'idrogenazione ad alta pressione, e tre richiedevano catalizzatori specifici. L'acetilene era ricavato a sua volta dal carburo di calcio, e l'intero sistema tecnico del Buna-S si basava su intermedi provenienti in modo più o meno mediato dal carbone.

Dopo la fine della seconda guerra mondiale la formazione di un nuovo mercato mondiale svaporò gli spettri dell'autarchia nelle grandi economie capitalistiche, e gli sviluppi dell'industria petrolifera che abbiamo appena descritti dettarono una nuova interpretazione del problema degli intermedi, così che, per gradi, si passò dal "tutto dal carbone" al "tutto dal petrolio". Il passaggio fu favorito anche da un altro fatto: gli intermedi richiesti per le nuove sostanze plastiche erano ottenuti con forti economie di scala, impiegando i procedimenti petrolchimici. Un caso emblematico chiarirà la svolta degli anni 1950.
Quando la ICI iniziò a produrre il polietilene, l'impianto era progettato per una produzione annua di 50 t, e l'etilene era ricavato da alcool etilico di fermentazione. Nel 1952 la produzione di 2.000 t annue di polietilene era impiegata ancora per usi speciali; l'etilene ricavato da fermentazione portava i costi a 250 sterline per tonnellata: il passaggio all'etilene da cracking significò una caduta dei costi a 90 sterline per tonnellata. Ulteriori vantaggi si ebbero spingendo verso l'alto la scala degli impianti; secondo calcoli del 1963 il costo per tonnellata di etilene da cracking sarebbe stato di 22 sterline per tonnellata con un impianto da 50.000 t/anno, e sarebbe sceso a 16 sterline con una produzione annua di 300.000 t. Su questa base tecnico-economica, imperniata sull'ottenimento di idrocarburi alifatici mediante cracking, e sulla produzione di massa di materie plastiche si sarebbe stabilizzato in buona parte quel paesaggio industriale della chimica che è giunto ai giorni nostri.
Plastica e polimeri (1870 - 1970)
[modifica | modifica wikitesto]
In tutti i casi analizzati fino ad ora le molecole sintetiche erano indistinguibili da quelle di origine naturale, già si erano presentati casi in cui un particolare "effetto" (ad esempio fisiologico), migliorativo o peggiorativo, era ottenuto con molecole di struttura completamente diversa da quelle della sostanza naturale. Così la saccarina (o solfammide benzoica), sintetizzata nel 1879 da Ira Remsen, aveva un potere dolcificante circa cinquecento volte maggiore del saccarosio e non aveva nulla a che fare con gli zuccheri dal punto di vista chimico. Lo stesso vale per i nuovi polimeri sintetici, in quanto portano a sostanze simili ma con caratteristiche diverse rispetto a quelle "mimate" (in particolare le proprietà fisiche, come la duttilità e la malleabilità).
I primi materiali plastici
[modifica | modifica wikitesto]L'onda di marea di queste nuove sostanze plastiche cominciò ad alzarsi impercettibilmente in un'occasione "ludica". Negli Stati Uniti era stato offerto un premio di 10.000 $ per chi avesse trovato un materiale sostitutivo dell'avorio, di cui si avvertiva grande penuria per la fabbricazione delle palle da biliardo. John Wesley Hyatt puntò a vincere il premio e, fra le varie sostanze prese in considerazione, studiò la nitrocellulosa; egli scoprì che la soluzione di canfora in etanolo era un solvente perfetto e un plastificante ideale della nitrocellulosa. Nel 1872 Hyatt mise in commercio i primi articoli di celluloide, una soluzione solida di nitrocellulosa e canfora; malgrado l'estrema infiammabilità, l'eccellente stabilità dimensionale[9] della celluloide la rese insostituibile nei lavori fotografici di precisione, fin quando fu sostituita nel secondo dopoguerra dal triacetato di cellulosa, molto meno infiammabile.

Un secondo materiale plastico destinato a una lunghissima vita sul mercato fu ottenuto da Leo Hendrik Baekeland, un geniale chimico belga trapiantato negli Stati Uniti, che con i suoi brevetti del 1907 aprì il nuovo settore delle sostanze termoplastiche. All'inizio del XX secolo aveva già guadagnato un milione di dollari cedendo a George Eastman il brevetto di una speciale carta fotografica, e si era concesso un periodo di studio a Berlino. Di ritorno negli Stati Uniti, aveva constatato che il suo paese d'adozione importava 27 milioni di chilogrammi di gommalacca, e si era impegnato nella ricerca di un sostituto. La reazione fra fenolo e formaldeide era già stata molto studiata, fin da quando Baeyer aveva segnalato nel 1871 la formazione di una sostanza scura e catramosa, ma nessuno era giunto a controllarla con la maestria di Baekeland: in presenza di alcali aveva ottenuto un materiale resinoso che una volta riscaldato diventava duro, insolubile e non più fusibile. Il nuovo materiale era un ottimo isolante termoelettrico; il materiale era termoindurente, per cui immesso in stampi sotto forma di polvere dava per un semplice aumento di temperatura oggetti di buona resistenza meccanica, sagomati e complessi a piacere. Il successo di questo materiale, chiamato bachelite fu duraturo; al momento della morte del suo scopritore erano prodotte in tutto il mondo 125.000 t di resine fenoliche.
La seta artificiale
[modifica | modifica wikitesto]
Le ambizioni iniziali di Hyatt e Baekeland erano relativamente modeste: avorio e gomma lacca non servivano certo a consumi di massa. Qui l'inizio della sostituzione avvenne in un territorio classico, quello dell'industria tessile, e germinò da un'intenzione affatto lontana: la produzione di filamenti adatti alle lampade a incandescenza di Edison. Il materiale di partenza dell'inglese Joseph Wilson Swan fu ancora una volta la nitrocellulosa; egli ottenne i primi filamenti nel 1883 iniettando in acido acetico una soluzione di nitrocellulosa. Gli schizzi di soluzione coagulavano in filamenti che Swan successivamente carbonizzava, essiccava e montava su supporti isolanti. La stessa traccia fu seguita in Francia da Hilaire Bernigaud de Chardonnet, un discepolo di Pasteur; egli disciolse il dinitrato di cellulosa in alcool e etere; la soluzione, molto densa, veniva forzata attraverso una filiera in un apposito bagno, ed era così ottenuta una "seta artificiale" commerciabile. I nuovi tessuti spuntarono un certo successo perché la fibra era estremamente lucente, ma erano anche piuttosto pericolosi per l'infiammabilità intrinseca della nuova fibra.
Con l'innovazione di Chardonnet, l'idea tecnica di base era formulata con chiarezza: dissolvere la cellulosa o qualche altra sostanza simile in una soluzione viscosa e trafilarla in fibre. Il passo successivo si realizzò in Inghilterra a opera di due chimici industriali, Charles Frederick Cross e Edward John Bevan. Essi erano nei primi anni 1880 i maggiori esperti mondiali dell'industria della cellulosa e della carta; nel loro laboratorio privato scoprirono che la cellulosa, trattata con soda, reagisce con il solfuro di carbonio dando un composto solubile in acqua (debolmente alcalina). La soluzione viscosa poteva dare una fibra continua se iniettata in un bagno di acido solforico e solfato di sodio (1892). L'utilizzazione industriale del processo di Cross e Bevan incontrò non poche difficoltà, ma esso aveva grandi potenzialità in quanto richiedeva come punto di partenza la stessa pasta di legno dell'industria della carta, e non la costosa cellulosa del cotone. Il brevetto fu ceduto a Samuel Courtauld, che avviò la produzione nel 1906; alla vigilia della prima guerra mondiale questo processo controllava l'80% del mercato della seta artificiale ("viscosa").

La storia della produzione di questa fibra è importante anche perché costituisce un caso particolare di pluralismo tecnologico. Sono infatti da ricordare altri due processi: quello che solubilizzava la cellulosa mediante anidride acetica, avviato in Germania nel 1902 e fiorito nel primo dopoguerra, e quello basato su una soluzione cuproammoniacale di cellulosa, il cui prodotto divenne noto sotto il nome di seta Bemberg (1911).
La convergenza dei diversi processi portò a un vero boom postbellico delle fibre derivate dalla cellulosa: nel 1919 la produzione mondiale era di 11.000 t, dieci anni dopo era salita a 197.000 t. Nel 1933 il pluralismo tecnologico si attenuò con la chiusura degli impianti Chardonnet, mentre alla fine degli anni trenta il processo alla viscosa dominava più dei 4/5 della produzione.
La legislazione a tutela della seta impedì poi l'uso del termine "seta artificiale", che venne sostituita con il termine rayon. Ma allora si stavano già producendo i primi campioni di nylon, ed era iniziata una storia diversa, quella delle fibre totalmente sintetiche.
La nascita della chimica macromolecolare
[modifica | modifica wikitesto]
La chimica macromolecolare fu fondata con un lavoro duro e appassionato da Hermann Staudinger, che fra il 1922 e il 1932 dovette sostenere una lotta estenuante all'interno della comunità scientifica tedesca per affermare il concetto stesso di macromolecola. Ancora nel 1926, in un grande congresso scientifico a Düsseldorf, apparve completamente isolato; tuttavia a questo isolamento accademico faceva riscontro una forte integrazione con gli interessi della grande industria chimica. Fra i maggiori frutti di questa collaborazione, dobbiamo ricordare la produzione di massa del Buna-S (5.000 t nel 1938), un elastomero che si otteneva dalla co-polimerizzazione del butadiene e dello stirene, e che si dimostrò un buon sostituto del caucciù. L'interesse della Bayer alla ricerca sulla gomma sintetica risaliva al 1906, però il crollo dei prezzi del prodotto naturale dopo il 1910 aveva messo in ombra l'ipotesi di uno sviluppo commerciale. La situazione drammatica dei rifornimenti durante la guerra aveva permesso la produzione di 2.350 t di gomma metile, derivata dalla polimerizzazione di 2,3-dimetilbutadiene. Il progresso fra questa situazione e quella nella seconda guerra mondiale può essere visto (oltre che nella qualità del prodotto) nei tempi di polimerizzazione. Per la gomma metile erano necessari da 3 a 5 mesi per la polimerizzazione al 97% di una carica; nel primo dopoguerra l'impiego del butadiene e del sodio come catalizzatore fece scendere i tempi a due settimane. Il passo decisivo avvenne nel 1927, quando alla Bayer (allora "inclusa" nell'IG Farben) venne messa a punto la nuova tecnologia della polimerizzazione in emulsione; durante la seconda guerra mondiale la reazione richiedeva solo più 30 ore negli impianti tedeschi di Schkopau, e appena 14 negli Stati Uniti, dove la situazione delle applicazioni della chimica macromolecolare era piuttosto diversa da quella tedesca.
Le ricerche sviluppate da Wallace Carothers per conto della DuPont a partire dal 1928, pur condotte in un laboratorio industriale furono più specializzate, e in un certo senso più eleganti di quelle di Staudinger. Ne derivarono due prodotti di qualità; nel 1931 Carothers sintetizzò un elastomero derivato dal cloroprene; esso fu commercializzato come gomma per usi speciali (neoprene) nel 1935, anno in cui il chimico della DuPont brevettò una serie di nuovi polimeri poliammidici. La produzione del nylon-66 iniziò nel 1938, dopo quattro anni di lavoro di sviluppo, costato alla DuPont 27 milioni di dollari. Malgrado questi successi (o forse proprio per questi) al momento dell'invasione giapponese delle Indie olandesi gli Stati Uniti non possedevano conoscenze "indigene" atte a sopperire ai mancati rifornimenti di caucciù; la produzione a scopi militari di gomma sintetica fu quindi alimentata con i brevetti del Buna-S. Al termine della guerra, la produzione mondiale di Buna-S era di 756.000 t all'anno, quella di neoprene di 45.000 t.
PVC, polietilene e polipropilene
[modifica | modifica wikitesto]
La prima sintesi del cloruro di vinile risale alle ricerche giovanili di Henri Victor Regnault, condotte nel 1835 nel laboratorio di Justus von Liebig. Le proprietà di polimerizzazione di questa sostanza rimasero incontrollabili, fin quando un chimico industriale della Höchst, Fritz Klatte, prese (fra il 1912 e il 1913) una serie di brevetti che puntavano alla foto-polimerizzazione del cloruro di vinile; il polivinilcloruro così ottenuto risultava essere un materiale intrattabile: instabile alla luce, duro da lavorare, e poteva liberare acido cloridrico se riscaldato. Fu nei laboratori dell'IG Farben che si trovò una soluzione a tutti questi problemi, man mano che divenivano accessibili i fondamenti della chimica macromolecolare di Staudinger. Il passo fondamentale fu compiuto nei laboratori di Ludwigshafen (1929-1931), con il trasferimento alla sintesi del PVC delle conoscenze acquisite nella polimerizzazione in emulsione del Buna-S e conseguente commercializzazione iniziata come materiale adatto agli usi più svariati.
Del tutto diverso fu il contesto scientifico-tecnico in cui venne alla luce il polietilene. L'Alcali Division della Imperial Chemical Industries aveva forti tradizioni di ricerca, ereditate dall'impresa di Mond che vi era stata incorporata al momento della formazione della ICI nel 1926. Proprio alla vigilia della fondazione dell'oligopolio inglese, aveva iniziato a lavorarvi un giovane chimico, R.O. Gibson, già allievo di A. Michels, uno studioso olandese delle tecniche di sintesi ad altissime pressioni. Il progetto di ricerca fondamentale era nato da un interesse verso il processo Haber, ed era rivolto allo studio delle reazioni di addizione fra etilene e la benzaldeide. I primi reattori disegnati da Michels furono installati nei laboratori di Winnington[10] nel 1931, e il 27 marzo 1933 fu notato che una cera bianca ricopriva le pareti di un recipiente che aveva contenuto etilene e benzaldeide a una pressione fra le 1.000 e le 2.000 atmosfere; l'analisi rivelò che era un polimero dell'etilene, ma solo nel dicembre del 1935 l'etilene fu fatto reagire da solo, con l'ottenimento di 8 g di polimero. A questo punto il problema tecnico di rendere il processo sicuro, con compressori affidabili, occupò la ICI fino al marzo 1938, quando fu avviata la preparazione su piccola scala. La prima tonnellata di materiale dimostrò che questo aveva qualità impareggiabili come isolante elettrico, e nell'agosto del 1939 iniziò la produzione industriale, che fu interamente assorbita dalle necessità belliche (in particolare nelle tecniche collegate al radar). Finita la guerra, il polietilene rischiò di scomparire dai prodotti della ICI, ma i risultati delle ricerche sulle possibili nuove applicazioni dimostrarono che il polietilene era un materiale assai più versatile di quanto si fosse pensato.

Uno sviluppo imprevisto venne dalle ricerche di Karl Ziegler, che si era occupato nel 1928 dell'attività catalitica del sodio nella preparazione del Buna-S, e non aveva mai abbandonato il campo dei composti metallorganici. Dal 1945 si era dedicato a ricerche sui composti organici dell'alluminio, e nel 1953 stava cercando di sintetizzare derivati tri-alchilici superiori dell'alluminio scaldando i termini inferiori con etilene, quando si imbatté in un risultato sorprendente: la dimerizzazione completa dell'etilene in butilene. Seguendo questa traccia, Ziegler scoprì che il tetracloruro di titanio favoriva la formazione di alti polimeri lineari dell'etilene in condizioni di temperatura e pressione assai blande. Era l'inizio di una vera rivoluzione, non solo per il nuovo processo di sintesi del polietilene (Höchst, 1955), ma anche per il formidabile effetto amplificatore di queste scoperte nel laboratorio milanese di Giulio Natta, che da tempo era in contatto con Ziegler attraverso la mediazione della Montecatini. Natta estese la reazione di Ziegler al propilene, scoprendo un'intera nuova classe di polimeri, e spiegandone le eccezionali proprietà attraverso una precisa indagine strutturale. La Montecatini cominciò la produzione commerciale del polipropilene nel 1957. Nel 1962 la produzione mondiale del polietilene ad alta densità di Ziegler e del polipropilene di Natta raggiungeva le 250.000 t; l'anno successivo i due scienziati ricevettero congiuntamente il premio Nobel per la chimica.
I processi di innovazione con cui i nuovi materiali polimerici furono portati sul mercato sono stati tortuosi, punteggiati da eventi inaspettati, e spesso vissuti dalle imprese con ritmi decennali. Sono i segni vistosi di una rivoluzione scientifica, che metteva in discussione il concetto classico di molecola e di una rivoluzione tecnica coeva, che doveva gestire nello stesso momento nuovi processi e nuovi prodotti. Un'analisi dettagliata dei principali "avanzamenti tecnici" nel periodo fino al 1955 (117 in tutto) ha dimostrato la presenza dominante di tre soli paesi, e quella rilevante di poche grandi imprese: su un totale di 51 innovazioni originate in Germania, 30 si erano realizzate all'interno dell'IG Farben; sul totale degli Stati Uniti di 43 la DuPont ne poteva rivendicare 12; l'Inghilterra contava 15 innovazioni. A tutti gli altri paesi rimanevano solo 8 innovazioni.
Per quanto riguarda i tempi di trasferimento delle scoperte di laboratorio alla produzione industriale, la commercializzazione dei risultati di Ziegler e Natta appare particolarmente rapida. A questo hanno contribuito diversi fattori: innanzi tutto le condizioni blande in cui si realizzavano le reazioni di polimerizzazione, e un generale progresso delle pratiche costruttive degli impianti chimici, ma forse il fattore essenziale è stato la flessibilità conseguita dall'industria petrolchimica nella produzione delle diverse classi di idrocarburi.
L'industria chimica in Italia
[modifica | modifica wikitesto]
L'industria chimica in Italia si basa essenzialmente sul settore petrolchimico e farmaceutico.
Le prime industrie chimiche in Italia nascono a partire dalla seconda metà dell'Ottocento. Il 26 marzo 1882 nasce l'ACNA (Azienda Coloranti Nazionali e Affini), a cui seguono la A. Menarini Industrie Farmaceutiche Riunite S.r.l. (1886, Napoli) e la Società Anonima delle Miniere di Montecatini (che più tardi si chiamerà Montecatini) nel 1888.
Nella prima metà del Novecento fioriscono in Italia numerose aziende farmaceutiche, in particolare:
- 1919: Francesco Angelini fonda la ACRAF (Aziende Chimiche Riunite Angelini Francesco), che diventerà una azienda farmaceutica operante a livello nazionale.
- 1926: viene fondato il gruppo "Laboratorio Farmacologico Reggiano", che in seguito cambierà nome in Recordati
- 1935: nasce a Parma il gruppo farmaceutico Chiesi
- 1935: viene fondata l'azienda farmaceutica Farmitalia.
- 1936: viene aperto il Polo chimico di Ferrara, con le prime aziende di saponi e gomma.
Nel 1915 viene fondata la Chimico Mineraria Rumianca, poi semplicemente Rumianca, seguita nel 1918 dalla Società Elettrochimica del Toce a Villadossola, per la produzione di carburo di calcio. Altra importante industria chimica e la Società Italiana Resine o SIR fondata nel 1922. Nel 1936 è la volta dell'Anic (Azienda Nazionale Idrogenazione Combustibili), dopo che l'Agip e Aipa, in collaborazione con la Montecatini, decisero di fondarla con lo scopo di ottenere combustibili succedanei del petrolio tramite l'idrogenizzazione del carbone nelle raffinerie di Livorno e Bari.

Nel decennio che va tra il 1950 e il 1960 l'economia italiana attraversa il periodo storico che verrà poi chiamato "boom economico" o "miracolo economico"; durante questa fase vengono fondate la Mossi & Ghisolfi (1953) e l'Eni (1953), e viene costruito il polo petrolchimico di Gela (1959).
Nel 1963 Giulio Natta riceve il premio Nobel per la chimica per la realizzazione del polipropilene isotattico e del polietilene ad alta densità (HDPE), che vennero messi in commercio da aziende del gruppo Montecatini con i nomi di Moplen e Meraklon.
Nel 1966 per fusione della Montecatini con la Edison nasce la Montedison; l'azienda produceva materie prime di base (organiche ed inorganiche) e una vasta gamma di polimeri. La progressiva frammentazione del gruppo, con conseguente vendita delle varie sedi produttive, ha portato alla definitiva chiusura nel 2002.
Nel 1967 la Società Italiana Resine incorpora la Rumianca costituendo il gruppo SIR-Rumianca.
Gli anni settanta segnarono negativamente il mondo dell'industria chimica internazionale, e così anche il panorama industriale italiano: questi anni corrispondono infatti a due successive crisi energetiche (la crisi del '73 e quella del '79), che avvennero conseguentemente al raggiungimento (per gli Stati Uniti d'America) del picco di Hubbert, dal nome dello studioso Marion King Hubbert che già nel 1956 aveva previsto delle crisi associate allo sfruttamento di risorse limitate[11]. Nel decennio successivo sparì la SIR-Rumianca, assorbita dall'Eni tramite l'Anic, mentre nel 1991 un nuovo tentativo di fusione tra ENI e Montedison, chiamato Enimont e nato solo tre anni prima, falliva con la confluenza di tutte le attività chimiche del gruppo Montedison all'ENI. Venne in seguito accertato che questa fusione fu favorita dal pagamento di un'importante tangente ai politici di allora da parte dell'imprenditore Montedison Raul Gardini.
Il periodo successivo alla crisi energetica vede le industrie chimiche impegnate in attività a sostegno dell'ambiente. Un esempio in questo senso è la Novamont, produttrice di materiale termoplastico biodegradabile, seguendo un processo che utilizza come materie prime l'amido di mais, il grano e la patata[12]. Nel 2011 Eni ha creato una joint venture con Novamont per la creazione di un polo chimico verde presso lo stabilimento di Porto Torres in Sardegna.
La chimica e l'ambiente
[modifica | modifica wikitesto]

Abbiamo seguito le principali vicende dell'industria chimica dalla metà del XVIII secolo fino alle soglie della crisi energetica degli anni 1970, quando inizia una difficile presa di coscienza dei costi sociali e ambientali di due secoli di sviluppo tecnico e di crescita produttiva.
Oltre ai danni causati dalle armi e dalla tecnologia bellica, a conferma dei grandi costi ambientali e sociali dello sviluppo industriale, riportiamo qui di seguito una breve cronologia di noti avvenimenti:
- 1921 - Oppau (Germania) - esplosione di nitrato d'ammonio alla BASF, oltre 800 morti;[13]
- anni cinquanta - Minamata (Giappone) e Iraq - casi di intossicazione da metilmercurio (malattia di Minamata);[14]
- anni sessanta - Gruenenthal (Germania) - scoppia il caso talidomide, numerosi bambini nati deformi;[15]
- 1965-70 - durante la Guerra del Vietnam sono scaricate nell'ambiente e sulla popolazione vietnamita 80.000 t di agente Arancio;[16]
- 1976 - disastro di Seveso - da un reattore dell'azienda ICMESA[17] fuoriesce TCDD tetracloro-p-dibenzodiossina, 6.000 residenti esposti ai danni provocati dalla sostanza;
- 1984 - disastro di Bhopal[18] (India) - dispersione di 40 t di metilisocianato fuoriuscite dallo stabilimento della Union Carbide che produceva il Sevin, decine di migliaia d'intossicati e più di 2000 morti;
- 1985 - è descritto per la prima volta sulla rivista Nature il buco dell'ozono;
- 2001 - esplosione di Tolosa (Francia) - esplosione di nitrato d'ammonio alla AZF, 31 morti e 2442 feriti;[19]
- 2020 - esplosione di Beirut (Libano) - esplosione di nitrato d'ammonio nel porto, 220 morti e oltre 7000 feriti.
Anche ciò che al momento del suo sorgere era apparso una grande conquista divenne altro nel suo permanere. È esemplare il caso dei prodotti farmaceutici in cui le pressioni dell'industria, le ambizioni dei medici, e le ossessioni dei pazienti sono riuscite a far "dimenticare" che sulfamidici e antibiotici hanno salvato (e salvano) da morte sicura milioni di malati. Analoghi sintomi di rigetto si sono manifestati verso altre classi di prodotti chimici, dagli antiparassitari ai nuovi materiali plastici.
Riepilogo
[modifica | modifica wikitesto]L'epoca dei tecnici imprenditori ebbe il suo massimo fiorire nella seconda metà dell'Ottocento, quando figure come Perkin, Solvay, Nobel, Castner, Chardonnet, Baekeland, fondarono grandi industrie a partire da modesti capitali iniziali. Già negli anni fra le due guerre mondiali questo modello era in piena crisi: Casale affermò il suo processo morendo a 45 anni, stroncato dal superlavoro; Bergius preferì cedere i suoi brevetti alla BASF, e Houdry non riuscì a mantenersi indipendente nemmeno dando fondo al suo ingente patrimonio personale. I due modi con cui i produttori di conoscenza, scienziati e tecnici, si rapportano attualmente con la produzione materiale, furono messi a punto nella cultura industriale tedesca nei decenni a cavallo fra il XIX e il XX secolo. Il modello "perfetto" si realizzò con la sintesi dell'ammoniaca, quando due grandi scienziati, Nernst e Haber, re-inventarono il problema, uno di essi (Haber) lo risolse in laboratorio, un tecnico-scienziato (Mittasch) lo rielaborò nella BASF, e un imprenditore (Bosch) ne curò la realizzazione ingegneristica su scala gigantesca. Più in generale la conoscenza giunge all'impresa sia dall'esterno del processo di produzione materiale, sia dall'interno. Questa situazione ormai consolidata delega il massimo di responsabilità all'imprenditore, nelle cui mani viene accentrato un potere di orientamento della ricerca e della produzione non sempre bilanciato da opportuni strumenti di controllo sociale.
La necessità di un'attenzione viva e razionale sugli sviluppi dell'industria chimica è acuita da una seconda tendenza di lungo periodo. L'approfondirsi delle conoscenze chimiche ha seguito una direzione precisa: dall'inorganico all'organico, fino al biologico. Nello stesso tempo la produzione materiale ha cominciato a duplicare i prodotti "naturali" maggiormente richiesti dall'industria: la soda, l'acido solforico, l'acido nitrico. La duplicazione si è estesa a molecole più complesse: prima i coloranti, poi via via molti composti di interesse direttamente fisiologico quali vitamine, ormoni, antibiotici. L'industria chimica ha cominciato a sostituire una parte cospicua del nostro mondo materiale, a partire dalle fibre tessili per giungere a parti del nostro corpo come le valvole cardiache.
In aggiunta, la coscienza riguardo ai problemi etici e ambientali dell'industria rende necessario, per il nuovo secolo, una filosofia più attenta ai temi ambientali ed allo sviluppo sostenibile, che può essere rappresentata dalla chimica verde.[20]
Note
[modifica | modifica wikitesto]- ^ Michael Flavin, Benjamin Disraeli: The Novel As Political Discourse, Sussex Academic Press, 2005. ISBN 1-903900-30-1
- ^ Lead Chamber Process, su sulphuric-acid.com. URL consultato il 21-12-2008.
- ^ L'anilina è un agente cancerogeno, la cui cancerogenicità fu accertata per la prima volta da studi epidemiologici tedeschi sugli operai dell'industria dei coloranti, che associarono il tumore all'esposizione lavorativa.
- ^ Mauveine: The First Industrial Organic Fine-Chemical, su ch.ic.ac.uk. URL consultato il 21-12-2008.
- ^ La porpora di anilina è una miscela composta da 4 composti aromatici simili, che si differenziano solo per la disposizione dei gruppi metilici. Questi composti sono la mauveina A, la mauveina B, la mauveina B2 e la mauveina C.
- ^ La sigla CI sta per Colour Index, che fa riferimento alla designazione nell'ambito dell'indice internazionale dei coloranti.
- ^ 26 giugno 2019, su parodos.it. URL consultato il 26 giugno 2019 (archiviato dall'url originale l'8 aprile 2016).
- ^ Gerthe è una parte della città di Bochum, in Germania.
- ^ Per stabilità dimensionale si intende la caratteristica chimico-fisica di mantenere la propria forma anche in presenza di sollecitazioni esterne.
- ^ Winnington è un'area della città di Northwich, nel Cheshire, in Inghilterra.
- ^ King Hubbert : Il picco di produzione del petrolio, su dani2989.com. URL consultato il 22-12-2008 (archiviato dall'url originale il 9 febbraio 2009).
- ^ La bioraffineria di Terni Qui nasce la plastica pulita, su peacelink.it. URL consultato il 22-12-2008.
- ^ Copia archiviata (PDF), su barpipdf.geniecube.info. URL consultato il 13 febbraio 2009 (archiviato dall'url originale il 25 marzo 2009).
- ^ Minamata Disease The History and Measures - Chapter 2 [MOE]
- ^ http://www.modenasitiweb.it/img-talidomide-focomelia/art-gianni-moriani.doc
- ^ www.monde-diplomatique.it, su monde-diplomatique.it. URL consultato il 13 febbraio 2009 (archiviato dall'url originale il 25 gennaio 2012).
- ^ allora parte del gruppo Givaudan & C. di Vernier S.A. di Ginevra.
- ^ (EN) W. Morehouse, The Bhopal Tragedy, 1986.
- ^ Lecco: Lecco
- ^ (EN) Italo Pasquon, Luciano Zanderighi, La chimica verde, Hoepli, Milano, 1987. ISBN 88-203-1567-X
Bibliografia
[modifica | modifica wikitesto]- Geoffrey John Pizzorni (a cura di), L'industria chimica italiana nel Novecento, 1ª ed., Franco Angeli edizioni, 2006, ISBN 88-464-7226-8.
- Antonio Corvi, L'officina farmaceutica: due secoli di storia, 1999, Primula Multimedia, ISBN 88-87344-08-6.
- Livio Cambi, Ernestina Dubini Paglia, Le grandi conquiste della chimica industriale, ERI, Torino, 1970.
- Luciano Caglioti, I due volti della chimica. Benefici e rischi, EST Mondadori, Milano, 1979.
- (EN) Fred Aftalion, History of the International Chemical Industry: From the "Early Days" to 2000, 2ª ed., Chemical Heritage Foundation, 2005, ISBN 0-941901-29-7.
- (EN) Alfred Dupont, Jr. Chandler, Shaping the Industrial Century: The Remarkable Story of the Evolution of the Modern Chemical and Pharmaceutical Industries, Harvard University Press, 2005, ISBN 0-674-01720-X.
- (EN) Fritz Ullmann, Ullman's Encyclopedia of Industrial Chemistry, 6ª ed., Wiley-VCH, 2002, ISBN 3-527-30385-5.
- (EN) Robert P. Multhauf, The History of Chemical Technology. An Annotated Bibliography, 6ª ed., Garland Pub., New York, 1984, ISBN 0-8240-9255-4.
- (EN) Ludwig F. Haber, The chemical industry during the nineteenth century: A study of the economic aspects of applied chemistry in Europe and North America, Clarendon Press, Oxford, 1958, ISBN 0-19-858102-5.
- (EN) Ludwig Fritz Haber, The Chemical Industry, 1900-1930. International Growth and Technological Change, Clarendon Press, Oxford, 1971, ISBN 0-19-858133-5.
- (EN) Frank Sherwood Taylor, A History of Industrial Chemistry, Heinemann, Londra, 1957, ISBN 978-0-405-04725-1.
- (EN) Aaron John Ihde, The Development of Modern Chemistry, Dover Publications, New York, 1984, ISBN 0-486-64235-6.
- (EN) (a cura di Charles Joseph Singer), A History of Technology, vol. IV e V, Oxford, 1958.
- (EN) (a cura di Trevor Illtyd Williams), A History of Technology, vol. VI, parte I, Oxford, 1978.
- (EN) Williams Haynes, American Chemical industry, vol. VI, The University of Chicago Press, New York, 1945-1954.
- (EN) Paul M. Hohenberg, Chemicals in Western Europe, 1850-1914. An economic study of technical change, Chicago, 1967.
- (EN) John Joseph Beer, The Emergence of the German Dye Industry (The development of science), Ayer Co Pub, Urbana, 1981, ISBN 0-405-13835-0.
- (EN) Martha Moore Trescott, The Rise of the American Electrochemicals industry, 1880-1910. Studies in the American Technological Environment, Westport, 1981.
- (EN) Peter H. Spitz, Petrochemicals. The Rise of an industry, Wiley, New York, 1988, ISBN 0-471-85985-0.
- (EN) William Joseph Reader, Imperial Chemical Industry. A History, vol. II, Londra, 1970.
- (EN) Frank M. McMillan, The Chain Straighteners, Macmillan Press, Londra, 1979, ISBN 0-333-25929-7.
- (EN) Bryan G. Reuben, M.L. Burstall, The Chemical Economy. A Guide to the Technology and Economics of the Chemical Industry, Longmans, Londra, 1973, ISBN 0-582-46307-6.
- (EN) Chris Freeman, Luc Soete, The Economics of Industrial Innovation, 3ª ed., The MIT Press, 1997, ISBN 0-262-56113-1.
- (EN) Kurt Lanz, Around the World with Chemistry, 1980.
- (EN) Graham D. Taylor, Du Pont and the International Chemical Industry, 1984.
- (EN) Fred Aftalion, A History of the International Chemical Industry, 1991.
- (EN) Alan Heaton, The Chemical Industry, 2ª ed., 1994.
- (DE) Fritz ter Meer, Die I.G. Farben Industrie Gesellschaft, Düsseldorf, 1953.
Voci correlate
[modifica | modifica wikitesto]- Ambiti dell'industria chimica
- Chimica
- Chimica industriale
- Industria
- Industria farmaceutica
- Industria petrolchimica
- Industria tessile
- Impianti chimici
Altri progetti
[modifica | modifica wikitesto] Wikibooks contiene testi o manuali su storia dell'industria chimica
Wikibooks contiene testi o manuali su storia dell'industria chimica
Collegamenti esterni
[modifica | modifica wikitesto]- Minerva: Storia dell'industria chimica da cui la versione iniziale di questa voce è tratta.
- Trattazione dei processi dell'industria chimica (in formato pdf)
- I Corsi di Storia e Cultura dell'Industria - Settori industriali e imprese - Chimica e farmaceutica - Acna - Storia (pag.1), su corsi.storiaindustria.it.
- Storia dell'industria chimica in Italia., su corsi.storiaindustria.it.
- (EN) Chemical Industry Archives, su chemicalindustryarchives.org. URL consultato il 16 dicembre 2008 (archiviato dall'url originale il 20 dicembre 2008).
- (EN) Rassegna storica dei coloranti artificiali. (PDF), su stoltz.caltech.edu. URL consultato il 21 dicembre 2008 (archiviato dall'url originale il 30 agosto 2008).
- (DE) Storia dell'industria chimica tedesca. (PDF), su deutsches-chemie-museum.de. URL consultato il 16 dicembre 2008 (archiviato dall'url originale il 9 maggio 2015).








