| Neoplasia del pancreas | |
|---|---|
 | |
| Specialità | oncologia e gastroenterologia |
| Eziologia | Tumorale |
| Sede colpita | Pancreas |
| Incidenza mondiale | circa 10±2 casi per 100 000 persone/anno |
| Classificazione e risorse esterne (EN) | |
| OMIM | 260350 |
| MedlinePlus | 000236 |
| eMedicine | 280605 |
I tumori del pancreas (o neoplasie del pancreas) si verificano in seguito alla moltiplicazione fuori controllo delle cellule del pancreas, un organo ghiandolare posto dietro lo stomaco, cellule che vanno a formare una massa. Queste cellule tumorali possiedono la capacità di diffondersi in altre parti dell'organismo.[1]
L'adenocarcinoma pancreatico è il tipo più comune di neoplasia pancreatica, in quanto rappresenta circa l'85% dei casi, e il termine "cancro del pancreas" viene talvolta utilizzato per riferirsi solo a questo tipo. Gli adenocarcinomi hanno origine nelle cellule che costituiscono la porzione dell'organo deputata alla produzione di enzimi digestivi. Tuttavia anche i diversi altri tipi di tumore, che rappresentano insieme la maggioranza dei non adenocarcinomi, possono derivare da queste cellule. Ogni cento casi di tumore al pancreas tra uno e due sono di tipo neuroendocrino (detti "PanNETs" o Pancreatic Neuroendocrine Tumors) e cioè derivanti dalle cellule che producono gli ormoni pancreatici; essi hanno un decorso generalmente meno aggressivo rispetto all'adenocarcinoma.
I segni e i sintomi più comuni dell'affezione possono includere un colorito giallo della pelle, dolore addominale o alla schiena, inspiegabile perdita di peso, feci di colore chiaro, urine scure e perdita di appetito. Solitamente nelle fasi iniziali della malattia i sintomi non si manifestano, oppure non sono sufficientemente specifici per suscitare il sospetto di una neoplasia. Ciò si traduce in un frequente ritardo nella diagnosi, che spesso viene formulata solo quando il tumore è già in uno stadio avanzato e si è diffuso in altre parti del corpo.[2][3][4]
Raramente il tumore al pancreas si verifica prima dei 40 anni di età e più della metà dei casi di adenocarcinoma pancreatico coinvolge ultrasettantenni.[2] I fattori di rischio per queste neoplasie includono il fumo di tabacco, l'obesità, il diabete e alcune rare malattie genetiche.[2] Circa il 25% dei casi sono legati al fumo[5] e il 5%-10% sono correlati ai geni ereditati.[2] La diagnosi viene solitamente formulata grazie a una combinazione di tecniche di imaging, come l'ecografia o la tomografia computerizzata, esami del sangue e la biopsia (l'esame al microscopio di campioni di tessuto).[5][6] Un eventuale screening della popolazione generale non si è dimostrato uno strumento efficace per la prevenzione.[7]
La malattia può essere trattata mediante la chirurgia, la radioterapia, la chemioterapia, le cure palliative o con una combinazione di queste. La scelta del trattamento è in parte basata sulla sede della neoplasia e sulla stadiazione clinica. La chirurgia è l'unico trattamento curativo, ma può essere intrapresa anche nel tentativo di migliorare la qualità della vita, senza perseguire l'obiettivo della cura.[8] Il ricorso alle cure palliative è consigliato anche per coloro che ricevono un trattamento finalizzato alla guarigione.[9][10]
Nel 2012 l'insieme delle neoplasie del pancreas ha rappresentato la settima causa più comune di morte per tumore, provocando 330 000 decessi a livello globale, con una maggiore prevalenza nel mondo sviluppato.[4][11][12] In genere l'adenocarcinoma pancreatico è caratterizzato da una prognosi nefasta: dopo la diagnosi, a un anno vi è una sopravvivenza del 25% e di solo il 5% a cinque anni.[4][13] Per casi diagnosticati precocemente, il tasso di sopravvivenza a cinque anni sale al 20%.[14] I tumori neuroendocrini hanno risultati migliori; a cinque anni dalla diagnosi, il 65% dei pazienti è in vita, anche se tali dati variano notevolmente a seconda del tipo di tumore.[4]
Tipi istologici e malignità
[modifica | modifica wikitesto]
I molti tipi di tumore pancreatico possono essere suddivisi in due gruppi generalizzati. La stragrande maggioranza dei casi (circa 99%) si verifica nella porzione di organo deputata alla produzione di enzimi digestivi, nota come pancreas esocrino. Vi sono diversi sottotipi di tumori pancreatici esocrini, ma la loro diagnosi e il trattamento hanno molti punti in comune. La ristretta minoranza di tumori che sorgono nel tessuto endocrino, che produce ormoni pancreatici, presenta diverse caratteristiche cliniche. Entrambi i gruppi colpiscono soprattutto, ma non esclusivamente, gli individui con un'età superiore ai 40 anni, con una prevalenza leggermente superiore nel sesso maschile, tuttavia alcuni rari sottotipi si verificano principalmente nelle donne o nei bambini.[15][16]
Tumori esocrini
[modifica | modifica wikitesto]Il gruppo dei tumori esocrini è dominato dagli adenocarcinomi pancreatici (alcune variazioni di questo nome possono essere l'attributo "invasivo" e "duttale"), che rappresentano di gran lunga il tipo più comune comprendendo circa l'85% di tutti i tumori del pancreas,[2] e ciò nonostante che il tessuto da cui essi originano, l'epitelio duttale pancreatico, rappresenti meno del 10% del volume cellulare dell'organo.[17] L'esatta origine è da ricercarsi nei condotti delle secrezioni esocrine del pancreas, come enzimi e idrogenocarbonato (vedi figura a destra).[2]
Il secondo tipo più frequente è il carcinoma a cellule acinose del pancreas che origina dalle cellule che producono gli enzimi, comprendendo il 5% dei tumori del pancreas esocrino. Tali carcinomi possono causare un eccesso di produzione di alcune molecole, in questo caso enzimi digestivi, che talvolta comportano il verificarsi di sintomi paraneoplastici come eruzioni cutanee e dolori articolari.
Il cistoadenocarcinoma rappresenta solo l'1% dei tumori pancreatici e vanta una prognosi migliore rispetto agli altri tipi esocrini.[18]
Il pancreatoblastoma è una forma rara, tipica soprattutto dell'infanzia, con una prognosi relativamente buona. Altri tumori esocrini includono il carcinoma adenosquamoso, il carcinoma a cellule ad anello con castone, il carcinoma epatoide, il carcinoma colloide, il carcinoma indifferenziato e i carcinomi indifferenziati con cellule giganti tipo osteoclasti. Il tumore solido pseudopapillare è una rara neoplasia a basso grado che colpisce soprattutto le giovani donne e ha generalmente una prognosi molto buona.[2][19]
Le neoplasie pancreatiche cistiche mucinose sono un ampio gruppo di tumori del pancreas che hanno diversi potenziali maligni e sono oggetto di numerosi dibattiti circa la loro valutazione e il loro trattamento, dato che in molti casi hanno un comportamento benigno.[20]
Tumori neuroendocrini
[modifica | modifica wikitesto]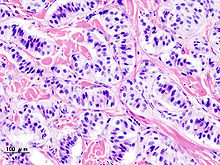
La ristretta minoranza dei tumori che nascono in altre porzioni del pancreas è costituita da tumori neuroendocrini principalmente pancreatici (detti "PanNET" o Pancreatic Neuroendocrine Tumor).[21] I tumori neuroendocrini (NET) sono un gruppo eterogeneo di tumori benigni o maligni che derivano dalle cellule neuroendocrine del corpo, responsabili dell'integrazione tra il sistema nervoso e quello endocrino. I NET possono esordire nei vari organi del corpo, tra cui appunto il pancreas, e le varianti maligne sono considerate rare. I PanNET sono raggruppati in "funzionanti" e "non funzionanti", a seconda della loro capacità di produrre gli ormoni. I tipi funzionanti secernono nel sangue ormoni come insulina, gastrina e glucagone, spesso in grandi quantità e dando luogo a sintomi gravi come l'ipoglicemia, ma in questo modo tendenzialmente si riesce a ottenere una diagnosi relativamente precoce. I PanNET funzionanti più comuni sono gli insulinomi e i gastrinomi, dal nome degli ormoni che secernono. I tipi non funzionanti non secernono ormoni in quantità sufficiente a dare luogo a sintomi clinici evidenti. Per questo motivo, i PanNET non funzionanti sono spesso diagnosticati solo dopo che il tumore si è diffuso ad altre parti del corpo.[22]
Come per altri tumori neuroendocrini, la nomenclatura e la classificazione dei PanNET è complessa.[21] Talvolta vengono chiamati "tumori a cellule insulari", anche se è ormai noto che in realtà non derivano da cellule insulari come ritenuto in precedenza.[22]
Epidemiologia
[modifica | modifica wikitesto]
nessun dato
<1
1
2
3
4
5
6
7
8
9
10
>10
Nel 2012 il tumore al pancreas ha provocato 330 000 decessi in tutto il mondo,[4] un dato in costante crescita se raffrontato ai 310 000 decessi registrati nel 2010 e ai 200 000 del 1990.[24] Si stima che nel 2014 nei soli Stati Uniti 46 000 persone avevano una diagnosi di un tumore pancreatico e vi siano stati 40 000 decessi causati da esso.[2] Anche se rappresenta solo il 2,5% dei nuovi casi di tumore diagnosticati, quello al pancreas è responsabile ogni anno per il 6% delle morti per cancro.[25] È la settima causa di morte per cancro in tutto il mondo.[4]
Globalmente il cancro del pancreas è l'11º tumore più comune nelle donne e il 12º più comune negli uomini.[4] La maggior parte dei casi registrati si verificano nei Paesi sviluppati.[4] Le statistiche epidemiologiche hanno stimato che gli statunitensi abbiano un rischio medio di incorrere in questa condizione di circa l'1,5%,[26] una probabilità leggermente superiore rispetto a quella degli abitanti del Regno Unito.[27] La malattia è più comune negli uomini rispetto alle donne,[2][4] anche se la differenza nei tassi si è ridotta negli ultimi decenni, riflettendo probabilmente l'aumento del tabagismo tra il genere femminile. Negli Stati Uniti, il rischio tra gli afroamericani è oltre il 50% maggiore rispetto ai bianchi, ma i tassi in Africa e in Asia orientale appaiono molto inferiori rispetto a quelli del Nord America o dell'Europa. Gli Stati Uniti, l'Europa centro-orientale, l'Argentina e l'Uruguay accusano tutti tassi elevati.[4]
Il tumore al pancreas è il 10º tumore più comune nel Regno Unito (la malattia è stata diagnosticata in circa 8 800 persone nel 2011), ed è la 5ª più comune causa di morte per tumore, con circa 8 700 decessi nel 2012.[27]
PanNET
[modifica | modifica wikitesto]L'incidenza annuale dei PanNET clinicamente riconosciuti è relativamente bassa (circa 5 per un milione di anni-persona) e la casistica è dominata dai tipi non funzionanti.[19] Si ritiene che tra il 45% e il 90% dei PanNET siano di tipo non funzionante.[16][22] Gli studi autoptici hanno riscontrato frequentemente la presenza di piccoli PanNET, il che suggerisce che la prevalenza dei tumori che rimangono inerti e asintomatici può essere relativamente elevata.[22] In generale si stima che i PanNET rappresentino circa l'1% ÷ 2% di tutti i tumori del pancreas.[19]
Storia
[modifica | modifica wikitesto]
Il primo riconoscimento del tumore del pancreas è stato attribuito allo scienziato italiano del XVIII secolo Giovanni Battista Morgagni, padre della moderna anatomia patologica, il quale sosteneva di averne seguito diversi casi. Molti medici di quel secolo e del successivo erano alquanto scettici circa l'esistenza di questa patologia, in quanto vi era una marcata somiglianza con la pancreatite cronica. Alcune descrizioni di casi sono state pubblicate tra il 1820 e il 1830 e una prima vera e propria diagnosi istopatologica è stata realizzata dal medico statunitense Jacob Mendes Da Costa, che tuttavia mise in dubbio l'attendibilità delle interpretazioni di Morgagni. Con l'inizio del XX secolo, la diagnosi del tumore della testa del pancreas poteva considerarsi una formulazione consolidata.[28]
Per quanto riguarda il riconoscimento delle PanNET, la possibilità di insorgenza di una neoplasia nelle cellule insulari è stata inizialmente proposta nel 1888. Il primo caso di iperinsulinismo, causato da un tumore di questo tipo, è stato descritto nel 1927. Il riconoscimento di un tipo non insulino-secernente di PanNET è generalmente attribuito ai chirurghi statunitensi Zollinger ed Ellison, che hanno dato il loro nome alla sindrome eponima, dopo aver postulato l'esistenza di un tumore al pancreas secernente gastrina in uno studio su due casi insolitamente gravi di ulcere peptiche pubblicato nel 1955.[28] Nel 2010, l'Organizzazione mondiale della sanità ha raccomandato che i PanNET siano indicati come "neuroendocrini" piuttosto che come "tumori endocrini".[21]
La prima pancreaticoduodenectomia parziale è stata eseguita dal chirurgo italiano Alessandro Codivilla nel 1898, ma il paziente sopravvisse solo diciotto giorni prima di spegnersi per via delle complicazioni. I primi interventi sono stati compromessi in parte a causa dell'erronea credenza che i pazienti sarebbero morti a seguito della rimozione del duodeno, e anche, in un primo momento, se il flusso di succhi pancreatici fosse stato fermato. In seguito si è pensato, sempre erroneamente, che il dotto pancreatico potesse essere semplicemente legato senza gravi effetti negativi. Tra il 1907 e il 1908, dopo alcune operazioni fallite da parte di altri chirurghi, alcune procedure sperimentali sono state testate su cadaveri per mano di chirurghi francesi.[29]
Nel 1912 il chirurgo tedesco Walther Kausch, che operava a Breslavia (nell'odierna Polonia), è stato il primo a rimuovere in blocco gran parte del duodeno e del pancreas. Nel 1918 è stato dimostrato, in operazioni su cani, che la rimozione totale del duodeno è compatibile con la vita, ma ciò non è stato effettuato su esseri umani fino al 1935, quando il chirurgo statunitense Allen Oldfather Whipple pubblicò i risultati di una serie di tre operazioni svolte al Columbia Presbyterian Hospital di New York. Solo uno dei pazienti era andato incontro alla completa rimozione del duodeno, ma era sopravvissuto per due anni prima di morire per le metastasi al fegato. Il successo di Whipple spianò la strada per il futuro, ma l'operazione è rimasta tuttavia difficile e pericolosa fino all'ultimo decennio del XX secolo. Egli pubblicò diversi perfezionamenti al suo procedimento, ma eseguì in totale solo 37 operazioni.[29]
Le scoperte avvenute alla fine del 1930, riguardo alla capacità della vitamina K di impedire il sanguinamento con ittero e lo sviluppo della pratica trasfusionale come procedura di routine, comportarono un miglioramento della sopravvivenza post-operatoria; tuttavia la mortalità rimase ancora molto alta.[30] Nel 1970 un gruppo di chirurghi statunitensi ha pubblicato un documento ove si evidenziava che la procedura fosse troppo pericolosa e che dovesse essere abbandonata. Da allora, nei grandi centri, i risultati furono studiati con maggior attenzione e la mortalità operatoria scese al 4%.[17] Nel 2006, è stato pubblicato un rapporto su una serie di 1 000 pancreaticoduodenostomie consecutive effettuate da un singolo chirurgo del Johns Hopkins Hospital tra il 1969 e il 2003. Tale studio ha evidenziato come il numero di queste operazioni sia aumentato costantemente nel corso di quel periodo, con un tempo medio per l'operazione ridotto dalle 8,8 ore necessarie nel 1970 alle 5,5 ore del 2000 e con una mortalità a 30 giorni in solo l'1% dei casi.[29][30] Un'altra serie di 2 050 operazioni registrate presso il Massachusetts General Hospital, tra il 1941 e il 2011, ha mostrato un analogo quadro di miglioramento nei risultati.[31]
Segni e sintomi
[modifica | modifica wikitesto]
Poiché le neoplasie pancreatiche solitamente non causano sintomi riconoscibili nelle fasi iniziali, la malattia in genere non viene diagnosticata fino a quando non si è diffusa oltre il pancreas stesso[6], e questo è uno dei principali motivi per cui tassi di sopravvivenza appaiono scarsi. Le eccezioni a ciò sono rappresentate dai PanNET funzionali, dove un'eccessiva produzione dei vari ormoni attivi può dar luogo a sintomi precoci che dipendono dal tipo di ormone sovraprodotto.
Tenendo presente anche che la malattia è raramente diagnosticata prima dei 40 anni di età, i sintomi comuni dell'adenocarcinoma pancreatico che si possono verificare prima che venga formulata una diagnosi includono:
- Dolore nella parte superiore dell'addome o alla schiena, spesso diffuso intorno allo stomaco e alla schiena. La localizzazione del dolore può indicare la parte del pancreas dove si trova la massa neoplastica. Il dolore può risultare più accentuato durante la notte e può aumentare nel tempo fino a diventare grave e incessante.[18] Nel Regno Unito, circa la metà dei nuovi casi di tumore del pancreas vengono diagnosticati dopo una visita al pronto soccorso ospedaliero in seguito a dolore o comparsa di ittero. Per i due terzi dei pazienti, il dolore addominale rappresenta il sintomo principale, per il 46% del totale esso è accompagnato da ittero, e il 13% ha ittero senza provare alcun dolore.[3]
- Ittero, un colorito giallo della pelle e della sclera dell'occhio, con o senza dolore, ed eventualmente in combinazione con urina di colore scuro. Ciò si verifica quando una massa tumorale si forma nella testa del pancreas andando a ostruire il dotto biliare comune che passa in parte attraverso il pancreas.[32] Inoltre possono anche presentarsi (sempre a causa dei rapporti anatomici di quest'organo con quelli vicini) ostruzione duodenale, emorragia digestiva e ascite; così come può sovrapporsi una pancreatite acuta al processo neoplastico.
- Una perdita di peso apparentemente inspiegabile, dovuta sia alla perdita di appetito sia alla perdita della funzione esocrina conseguente alla cattiva digestione.[3]
- La massa tumorale può comprimere gli organi vicini, interrompendo i processi digestivi e rendendo difficile lo svuotamento completo dello stomaco, e provoca di conseguenza nausea e una sensazione di pienezza. Il grasso non digerito porta a feci grasse e maleodoranti.[3] La costipazione è una condizione frequente.[33]
- Almeno il 50% delle persone con adenocarcinoma pancreatico presenta il diabete al momento della diagnosi, condizione che può sfociare in iperglicemia fino alla glicosuria.[2] Mentre lo stesso diabete è considerato un noto fattore di rischio per il cancro al pancreas, il tumore può essere anche causa di esso, nel caso una recente insorgenza del diabete potrebbe essere considerata come un segno precoce della malattia neoplastica.[34] Gli individui di età superiore ai 50 anni che sviluppano il diabete, solitamente, hanno un rischio aumentato di otto volte di incorrere nell'adenocarcinoma del pancreas a tre anni dall'insorgenza, dopodiché il rischio relativo tende a calare.[3]
Altre manifestazioni
[modifica | modifica wikitesto]- La sindrome di Trousseau, in cui coaguli di sangue si formano spontaneamente nei vasi sanguigni della vena porta, delle vene profonde degli arti o delle vene superficiali di qualsiasi parte del corpo, può essere associata con il tumore del pancreas, e si riscontra nel circa 10% dei casi.[5]
- La depressione clinica è stata riportata in correlazione con il tumore al pancreas nel 10% ÷ 20% dei casi, e può essere un ostacolo al corretto trattamento. La depressione talvolta compare prima della diagnosi, suggerendo che potrebbe essere causata dai processi biologici della malattia.[5]
Altre manifestazioni comuni provocate dalle neoplasie del pancreas comprendono: debolezza e facile affaticamento, bocca asciutta, insonnia e una massa addominale palpabile.[33]
Sintomi della diffusione (metastasi)
[modifica | modifica wikitesto]
Anche la diffusione del tumore del pancreas ad altri organi (metastasi) può causare sintomi. In genere, l'adenocarcinoma pancreatico si diffonde prima ai linfonodi più vicini e poi al fegato o alla cavità peritoneale, all'intestino crasso o ai polmoni.[5] Spesso, i pazienti con metastasi ad altri organi intra-addominali sviluppano ulteriori sintomi locali come ascite, masse addominali palpabili dall'esterno, epatomegalia e/o splenomegalia in caso di ostruzione della vena porta.[35] Raramente si riscontra diffusione alle ossa o al cervello.[36]
Fattori predisponenti
[modifica | modifica wikitesto]Alcuni fattori di rischio accertati (o fortemente indiziati) per il cancro del pancreas includono:[2][3][4][37]
- Età, sesso ed etnia; il rischio di sviluppare il tumore del pancreas aumenta con l'età. La maggior parte dei casi si verificano dopo i 65 anni,[4] mentre i casi prima dei 40 anni sono rari. La malattia è leggermente più comune negli uomini rispetto alle donne e negli Stati Uniti è di oltre 1,5 volte più frequente negli afro-americani, tuttavia l'incidenza in Africa risulta bassa.[4]
- Il fumo di sigaretta è il maggior fattore di rischio evitabile, con un rapporto di rischio di 1,74 per quanto concerne il cancro al pancreas.[38] I fumatori da lungo tempo raddoppiano la probabilità di incorrere nella condizione; il rischio aumenta con il numero di sigarette fumate e con gli anni di fumo. Il rischio diminuisce lentamente a seguito della cessazione, con circa 20 anni necessari per tornare a quasi quello di chi non ha mai fumato.[39]
- Obesità; un indice di massa corporea maggiore di 35 aumenta il rischio relativo di circa la metà.[3][40]
- Storia familiare; tra il 5% e il 10% dei casi di tumore del pancreas ha una componente ereditaria, ovvero i pazienti discendono da parenti che hanno accusato la condizione.[2][41] Il rischio si intensifica notevolmente se più di un parente di primo grado ha avuto la malattia e più modestamente se esso si è sviluppato prima dei 50 anni.[6] La maggior parte dei geni coinvolti non sono stati però ancora identificati.[2][42][43] La pancreatite ereditaria è causa di un notevole aumento del rischio di vita da neoplasia del pancreas, indicativamente con una probabilità tra il 30% e il 40%, all'età di 70 anni.[5] Uno screening precoce può essere proposto per coloro con questa condizione.[44] Alcune persone scelgono di rimuovere chirurgicamente il proprio pancreas preventivamente per evitare di incorrere nello sviluppo futuro di un tumore.[5]
- Il tumore al pancreas è stato, inoltre, correlato alle seguenti sindromi rare ereditarie: sindrome di Peutz-Jeghers, dovuta a mutazioni nel gene oncosoppressore STK11 (condizione molto rara, ma un importante fattore di rischio); sindrome del nevo displastico causa mutazioni nel gene CDKN2A soppressore del tumore; atassia-teleangectasia autosomica recessica e le mutazioni autosomiche dominanti ereditate del gene BRCA2 e del gene PALB2; cancro colorettale ereditario non poliposico (sindrome di Lynch); poliposi adenomatosa familiare. I PanNET sono stati associati alla neoplasia endocrina multipla (MEN1) e alla sindrome di von Hippel-Lindau.[2][5][6]
- Contaminanti ambientali: l'acrilammide e gli insetticidi organico-clorurati sono sospettati di favorire il cancro del pancreas.[45]
- Un'alimentazione a basso contenuto di frutta e verdura.[46]
- La pancreatite cronica sembra aumentare il rischio di quasi il triplo e, come con il diabete, la pancreatite di nuova insorgenza può essere un sintomo del tumore.[5] Il rischio di cancro al pancreas in soggetti con pancreatite familiare è particolarmente elevato.[5][43]
- Il diabete mellito è un fattore di rischio per il cancro al pancreas e anche un segno e/o sintomo della condizione; infatti, il diabete di nuova insorgenza può essere un segno precoce della malattia neoplastica. Le persone che hanno ricevuto una diagnosi di diabete di tipo 2 da oltre dieci anni, possono avere un rischio aumentato del 50%, rispetto ai non diabetici.[5]
- Uno studio del 2021 ha evidenziato come un'esposizione a una grande quantità di cesio radioattivo (Cs-134 e Cs-137) possa essere correlata a una maggiore probabilità di sviluppare il cancro pancreatico.[47]
- Specifici tipi di cibo, non sono stati chiaramente dimostrati per essere causa di un aumento del rischio del tumore al pancreas.[2] Tuttavia, per alcuni alimenti vi sono alcune evidenze di un possibile leggero aumento del rischio; essi comprendono le carni lavorate, la carne rossa[48] e la carne cotta a temperature molto elevate (ad esempio in seguito a frittura, cottura alla griglia o barbecue).[49][50]
- Le diete ricche di bevande zuccherate (soft drinks).[51] In particolare, il dolcificante fruttosio utilizzato in alcune bevande (ma anche il saccarosio, in quanto disaccaride composto da fruttosio e glucosio, che vengono poi scissi dall'organismo), è stato correlato alla crescita delle cellule tumorali del pancreas.[52]
- L'infezione da Helicobacter pylori.[53][54]
- Presenza di gengivite o malattia parodontale.[55]
Assunzione di alcol
[modifica | modifica wikitesto]Assumere alcolici in quantità eccessiva è una delle principali cause della pancreatite cronica, che a sua volta è un fattore predisponente per il tumore al pancreas. Tuttavia, una ricerca di notevoli dimensioni non è riuscita a stabilire con certezza se il consumo di alcol sia un fattore di rischio diretto per questo tumore. Nel complesso, la correlazione appare costantemente debole e la maggior parte degli studi non ha trovato alcuna associazione, anche se l'eventuale tabagismo può aver rappresentato un decisivo fattore di confusione nelle analisi statistiche. Vi sono prove più consistenti nel caso di un importante abuso di alcol.[5][56]
Precursori
[modifica | modifica wikitesto]

Si ritiene che i tumori pancreatici derivino da diversi tipi di lesioni precancerose che si sono formate all'interno del pancreas. Tuttavia, non sempre queste lesioni progrediscono a tumore e spesso sono rilevate solo in seguito a indagini TC eseguite per altri motivi.[5] Oltre al cistoadenoma sieroso pancreatico, quasi sempre con caratteristiche benigne, tre tipi di lesione precancerose sono state riconosciute.
La prima è la neoplasia intraepiteliale pancreatica. Si tratta di un'anomalia microscopica situata nel pancreas, che spesso si riscontra durante l'esame autoptico di persone a cui non era stato diagnosticato alcun tumore. Queste possono passare da un basso a un alto grado istologico e quindi a un tumore. Più del 90% dei casi possiedono un gene KRAS difettoso, mentre nei gradi 2 e 3 si riscontrano spesso danni a tre ulteriori geni: CDKN2A (p16), p53 e SMAD4.[2]
In secondo luogo, la neoplasia mucinosa papillare intraduttale consiste in lesioni macroscopiche, che si verificano in circa il 2% di tutti gli adulti, con un aumento del rischio di circa il 10% dopo i 70 anni di età e presentano una probabilità del 25% di sviluppare un tumore invasivo. Inoltre, molto spesso presentano mutazioni del gene KRAS, in circa il 40%-65% dei casi e con un interessamento della via di segnalazione di Wnt.[2] Anche se essa viene rimossa chirurgicamente, rimane comunque un considerevole aumento del rischio di sviluppare successivamente un tumore del pancreas.[5]
L'ultimo tipo, le neoplasie cistiche mucinose del pancreas, si verificano soprattutto nelle donne e possono rimanere a carattere benigno o evolvere verso la malignità.[57] Se diventano grandi, causano sintomi o assumono caratteristiche sospette, generalmente vengono rimosse con successo in seguito a un intervento chirurgico.[5]
Gli eventi genetici riscontrati in un adenocarcinoma duttale sono stati ben caratterizzati ed è stato effettuato un completo sequenziamento per i tipi più comuni. Quattro geni sono stati trovati mutati nella maggioranza degli adenocarcinomi: KRAS (nel 95% dei casi), CDKN2A (anche nel 95%), TP53 (75%) e SMAD4 (55%). L'ultimo di questi è, in particolare, associato a una prognosi infausta.[5]
PanNET
[modifica | modifica wikitesto]I geni mutati che spesso si riscontrano nei PanNET sono spesso diversi da quelli dell'adenocarcinoma pancreatico.[58] Ad esempio, solitamente la mutazione del gene KRAS è assente. Invece, ereditarie mutazioni del gene MEN1 danno luogo alla sindrome MEN1, in cui i tumori primari si verificano in due o più ghiandole endocrine. Circa il 40% ÷ 70% delle persone nate con una mutazione MEN1 possono sviluppare un PanNET.[59] Altri geni che sono frequentemente mutati sono DAXX, mTOR e ATRX.[22]
Prevenzione e screening
[modifica | modifica wikitesto]Oltre ad astenersi dal fumo, l'American Cancer Society raccomanda di mantenere un peso corporeo salutare, compiere regolare attività fisica e aumentare il consumo di frutta, vegetali, pane e cereali a grano intero, diminuendo nel contempo il consumo di carne rossa e trasformati, anche se non vi sono prove certe che tutto ciò possa prevenire o ridurre, nello specifico, le probabilità di sviluppare un tumore del pancreas.[60] Uno studio pubblicato sul Journal of the National Cancer Institute del 2009 mette in relazione gli acidi grassi saturi e monoinsaturi delle carni animali con il carcinoma pancreatico, e dichiara che specialmente il consumo di carni rosse alla brace sarebbe correlabile a un aumento statistico di questa neoplasia.[61] Un ulteriore studio di revisione effettuato nel 2014 ha concluso che non vi sono elementi sufficienti per sostenere che il consumo di agrumi e curcumina possano ridurre il rischio, mentre l'assunzione tramite alimentazione di cereali integrali, i folati, il selenio e il pesce non fritto potrebbero avere un effetto positivo.[56] Il ruolo della vitamina D e i suoi analoghi, con la loro capacità di regolare la crescita cellulare, la differenziazione, l'apoptosi e l'angiogenesi, viene studiato in quanto potrebbe essere un fattore protettivo per i tumori in generale.[62]
Nella popolazione generale, lo screening di grandi gruppi non è attualmente una strategia considerata efficace nella prevenzione del tumore al pancreas, tuttavia sono in corso valutazioni riguardo all'impiego di nuove tecnologie e alla selezione di gruppi mirati.[63][64] Al 2015, lo screening regolare mediante ecografia endoscopica e imaging RMN/TC è raccomandato solo per coloro che presentano un alto rischio per via di fattori genetici ereditati.[6][64][65][66]
Diagnosi
[modifica | modifica wikitesto]
Il tumore colpisce prevalentemente la testa del pancreas (nel 65% dei casi), mentre più raramente il corpo (30%) e, a seguire, la coda (5%).[67]
Solitamente, i sintomi dell'adenocarcinoma pancreatico non compaiono nelle fasi iniziali della malattia e non sono suggestivi di questa condizione.[2][3][32] Tuttavia, al momento della diagnosi, i sintomi possono variare a seconda della posizione della neoplasia sull'organo. Indipendentemente dalla posizione di un tumore, il sintomo più comune è una inspiegabile perdita di peso, che talvolta può essere considerevole. Una percentuale oscillante tra il 35% e il 47% degli individui con diagnosi della malattia presenta nausea, vomito o una sensazione di debolezza.[32]
I tumori nella testa del pancreas in genere possono causare anche ittero, dolore, perdita di appetito, urine scure e feci di colore chiaro. I tumori del corpo e della coda di solito causano anche dolore.[32]
Talvolta i pazienti vanno incontro anche all'insorgenza del diabete di tipo 2, che è atipico e difficile da controllare, a una inspiegabile infiammazione dei vasi sanguigni causata da coaguli di sangue (tromboflebite), nota come segno di malignità di Trousseau, o un attacco di pancreatite.[32] Un medico può sospettare un tumore pancreatico quando si riscontra l'insorgenza del diabete in una persona di più di 50 anni di età con l'accompagnamento di sintomi tipici come l'inspiegabile perdita di peso, persistente dolore addominale o lombare, difficoltà nella digestione, vomito o feci grasse.[3] L'ittero accompagnato da un dolore e gonfiore alla colecisti (conosciuto come segno di Courvoisier) può far sorgere il sospetto e può aiutare a differenziare il cancro al pancreas dai calcoli biliari.[68]

Tecniche di imaging medico, come la tomografia computerizzata (TC) e l'ecografia endoscopica (EUS) vengono utilizzate sia per confermare la diagnosi, sia per contribuire alla decisione sulla possibilità di rimuovere chirurgicamente la massa tumorale (la sua "resecabilità").[3] La risonanza magnetica e la tomografia a emissione di positroni (PET) possono essere anch'esse d'aiuto,[2] e in alcuni casi particolari, la risonanza magnetica colangiopancreatografica può essere richiesta.[32] L'ecografia addominale risulta essere meno sensibile, rispetto alla precedenti tecniche, e non sarà in grado di evidenziare piccoli tumori, ma tuttavia può identificare i tumori che hanno metastizzato al fegato e confermare la presenza di liquido nella cavità peritoneale (ascite).[3] Inoltre, l'ecografia può essere utilizzata come un rapido ed economico esame prima di approfondire con le altre tecniche.[65] La colangio-pancreatografia endoscopica retrograda (ERCP) è una tecnica diagnostica altamente sensibile (90% ÷ 95%) per rilevare anomalie al pancreas o al dotto biliare nei casi di carcinoma pancreatico, tuttavia i cambiamenti osservati non sembrano essere altamente specifici per la condizione. Tale metodica comporta anche un rischio del 5% ÷ 10% di complicanze significative e pertanto, solitamente, è riservata solo come procedura terapeutica per l'ostruzione biliare o per la diagnosi di insolite neoplasie pancreatiche, come neoplasie pancreatiche mucinose intraduttali.[69]

Una biopsia da agoaspirato, spesso guidata tramite ecografia endoscopica, può essere utilizzata nel caso di incertezza sulla diagnosi, ma un esame istologico di solito non è necessario per decidere circa la rimozione del tumore mediante intervento chirurgico.[3]
I test della funzionalità epatica possono mostrare una combinazione di valori indicativi di una ostruzione delle vie biliari (come l'aumento della bilirubina coniugata, della gammaglutammiltransferasi e della fosfatasi alcalina). Il marcatore tumorale CA 19-9 (antigene carboidratico 19-9) risulta spesso elevato nei casi di cancro del pancreas. Tuttavia, esso è carente di sensibilità e specificità, poiché il 5% degli individui è privo dell'antigene di Lewis e non può produrre CA19-9. Si è dimostrato che tale marker possieda una sensibilità del 80% e una specificità del 73% nel rilevare l'adenocarcinoma pancreatico e, pertanto, viene utilizzato soprattutto per il monitoraggio dei casi già diagnosticati piuttosto che per la diagnosi iniziale.[2][3]
La forma più comune di cancro pancreatico (l'adenocarcinoma) è tipicamente caratterizzata da strutture ghiandolari che appaiono da moderatamente a scarsamente differenziate a un esame al microscopico. Tipicamente si riscontra una considerevole desmoplasia o la formazione di uno stroma fibroso denso o di tessuto strutturale costituito da una serie di tipi di cellule (compresi miofibroblasti, macrofagi, linfociti e mastociti) e materiale depositato (ad esempio collagene di tipo I e acido ialuronico). Questo crea un microambiente tumorale scarsamente vascolarizzato (con pochi vasi sanguigni) e quindi con poca presenza di ossigeno (ipossia tumorale).[2] Si ritiene che questo impedisca a molti farmaci chemioterapici di raggiungere il tumore, un fattore che rende tale neoplasia particolarmente difficile da trattare.[2][5]
Stadiazione
[modifica | modifica wikitesto]Il tumore al pancreas viene solitamente valutato soprattutto tramite tomografia computerizzata.[32] Il sistema di stadiazione più diffuso per questo tumore è quello proposto dalla Joint Committee on Cancer (AJCC), insieme con l'Union for International Cancer Control (UICC). Il sistema AJCC-UICC indica quattro fasi generali principali, che vanno dallo stadio primitivo fino a quello relativo alla malattia avanzata. Tale sistema si basa sulla classificazione TNM in cui si considerano le dimensioni del tumore (T), il possibile coinvolgimento dei linfonodi (N) e l'eventuale presenza di metastasi (M).[70]
Per facilitare la decisione circa il possibile trattamento, i tumori sono divisi in tre categorie più ampie, a seconda che la rimozione chirurgica possa apparire possibile. In questo modo, i tumori sono giudicati "resecabili", "resecabili borderline" o "non resecabili".[71] Quando la malattia è ancora in una fase iniziale (AJCC-UICC fasi I e II), senza che vi sia un coinvolgimento dei grandi vasi sanguigni o di organi distanti come il fegato o i polmoni, la resezione chirurgica del tumore può normalmente essere eseguita, a condizione che il paziente sia disposto a sottoporsi a un intervento così complesso e si ritenga che sia sufficientemente in salute per affrontarlo.[3] Il sistema di stadiazione AJCC-UICC consente la distinzione tra lo stadio III dei tumori che vengono giudicati "resecabili borderline" (dove la chirurgia è tecnicamente possibile perché il tronco celiaco e l'arteria mesenterica superiore sono ancora liberi dalla malattia) e quelli che sono "non resecabili" (a causa di una malattia localmente avanzata); in termini di classificazione più dettagliata TNM, questi due gruppi corrispondono rispettivamente allo stadio T3 e T4.[5]
Di seguito è riportata la classificazione TNM in forma tabellare e grafica.
| Stadio | Descrizione |
|---|---|
| T0 | Non evidenza di neoplasia |
| Tis | Tumore in situ |
| T1 | Limitato al pancreas e con diametro minore di 2 cm |
| T2 | Come T1 ma con diametro maggiore di 2 cm |
| T3 | Oltre il pancreas senza coinvolgere il tripode celiaco o l'arteria mesenterica superiore |
| T4 | Coinvolge le strutture citate sopra |
| N0 | Assenza di metastasi linfonodali |
| N1 | Presenza di metastasi linfonodali |
| M0 | Assenza di metastasi a distanza |
| M1 | Presenza di metastasi a distanza |
- Stadiazione TNM del tumore pancreatico
-
Stadio T1
-
Stadio T2
-
Stadio T3
-
Stadio T4
-
Diffusione ai linfonodi vicini - Stadio N1
-
Metastasi - Stadio M1
Gli stadi risultanti possibili sono:
| Stadio | Classificazione |
|---|---|
| Stadio 0: | TisN0M0 |
| Stadio 1A: | T1N0M0 |
| Stadio 1B: | T2N0M0 |
| Stadio 2A: | T3N0M0 |
| Stadio 2B: | T1-3N1M0 |
| Stadio 3: | T4N (qualunque) M0 |
| Stadio 4: | T e N (qualunque) M1 |
Anche la Japan Pancreas Society ha proposto una propria classificazione, che di seguito è riportata[72][73]:
| Stadio | Descrizione |
|---|---|
| T1 | Da 0 a 2 cm |
| T2 | Da 2 a 4 cm |
| T3 | Da 4 a 6 cm |
| T4 | Oltre 6 cm |
| N0 | Nessun linfonodo colpito |
| N1 | Colpiti i linfonodi pancreatici del primo livello |
| N2 | Colpito il secondo livello (arteria epatica, tripode celiaco, mesenterica superiore) |
| M0 | Assenza di metastasi a distanza |
| M1 | Presenza di metastasi a distanza |
Alla classificazione vanno aggiunti eventualmente i seguenti parametri:
- S (invasione della capsula pancreatica)
- Rp (invasione del retroperitoneo)
- V (invasione vascolare)
a cui possono essere attribuiti i seguenti punteggi: 0 se assente, 1 se sospetto, 2 se certo, 3 se grave.[74]
Trattamento
[modifica | modifica wikitesto]Tumore esocrino
[modifica | modifica wikitesto]A seguito della diagnosi, si procede con la valutazione circa la possibilità di eseguire un intervento chirurgico di resezione, l'unico trattamento che possa essere curativo. La decisione è vincolata soprattutto dal grado di diffusione del tumore, ma anche la posizione esatta della massa neoplastica è un fattore significativo e le immagini ottenute tramite tomografia computerizzata (TC) possono mostrare il suo rapporto anatomico coi principali vasi sanguigni. Anche la condizione di salute generale del paziente deve essere valutata, tuttavia l'età di per sé non rappresenta un ostacolo alla chirurgia.[5]
Se la prospettiva chirurgica non è possibile, la chemioterapia e, in misura minore, la radioterapia sono approcci che possono essere proposti nella maggioranza dei casi. Gli specialisti consigliano di affidare la gestione di un tumore pancreatico a un gruppo multidisciplinare di cui facciano parte specialisti in diversi ambiti dell'oncologia e quindi sono da preferire i centri di riferimento più grandi.[2][5]
Chirurgia
[modifica | modifica wikitesto]

L'intervento chirurgico a scopo curativo è possibile solo in circa un quinto (20%) dei nuovi casi.[3] Sebbene la TC aiuti molto a valutare la morfologia e i rapporti anatomici di un tumore, in pratica può essere difficile determinare se esso può essere completamente rimosso (ovvero, la sua "resecabilità") senza ledere organi vitali vicini; talvolta ciò può essere valutato solamente durante l'intervento chirurgico stesso. La resezione chirurgica può risultare un approccio non perseguibile per una serie di fattori, tra cui l'anatomia circostante alla massa o il coinvolgimento dei vasi sanguigni venosi o arteriosi,[2] nonché la competenza del team chirurgico e un'attenta considerazione delle previsioni circa il decorso post-operatorio.[75][76] L'età della persona non è di per sé un motivo per sconsigliare l'intervento, ma lo stato di salute generale del paziente deve essere valutato.[3]
Un particolare aspetto che può rivelarsi determinante per una positiva valutazione circa la fattibilità dell'intervento è l'eventuale presenza di uno strato di grasso posto a barriera tra il tumore e i vasi sanguigni adiacenti.[5] Talvolta è possibile procedere a una resezione anche nel caso che vi sia la presenza di vasi,[77][78] soprattutto se risulta attuabile una terapia neoadiuvante preliminare,[79][80][81] tramite la chemioterapia[76][82][83] e/o la radioterapia al fine di diminuire le dimensioni della massa neoplastica.[82]
Anche quando si ritiene che l'operazione abbia avuto successo, possono esserci delle condizioni che portano a una ricrescita del tumore. Ad esempio, cellule cancerose possono rimanere attorno ai bordi ("margini") del tessuto rimosso e il successivo esame istologico effettuato da un patologo può dimostrare se il tumore non sia stato effettivamente completamente resecato.[2] Inoltre, le cellule staminali del tumore, solitamente non sono evidenti al microscopio e se sono presenti possono continuare a svilupparsi e diffondersi.[84][85] Una laparoscopia esplorativa (un intervento chirurgico mini invasivo guidato da una fotocamera) può quindi essere eseguito per avere un'idea più chiara del risultato post-chirurgico.[86]
Per i tumori che coinvolgono la testa del pancreas, la procedura di Whipple è il trattamento chirurgico più comunemente adottato a scopo curativo. Esso consiste in un intervento di grande portata che comporta la rimozione della testa del pancreas e la curva del duodeno ("pancreatoduodenectomia"), andando a realizzare per il passaggio del cibo un bypass dallo stomaco al digiuno ("gastro-digiuno-stomia") e anastomizzando il digiuno al dotto cistico al fine di drenare la bile ("colecisto-digiunostomia"). Tale procedura può essere eseguita solo se il paziente possiede una buona probabilità di sopravvivenza a una procedura chirurgica maggiore e se il tumore appare localizzato, senza che vi sia invasione delle strutture locali o la presenza di metastasi; pertanto solo pochi casi possone essere eleggibili. I tumori della coda del pancreas possono essere asportati utilizzando una procedura nota come pancreasectomia distale, che comporta spesso anche la rimozione della milza.[2][5] A partire dagli anni 2000, tale intervento può essere eseguito anche utilizzando la chirurgia mini-invasiva.[2][5]
La radicalità dell'intervento è classificabile in tre gradi:
| Grado | Descrizione |
|---|---|
| R0: | Completa |
| R1: | Assenza di malattia a livello macroscopico con permanenza a livello microscopico (margini non "puliti") |
| R2: | Permanenza di malattia a livello macroscopico |
Per valutare l'estensione vascolare si usa la classificazione di Ishikawa sui dati risultanti da indagini angiografiche[78][87]:
| Grado | Descrizione |
|---|---|
| Grado 1: | Vaso indenne |
| Grado 2: | Interessata la parete destra della vena mesenterica superiore |
| Grado 3: | Come la precedente, più confluenza della vena porta |
| Grado 4: | Infiltrata tutta la circonferenza della vena mesenterica superiore |
| Grado 5: | Come la precedente, più confluenza della vena porta |
In caso di interessamento dal grado 1 al 3, è possibile ricostruire i vasi tramite anastomosi, innesti autologhi, protesi, shunt portosistemico, patch peritoneali; a volte, è anche possibile scegliere di non ricostruire (intervento di Appleby).[78][87][88]
Anche se la chirurgia curativa non è più caratterizzata dagli elevati tassi di mortalità che si registravano fino agli anni 1980, una percentuale rilevante di pazienti (circa il 30% ÷ 45%) sono costretti a ricorrere a ulteriori trattamenti post-operatori non dovuti al tumore stesso. La complicanza più comune della chirurgia è la conseguente difficoltà nello svuotamento dello stomaco.[5] Alcuni interventi chirurgici più limitati possono essere utilizzati per alleviare alcuni sintomi. Ad esempio, se il tumore sta invadendo o comprimendo il duodeno o il colon, la realizzazione di un bypass chirurgico può superare l'ostruzione e migliorare di conseguenza la qualità della vita.[3]
Chemioterapia
[modifica | modifica wikitesto]
Dopo l'intervento chirurgico e un periodo di recupero di 1-2 mesi, la chemioterapia come terapia adiuvante con gemcitabina o 5-FU può essere proposta se il paziente risulta sufficientemente ristabilito.[6][65] In coloro che non risultano adatti per la chirurgia curativa, la chemioterapia può essere utilizzata per prolungare la vita o migliorarne la qualità.[5] Prima della chirurgia, chemioterapia o la chemioradioterapia neoadiuvante possono essere proposte nei casi considerati al limite della resecabilità, al fine di ridurre la massa neoplastica a una dimensione in cui l'intervento chirurgico può essere effettuabile e utile. In altri casi, la terapia neoadiuvante rimane controversa poiché comporta un inevitabile ritardo nell'esecuzione dell'intervento chirurgico.[5][6][89]
Per i pazienti con carcinoma pancreatico avanzato, la gemcitabina è stata approvata dalla statunitense Food and Drug Administration (FDA) nel 1997, dopo che uno studio clinico ha riportato miglioramenti nella qualità della vita e un aumento di cinque settimane nella durata mediana di sopravvivenza.[90] La chemioterapia con la sola gemcitabina è stata per circa un decennio lo standard e un certo numero di studi clinici che la vedevano in combinazione con altri farmaci non hanno dimostrato risultati significativamente migliori. Tuttavia, nel 2005, è stato dimostrato che la combinazione di gemcitabina con erlotinib sia in grado di aumentare, seppur modestamente, la sopravvivenza e l'erlotinib è stato quindi autorizzato dalla FDA per l'uso nelle neoplasie maligne pancreatiche.[91]
Il regime chemioterapico FOLFIRINOX, che comporta l'assunzione di quattro farmaci, si è dimostrato più efficace della gemcitabina, ma presenta effetti collaterali significativi, ed è quindi adatto solo per le persone con una buona condizione di base. Identica cosa per il nab-paclitaxel, che è stato autorizzato dalla FDA nel 2013 per l'uso combinato con la gemcitabina per i tumori pancreatici.[92] Dalla fine del 2013, sia il FOLFIRINOX sia il nab-paclitaxel con gemcitabina, sono stati considerati come buone scelte per chi è in grado di tollerare gli effetti collaterali e la terapia con la sola gemcitabina è rimasta un'opzione efficace per coloro che non lo sono. Tuttavia, nonostante queste ricerche, i tempi di sopravvivenza appaiono aumentati di solo circa un paio di mesi.[90] Qualora si manifesti progressione a seguito di trattamenti con questi regimi terapeutici, è possibile utilizzare la combinazione nal-irinotecano (irinotecano nanoliposomiale) con fluorouracile.[93] Sovente vengono intrapresi ulteriori studi clinici per realizzare nuove terapie adiuvanti.[6]
Radioterapia
[modifica | modifica wikitesto]Fin dagli anni 1980, il ruolo della radioterapia come trattamento adiuvante ausiliario dopo un intervento chirurgico potenzialmente curativo, è considerato un argomento controverso.[5] Molti studi clinici hanno testato una varietà di combinazioni di trattamento, ma non sono riusciti a risolvere la questione in modo conclusivo.[5][6] La Società Europea di Oncologia Medica raccomanda che la radioterapia adiuvante sia prescritta solo per le persone inserite in uno studio clinico.[65]
La radioterapia può far parte di un trattamento che mira a ridurre un tumore a uno stato resecabile, ma il suo utilizzo sui tumori non operabili rimane dubbio in quanto vi sono risultati contraddittori provenienti da numerosi studi. I risultati di uno studio, presentato nel 2013, hanno "notevolmente ridotto l'entusiasmo" per il suo utilizzo sui tumori localmente avanzati.[2]
PanNET
[modifica | modifica wikitesto]Il trattamento dei PanNET, inclusi i tipi maligni meno comuni, può includere una serie di approcci.[94][95][96][97] Alcuni piccoli tumori inferiori a 1 cm, che spesso vengono identificati casualmente, ad esempio durante una tomografia computerizzata eseguita per altri scopi, possono essere gestiti attraverso una vigile attesa.[94] Questo dipende dalla valutazione del rischio chirurgico, correlato dalla posizione del tumore e alla presenza di eventuali altri problemi medici.[94] I tumori unici all'interno del pancreas (tumori localizzati) o con limitate metastasi, ad esempio al fegato, possono essere rimossi a seguito di un intervento chirurgico. Il tipo di intervento dipende dalla localizzazione del tumore e dal livello di diffusione linfonodale.[16]
Per i tumori localizzati, le procedure chirurgiche possono essere nettamente meno invasive rispetto a quelle utilizzate per il trattamento dell'adenocarcinoma pancreatico, altrimenti sono molto simili a quelle per i tumori esocrini. I possibili risultati possono variare notevolmente: alcune tipologie hanno un tasso di sopravvivenza molto alto dopo l'intervento chirurgico, mentre altre hanno un decorso meno positivo. Essendo che queste situazioni si presentano abbastanza raramente, le linee guida sottolineano che il trattamento debba essere effettuato in un centro specializzato.[16][22] Nei casi di presenza di metastasi epatiche può essere considerato il ricorso al trapianto di fegato.[98]
Per i tumori endocrini (o "funzionanti"), i farmaci analoghi alla somatostatina, come l'octreotide, sono in grado di ridurre l'eccessiva produzione di ormoni.[16] Il lanreotide può rallentare la crescita del tumore.[99] Se il tumore non è suscettibile di rimozione chirurgica ed è causa di sintomi, la terapia mirata con everolimus o sunitinib può ridurre le sue manifestazioni e rallentare la progressione della malattia. La chemioterapia citotossica standard non è in genere molto efficace per il trattamento dei PanNET, ma può essere utilizzata quando altri trattamenti farmacologici non riescono a prevenire la progressione della malattia[22][100] o nel caso di tumori PanNET scarsamente differenziati.[101]
La radioterapia viene talvolta utilizzata se vi è dolore dovuto alla compressione degli organi adiacenti conseguente all'estensione della massa tumorale, come ad esempio nelle metastasi alle ossa. Alcuni PanNET assorbono peptidi o ormoni specifici e possono rispondere alla terapia di medicina nucleare con peptidi radiomarcati o con ormoni come lo iobenguane (iodio-131-MIBG).[102][103][104][105] L'ablazione a radiofrequenza (RFA), può essere utilizzata anche con la crioablazione e l'embolizzazione dell'arteria epatica.[106][107]
Cure palliative
[modifica | modifica wikitesto]Le cure palliative sono cure mediche che si concentrano sul trattamento dei sintomi di una malattia grave, come può essere il tumore, al fine di migliorare la qualità della vita.[108] Siccome l'adenocarcinoma pancreatico viene solitamente diagnosticato quando si trova già a uno stadio avanzato, le cure palliative sono spesso l'unico trattamento possibile.[109]
Esse non si focalizzano sul trattamento del tumore stesso, ma sulla gestione dei sintomi, come il dolore e la nausea, aiutando nel processo decisionale di approccio alla malattia. Il dolore può essere gestito tramite farmaci, come gli oppioidi o attraverso alcune procedure interventistiche, come un blocco nervoso sul plesso celiaco. Ciò altera, o distrugge (a seconda della tecnica utilizzata), i nervi che trasmettono il dolore. Tale intervento è un modo sicuro ed efficace per ridurre il dolore, diminuendo generalmente la necessità di utilizzare analgesici oppioidi che presentano significativi effetti collaterali negativi.[5][110]
Altri sintomi o complicazioni che possono essere trattati con la chirurgia palliativa sono le ostruzioni dovute alla massa tumorale dell'intestino o dei dotti biliari. Per questi ultimi, che vengono compromessi in più della metà dei casi, un piccolo tubo metallico, chiamato stent può essere inserito tramite procedura endoscopica per mantenere i condotti pervi.[32] Le cure palliative possono anche aiutare nella gestione della depressione clinica che spesso si accompagna alla diagnosi di una neoplasia pancreatica.[5]
Sia la chirurgia sia i tumori inoperabili in fase avanzata, spesso portano a disturbi del sistema digerente per colpa di una mancanza di prodotti esocrini del pancreas (insufficienza esocrina). Questi possono essere trattati assumendo pancreatina che contiene enzimi pancreatici.[3] La difficoltà nello svuotamento dello stomaco è frequente e può rappresentare un problema serio, che comporta l'ospedalizzazione. Il trattamento può comportare una varietà di approcci, tra cui lo svuotamento dello stomaco mediante aspirazione nasogastrica e l'assunzione di farmaci chiamati inibitori della pompa protonica o antagonisti H2, i quali sono in grado di ridurre la produzione di succo gastrico.[3]
Prognosi
[modifica | modifica wikitesto]| Stadiazione clinica | Sopravvivenza a cinque anni (%) – diagnosi tra il 1992 e il 1998 negli USA | |
|---|---|---|
| Tumori pancreatici esocrini | Tumori neuroendocrini trattati con la chirurgia | |
| IA / I | 14 | 61 |
| IB | 12 | |
| IIA / II | 7 | 52 |
| IIB | 5 | |
| III | 3 | 41 |
| IV | 1 | 16 |
Tipicamente, i pazienti con adenocarcinoma pancreatico o altri tumori esocrini meno comuni, non hanno una buona prognosi, in parte perché spesso la diagnosi viene formulata quando il tumore è già localmente avanzato o si è diffuso ad altre parti del corpo.[2]
Risultati migliori si hanno nel caso dei PanNET, molti dei quali sono benigni e non presentano sintomi clinici e i casi non trattabili con la chirurgia hanno un tasso medio di sopravvivenza a cinque anni del 16%,[71] anche se le prospettive variano notevolmente a seconda del tipo.[111]
Per l'adenocarcinoma pancreatico localmente avanzato e quello metastatico, che insieme rappresentano oltre l'80% dei casi, numerosi studi recenti mirati a confrontare i diversi regimi chemioterapici, hanno mostrato un aumento della sopravvivenza, ma non superiore all'anno.[2][90] Negli Stati Uniti, la sopravvivenza globale a cinque anni per il tumore pancreatico è migliorata negli anni, passando dal 2% nei casi diagnosticati tra il 1975 e il 1977, al 4% tra quelli rilevati dal 1987 al 1989, al 6% tra quelli scoperti dal 2003 al 2009.[112] In meno del 20% dei casi di adenocarcinoma del pancreas con diagnosi di una crescita cancerosa localizzata e di scarse dimensioni (meno di 2 cm in fase T1), circa il 20% degli statunitensi sono sopravvissuti a cinque anni.[14]
Nel Regno Unito, la sopravvivenza a un anno è stimata del 19,2% nelle femmine e del 18,47% negli uomini, mentre a 5 anni appare rispettivamente del 4,7% e del 4,4%.[113]
Spesso il cancro pancreatico provoca collateralmente il diabete mellito. La produzione di insulina viene diminuita per la progressiva compressione, invasione e distruzione delle cellule β nelle isole di Langerhans. Alcuni autori hanno suggerito che il cancro possa provocare l'instaurarsi del diabete e viceversa.[114]
Stato della ricerca
[modifica | modifica wikitesto]
In tutto il mondo vi sono ricercatori impegnati su molti livelli al fine di comprendere il meccanismo di sviluppo e progressione del tumore al pancreas, ma i progressi appaiono lenti, soprattutto nella comprensione delle cause della malattia.[115] Vi sono diversi interrogativi fondamentali che non hanno trovato ancora una risposta.[116][117] La natura delle mutazioni che porta alla malattia viene intensamente studiata, come ad esempio il ruolo svolto da alcuni geni, come KRAS e p53.[43][118][119] Una questione chiave è la cronologia degli eventi, ovvero come la malattia si sviluppa e progredisce - in particolare correlandoli con il ruolo svolto dal diabete[120] e le tempistiche e modalità della diffusione della malattia.[121]
Vi è anche in corso una ricerca sulla possibilità di ottenere una diagnosi precoce.[63][64] Ad esempio, l'European Registry of Hereditary Pancreatitis and Familial Pancreatic Cancer (EUROPAC) è stato istituito per indagare se lo screening regolare sia appropriato per coloro che hanno una storia familiare della malattia o che hanno pancreatite ereditaria.[122]
Un'altra area di interesse è lo studio circa la validità della chirurgia mininvasiva (laparoscopia) rispetto alla procedura di Whipple, soprattutto in termini di tempo di recupero.[123] L'elettroporazione irreversibile è una tecnica di ablazione relativamente nuova che ha mostrato promettenti risultati nel downstaging (contenimento della malattia) e nel prolungare la sopravvivenza nelle persone in uno stadio avanzato della condizione. È particolarmente adatta per il trattamento di tumori che sono in prossimità dei vasi peri-pancreatici senza che vi siano rischi di traumi vascolari.[85][124] I limitati successi in seguito alla chirurgia hanno portato a una serie di studi circa l'utilizzo della chemioterapia o della radiochemioterapia prima dell'intervento chirurgico.[2]
Vi sono, inoltre, notevoli sforzi circa lo sviluppo di nuovi farmaci.[64][125] Alcuni di questi consistono in una terapia mirata contro i meccanismi molecolari delle cellule tumorali.[126][127] Altri, invece, mirano a colpire le cellule staminali del tumore ad alta resistenza.[128][129] Altri ancora hanno lo scopo di influenzare le cellule stromali non-neoplastiche e il microambiente del tumore, che è noto per influenzare la proliferazione cellulare e le metastasi.[124][127][130][131][132] Un ulteriore approccio implica l'uso dell'immunoterapia, come ad esempio i virus oncolitici.[133][134][135]
Note
[modifica | modifica wikitesto]- ^ (EN) National Cancer Institute, What is Cancer? Defining Cancer, su cancer.gov, National Institutes of Health, marzo 2014. URL consultato il 5 dicembre 2014.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae Ryan DP, Hong TS, Bardeesy N, Pancreatic adenocarcinoma (PDF), in N. Engl. J. Med., vol. 371, n. 11, pp. 1039–49, DOI:10.1056/NEJMra1404198, PMID 25207767 (archiviato dall'url originale il 26 dicembre 2014).
- ^ a b c d e f g h i j k l m n o p q r s Bond-Smith G et al., Pancreatic adenocarcinoma (PDF), in BMJ (Clinical research ed.), vol. 344, 2012, p. e2476, DOI:10.1136/bmj.e2476, PMID 22592847 (archiviato dall'url originale il 9 gennaio 2015).
- ^ a b c d e f g h i j k l m World Cancer Report 2014, World Health Organization, 2014, ISBN 92-832-0429-8.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad Wolfgang CL, Herman JM, Laheru DA, Klein AP, Erdek MA, Fishman EK, Hruban RH, Recent progress in pancreatic cancer, in CA: a Cancer Journal for Clinicians, vol. 63, n. 5, September 2013, pp. 318–48, DOI:10.3322/caac.21190, PMC 3769458, PMID 23856911.
- ^ a b c d e f g h i Vincent AJ et al., Pancreatic cancer (PDF), in Lancet, vol. 378, n. 9791, agosto 2011, pp. 607–620, DOI:10.1016/S0140-6736(10)62307-0, PMID 21620466 (archiviato dall'url originale il 12 gennaio 2015).
- ^ Bussom S, Saif MW, Methods and rationale for the early detection of pancreatic cancer. Highlights from the "2010 ASCO Gastrointestinal Cancers Symposium". Orlando, FL, USA. January 22–24, 2010, in JOP : Journal of the pancreas, vol. 11, n. 2, marzo 2010, pp. 128–130, PMID 20208319. URL consultato l'8 maggio 2015 (archiviato dall'url originale l'8 dicembre 2014).
- ^ (EN) Pancreatic Cancer Treatment Patient Version, in National Cancer Institute, National Institutes of Health, aprile 2014. URL consultato l'8 giugno 2014.
- ^ Shahrokni A, Saif MW, Metastatic pancreatic cancer: the dilemma of quality vs. quantity of life, in JOP : Journal of the pancreas, vol. 14, n. 4, luglio 2013, pp. 391–394, DOI:10.6092/1590-8577/1663, PMID 23846935.
- ^ Bardou M, Le Ray I, Treatment of pancreatic cancer: A narrative review of cost-effectiveness studies, in Best practice & research. Clinical gastroenterology, vol. 27, n. 6, dicembre 2013, pp. 881–892, DOI:10.1016/j.bpg.2013.09.006, PMID 24182608.
- ^ Hariharan D, Saied A, Kocher HM, Analysis of mortality rates for pancreatic cancer across the world, in HPB, vol. 10, n. 1, 2008, pp. 58–62, DOI:10.1080/13651820701883148, PMC 2504856, PMID 18695761.
- ^ (EN) Lifetime Risk of Developing or Dying From Cancer, in American Cancer Society, ottobre 2014. URL consultato il 1º dicembre 2014 (archiviato dall'url originale il 25 novembre 2016).
- ^ (EN) Cancer Facts & Figures 2010 (PDF), in American Cancer Society, 2010. URL consultato il 5 dicembre 2014 (archiviato dall'url originale il 14 gennaio 2015). Vedi p. 4 per la stima dell'incidenza e p. 19 per la percentuale di sopravvivenza.
- ^ a b (EN) Pancreatic Cancer Treatment (PDQ®) Health Professional Version, in National Cancer Institute, National Institutes of Health, febbraio 2014. URL consultato il 24 novembre 2014.
- ^ RE Harris, Epidemiology of pancreatic cancer, in Epidemiology of Chronic Disease, Jones & Bartlett, 2013, pp. 181–190, ISBN 978-0-7637-8047-0.
- ^ a b c d e Öberg K, Knigge U, Kwekkeboom D, Perren A, Neuroendocrine gastro-entero-pancreatic tumors: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up, in Annals of Oncology: Official Journal of the European Society for Medical Oncology / ESMO, 23 Suppl 7, ottobre 2012, pp. vii124–130, DOI:10.1093/annonc/mds295, PMID 22997445.
- ^ a b Govindan R, DeVita, Hellman, and Rosenberg's Cancer: Cancer: Principles & Practice of Oncology, 9ª ed., Lippincott Williams & Wilkins, 2011, ISBN 978-1-4511-0545-2.
- ^ a b Tobias JS, Hochhauser D, Cancer and its Management, 6ª ed., 2010, pp. 276–277, ISBN 978-1-118-71325-9.
- ^ a b c (EN) Types of Pancreas Tumors, in The Sol Goldman Pancreas Cancer Research Center, Johns Hopkins Medicine, 2012. URL consultato il 18 novembre 2014 (archiviato dall'url originale l'8 ottobre 2014).
- ^ Farrell JJ, Fernández-del Castillo C, Pancreatic cystic neoplasms: management and unanswered questions, in Gastroenterology, vol. 144, n. 6, giugno 2013, pp. 1303–1315, DOI:10.1053/j.gastro.2013.01.073, PMID 23622140.
- ^ a b c Klimstra DS, Modlin IR, Coppola D, Lloyd RV, Suster S, The pathologic classification of neuroendocrine tumors: a review of nomenclature, grading, and staging systems (PDF), in Pancreas, vol. 39, n. 6, August 2010, pp. 707–12, DOI:10.1097/MPA.0b013e3181ec124e, PMID 20664470. URL consultato l'8 maggio 2015 (archiviato dall'url originale il 24 settembre 2015).
- ^ a b c d e f g Burns WR, Edil BH, Neuroendocrine pancreatic tumors: guidelines for management and update, in Current treatment options in oncology, vol. 13, n. 1, March 2012, pp. 24–34, DOI:10.1007/s11864-011-0172-2, PMID 22198808.
- ^ (EN) WHO Disease and injury country estimates, in World Health Organization, 2009. URL consultato l'11 novembre 2009.
- ^ Lozano R et al., Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010, in Lancet, vol. 380, n. 9859, December 2012, pp. 2095–128, DOI:10.1016/S0140-6736(12)61728-0, PMID 23245604.
- ^ Jemal A et al., Cancer statistics, 2007, in CA, vol. 57, n. 1, 2007, pp. 43–66, DOI:10.3322/canjclin.57.1.43, PMID 17237035.
- ^ (EN) What are the key statistics about pancreatic cancer?, in American Cancer Society, giugno 2014. URL consultato l'11 novembre 2014 (archiviato dall'url originale l'11 novembre 2014).
- ^ a b (EN) Pancreatic cancer statistics, in Cancer Research UK. URL consultato il 28 ottobre 2014.
- ^ a b Busnardo AC, DiDio LJ, Tidrick RT, Thomford NR, History of the pancreas, in American Journal of Surgery, vol. 146, n. 5, 1983, pp. 539–50, DOI:10.1016/0002-9610(83)90286-6, PMID 6356946.
- ^ a b c Are C, Dhir M, Ravipati L, History of pancreaticoduodenectomy: early misconceptions, initial milestones and the pioneers, in HPB : the official journal of the International Hepato Pancreato Biliary Association, vol. 13, n. 6, June 2011, pp. 377–84, DOI:10.1111/j.1477-2574.2011.00305.x, PMID 21609369.
- ^ a b Cameron JL, Riall TS, Coleman J, Belcher KA, One thousand consecutive pancreaticoduodenectomies, in Annals of surgery, vol. 244, n. 1, July 2006, pp. 10–5, DOI:10.1097/01.sla.0000217673.04165.ea, PMID 16794383.
- ^ Fernández-del Castillo C, Morales-Oyarvide V, McGrath D, Wargo JA, Ferrone CR, Thayer SP, Lillemoe KD, Warshaw AL, Evolution of the Whipple procedure at the Massachusetts General Hospital, in Surgery, vol. 152, 3 Suppl 1, September 2012, pp. S56–63, DOI:10.1016/j.surg.2012.05.022, PMC 3806095, PMID 22770961.
- ^ a b c d e f g h De La Cruz MS, Young AP, Ruffin MT, Diagnosis and management of pancreatic cancer, in Am Fam Physician, vol. 89, n. 8, April 2014, pp. 626–32, PMID 24784121.
- ^ a b SR Alberts e RM Goldberg, Chapter 9: Gastrointestinal tract cancers, in DA Casciato e MC Territo (a cura di), Manual of clinical oncology, Lippincott Williams & Wilkins, 2009, pp. 188–236, ISBN 978-0-7817-6884-9.
- ^ Pannala R, Basu A, Petersen GM, Chari ST, New-onset diabetes: a potential clue to the early diagnosis of pancreatic cancer, in The Lancet. Oncology, vol. 10, n. 1, January 2009, pp. 88–95, DOI:10.1016/S1470-2045(08)70337-1, PMC 2795483, PMID 19111249.
- ^ (EN) Tomislav Dragovich, N Joseph Espat, Pancreatic Cancer Clinical Presentation, su emedicine.medscape.com, Medscape. URL consultato il 19 giugno 2016.
- ^ Chapter 15; Pancreas (PDF), in Manual for Staging of Cancer, 2ª ed., American Joint Committee on Cancer, pp. 95–8.
- ^ (EN) Causes of pancreatic cancer, in NHS Choices, National Health Service, England, 7 ottobre 2014. URL consultato il 5 dicembre 2014.
- ^ Iodice S, Gandini S, Maisonneuve P, Lowenfels AB, Tobacco and the risk of pancreatic cancer: a review and meta-analysis, in Langenbeck's Archives of Surgery, vol. 393, n. 4, luglio 2008, pp. 535–45, DOI:10.1007/s00423-007-0266-2, PMID 18193270.
- ^ Bosetti C et al., Cigarette smoking and pancreatic cancer: an analysis from the International Pancreatic Cancer Case-Control Consortium (Panc4), in Annals of Oncology, vol. 23, n. 7, July 2012, pp. 1880–8, DOI:10.1093/annonc/mdr541, PMID 22104574.
- ^ (EN) Obesity Linked to Pancreatic Cancer, in American Cancer Society, Cancer Epidemiology, Biomarkers & Prevention (Vol. 14, No. 2: 459–466), 6 marzo 2005. URL consultato il 5 marzo 2008 (archiviato dall'url originale il 5 febbraio 2008).
- ^ ML Peters, JF Tseng e RA Miksad, Genetic Testing in Pancreatic Ductal Adenocarcinoma: Implications for Prevention and Treatment., in Clinical therapeutics, 31 marzo 2016, PMID 27041411.
- ^ Efthimiou E, Crnogorac-Jurcevic T, Lemoine NR, Brentnall TA, Inherited predisposition to pancreatic cancer, in Gut, vol. 48, n. 2, febbraio 2001, pp. 143–7, DOI:10.1136/gut.48.2.143, PMC 1728218, PMID 11156628.
- ^ a b c Reznik R, Hendifar AE, Tuli R, Genetic determinants and potential therapeutic targets for pancreatic adenocarcinoma, in Front Physiol, vol. 5, 2014, p. 87, DOI:10.3389/fphys.2014.00087, PMC 3939680, PMID 24624093.
- ^ Greenhalf W, Grocock C, Harcus M, Neoptolemos J, Screening of high-risk families for pancreatic cancer, in Pancreatology, vol. 9, n. 3, 2009, pp. 215–22, DOI:10.1159/000210262, PMID 19349734.
- ^ (EN) Causal Agent-Cancer Links in Haz-Map, su haz-map.com. URL consultato il 17 giugno 2016.
- ^ Chan JM, Wang F, Holly EA, Vegetable and fruit intake and pancreatic cancer in a population-based case-control study in the San Francisco bay area, in Cancer Epidemiology, Biomarkers & Prevention, vol. 14, n. 9, settembre 2005, pp. 2093–7, DOI:10.1158/1055-9965.EPI-05-0226, PMID 16172215.
- ^ Venturi, Sebastiano, Cesium in Biology, Pancreatic Cancer, and Controversy in High and Low Radiation Exposure Damage., in Int. J. Environ. Res. Public Health, 18(4):1-15, 2021, DOI:10.3390/ijerph18178934.
- ^ (EN) Red Meat May Be Linked to Pancreatic Cancer, in Journal of the National Cancer Institute, WebMD, 5 ottobre 2005. URL consultato il 5 marzo 2008.
- ^ (EN) Cancer Facts and Figures 2014 (PDF), in American Cancer Society. URL consultato il 5 gennaio 2015 (archiviato dall'url originale il 18 dicembre 2014)., p. 19, "Though evidence is still accumulating, consumption of red or processed meat, or meat cooked at very high temperatures, may slightly increase risk."
- ^ Larsson SC, Wolk A, Red and processed meat consumption and risk of pancreatic cancer: meta-analysis of prospective studies, in Br J Cancer, Online first, n. 3, January 2012, pp. 603–7, DOI:10.1038/bjc.2011.585, PMC 3273353, PMID 22240790.
- ^ (EN) Soft Drink and Juice Consumption and Risk of Pancreatic Cancer: The Singapore Chinese Health Study, su cebp.aacrjournals.org.
- ^ (EN) Cancer cells slurp up fructose, U.S. study says, su healthzone.ca, Reuters, 2 agosto 2010. URL consultato il 2 agosto 2010.
- ^ Raderer M, Wrba F, Kornek G, Maca T, Koller DY, Weinlaender G, Hejna M, Scheithauer W, Association between Helicobacter pylori infection and pancreatic cancer, in Oncology, vol. 55, n. 1, 1998, pp. 16–9, DOI:10.1159/000011830, PMID 9428370.
- ^ Stolzenberg-Solomon RZ, Blaser MJ, Limburg PJ, Perez-Perez G, Taylor PR, Virtamo J, Albanes D, Helicobacter pylori seropositivity as a risk factor for pancreatic cancer, in J. Natl. Cancer Inst., vol. 93, n. 12, 2001, pp. 937–41, DOI:10.1093/jnci/93.12.937, PMID 11416115.
- ^ Michaud DS, Joshipura K, Giovannucci E, Fuchs CS, A prospective study of periodontal disease and pancreatic cancer in US male health professionals, in Journal of the National Cancer Institute, vol. 99, n. 2, gennaio 2007, pp. 171–5, DOI:10.1093/jnci/djk021, PMID 17228001.
- ^ a b Pericleous M, Rossi RE, Mandair D, Whyand T, Caplin ME, Nutrition and pancreatic cancer., in Anticancer research, vol. 34, n. 1, January 2014, pp. 9–21, PMID 24403441.
- ^ Delpu Y, Hanoun N, Lulka H, Sicard F, Selves J, Buscail L, Torrisani J, Cordelier P, Genetic and epigenetic alterations in pancreatic carcinogenesis, in Curr Genomics, vol. 12, n. 1, 2011, pp. 15–24, DOI:10.2174/138920211794520132, PMC 3129039, PMID 21886451.
- ^ Lewis MA, Yao JC, Molecular pathology and genetics of gastrointestinal neuroendocrine tumours, in Current Opinion in Endocrinology & Diabetes and Obesity, vol. 21, n. 1, Febbraio 2014, pp. 22–7, DOI:10.1097/MED.0000000000000033, PMID 24310147.
- ^ Thakker RV, Clinical practice guidelines for multiple endocrine neoplasia type 1 (MEN1) (PDF), in The Journal of Clinical Endocrinology and Metabolism, vol. 97, n. 9, September 2012, pp. 2990–3011, DOI:10.1210/jc.2012-1230, PMID 22723327. URL consultato il 18 giugno 2016 (archiviato dall'url originale il 17 febbraio 2015).
- ^ Diet and activity factors that affect risks for certain cancers: Pancreatic cancer section, in American Cancer Society, 20 agosto 2012. URL consultato il 4 novembre 2014 (archiviato dall'url originale il 4 novembre 2014).
- ^ Thiébaut AC, Jiao L, Silverman DT, Cross AJ, Thompson FE, Subar AF, Hollenbeck AR, Schatzkin A, Stolzenberg-Solomon RZ, Dietary fatty acids and pancreatic cancer in the NIH-AARP diet and health study, in J. Natl. Cancer Inst., vol. 101, n. 14, 2009, pp. 1001–11, DOI:10.1093/jnci/djp168, PMC 2724851, PMID 19561318.
- ^ Barreto SG, Neale RE, Vitamin D and pancreatic cancer, in Cancer Lett., vol. 368, n. 1, 2015, pp. 1–6, DOI:10.1016/j.canlet.2015.06.030, PMID 26276715.
- ^ a b He XY, Yuan YZ, Advances in pancreatic cancer research: moving towards early detection, in World J. Gastroenterol., vol. 20, n. 32, August 2014, pp. 11241–8, DOI:10.3748/wjg.v20.i32.11241, PMC 4145762, PMID 25170208.
- ^ a b c d Okano K, Suzuki Y, Strategies for early detection of resectable pancreatic cancer, in World J. Gastroenterol., vol. 20, n. 32, August 2014, pp. 11230–40, DOI:10.3748/wjg.v20.i32.11230, PMC 4145761, PMID 25170207.
- ^ a b c d Seufferlein T, Bachet JB, Van Cutsem E, Rougier P, Pancreatic adenocarcinoma: ESMO-ESDO Clinical Practice Guidelines for diagnosis, treatment and follow-up, in Annals of oncology : official journal of the European Society for Medical Oncology / ESMO, 23 Suppl 7, October 2012, pp. vii33–40, DOI:10.1093/annonc/mds224, PMID 22997452.
- ^ Stoita A, Penman ID, Williams DB, Review of screening for pancreatic cancer in high risk individuals, in World J. Gastroenterol., vol. 17, n. 19, May 2011, pp. 2365–71, DOI:10.3748/wjg.v17.i19.2365, PMC 3103788, PMID 21633635.
- ^ Stefano Cascinu, Tumore del pancreas, su startoncology.net. URL consultato il 19 giugno 2016.
- ^ Fitzgerald JE, White MJ, Lobo DN, Courvoisier's gallbladder: law or sign? (PDF), in World Journal of Surgery, vol. 33, n. 4, April 2009, pp. 886–91, DOI:10.1007/s00268-008-9908-y, PMID 19190960.
- ^ (EN) Tomislav Dragovich, Joseph Espat, Pancreatic Cancer Workup, su emedicine.medscape.com, Medscape. URL consultato il 29 giugno 2016.
- ^ Cascinu S, Falconi M, Valentini V, Jelic S, Pancreatic cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up, in Annals of Oncology: Official Journal of the European Society for Medical Oncology / ESMO, 21 Suppl 5, May 2010, pp. v55–8, DOI:10.1093/annonc/mdq165, PMID 20555103.
- ^ a b c (EN) Staging of pancreatic cancer, in American Cancer Society, 11 giugno 2014. URL consultato il 29 settembre 2014 (archiviato dall'url originale il 10 agosto 2020).
- ^ (JA) Isaji S, Kawarada Y, [Evaluation of classification of pancreatic cancer by the Japan Pancreas Society and Union Internationale Contre le Cancer and proposal for a new international classification], in Nihon Geka Gakkai Zasshi, vol. 101, n. 2, 2000, pp. 205–11, PMID 10734638.
- ^ Kobari M, Matsuno S, Staging systems for pancreatic cancer: differences between the Japanese and UICC systems, in J Hepatobiliary Pancreat Surg, vol. 5, n. 2, 1998, pp. 121–7, PMID 9745076 (archiviato dall'url originale il 10 giugno 2000).
- ^ Satoshi Kondo, Japanese Pancreas Society Staging Systems for Pancreatic Cancer, in Pancreatic cancer, Springer New York, DOI:10.1007/978-0-387-77498-5_42, ISBN 978-0-387-77497-8.
- ^ Gurusamy KS, Kumar S, Davidson BR, Fusai G, Cochrane Database of Systematic Reviews, in The Cochrane database of systematic reviews, 2: CD010244, 2014, pp. CD010244, DOI:10.1002/14651858.CD010244.pub2, PMID 24578248.
- ^ a b Mollberg N et al., Arterial resection during pancreatectomy for pancreatic cancer: A systematic review and meta-analysis, in Annals of Surgery, vol. 254, n. 6, 2011, pp. 882–93, DOI:10.1097/SLA.0b013e31823ac299, PMID 22064622.
- ^ Alamo JM et al., Improving outcomes in pancreatic cancer: key points in perioperative management, in World J. Gastroenterol., vol. 20, n. 39, 2014, pp. 14237–45, DOI:10.3748/wjg.v20.i39.14237, PMC 4202352, PMID 25339810.
- ^ a b c Lopez NE, Prendergast C, Lowy AM, Borderline resectable pancreatic cancer: definitions and management, in World J. Gastroenterol., vol. 20, n. 31, 2014, pp. 10740–51, DOI:10.3748/wjg.v20.i31.10740, PMC 4138454, PMID 25152577.
- ^ Polistina F, Di Natale G, Bonciarelli G, Ambrosino G, Frego M, Neoadjuvant strategies for pancreatic cancer, in World J. Gastroenterol., vol. 20, n. 28, 2014, pp. 9374–83, DOI:10.3748/wjg.v20.i28.9374, PMC 4110569, PMID 25071332.
- ^ Gillen S, Schuster T, Meyer Zum Büschenfelde C, Friess H, Kleeff J, Preoperative/neoadjuvant therapy in pancreatic cancer: a systematic review and meta-analysis of response and resection percentages, in PLoS Med., vol. 7, n. 4, 2010, pp. e1000267, DOI:10.1371/journal.pmed.1000267, PMC 2857873, PMID 20422030.
- ^ Christians KK, Evans DB, Additional Support for Neoadjuvant Therapy in the Management of Pancreatic Cancer, in Ann. Surg. Oncol., 2014, DOI:10.1245/s10434-014-4307-0, PMID 25519932.
- ^ a b (EN) Pancreatic adenocarcinoma. NCCN Guidelines Version 1.2015 (PDF), in NCCN Guidelines, National Comprehensive Cancer Network, Inc., 4 dicembre 2014. URL consultato il 26 dicembre 2014.
- ^ Tsvetkova EV, Asmis TR, Role of neoadjuvant therapy in the management of pancreatic cancer: is the era of biomarker-directed therapy here?, in Curr Oncol, vol. 21, n. 4, 2014, pp. e650–7, DOI:10.3747/co.21.2006, PMC 4117630, PMID 25089113.
- ^ Zhan HX, Xu JW, Wu D, Zhang TP, Hu SY, Pancreatic cancer stem cells: New insight into a stubborn disease, in Cancer Lett., vol. 357, n. 2, 2015, pp. 429–37, DOI:10.1016/j.canlet.2014.12.004, PMID 25499079.
- ^ a b Tanase CP, Neagu AI, Necula LG, Mambet C, Enciu AM, Calenic B, Cruceru ML, Albulescu R, Cancer stem cells: Involvement in pancreatic cancer pathogenesis and perspectives on cancer therapeutics, in World Journal of Gastroenterology, vol. 20, n. 31, 2014, pp. 10790-801, DOI:10.3748/wjg.v20.i31.10790, PMC 4138459, PMID 25152582.
- ^ Allen VB, Gurusamy KS, Takwoingi Y, Kalia A, Davidson BR, Diagnostic accuracy of laparoscopy following computed tomography (CT) scanning for assessing the resectability with curative intent in pancreatic and periampullary cancer, in Cochrane Database Syst Rev, vol. 11, 2013, p. CD009323, DOI:10.1002/14651858.CD009323.pub2, PMID 24272022.
- ^ a b Mullapudi B, Hawkes PJ, Patel A, Are C, Misra S, Borderline resectable pancreatic cancer, in Indian J Surg Oncol, vol. 6, n. 1, 2015, pp. 63–8, DOI:10.1007/s13193-014-0374-8, PMC 4412859, PMID 25937766.
- ^ Smoot RL, Donohue JH, Modified Appleby procedure for resection of tumors of the pancreatic body and tail with celiac axis involvement, in J. Gastrointest. Surg., vol. 16, n. 11, 2012, pp. 2167–9, DOI:10.1007/s11605-012-1925-3, PMID 22696234.
- ^ Heinemann V, Haas M, Boeck S, Neoadjuvant treatment of borderline resectable and non-resectable pancreatic cancer., in Annals of oncology : official journal of the European Society for Medical Oncology / ESMO, vol. 24, n. 10, October 2013, pp. 2484–92, DOI:10.1093/annonc/mdt239, PMID 23852311.
- ^ a b c Thota R, Pauff JM, Berlin JD, Treatment of metastatic pancreatic adenocarcinoma: a review, in Oncology (Williston Park, N.Y.), vol. 28, n. 1, January 2014, pp. 70–4, PMID 24683721.
- ^ (EN) Cancer Drug Information: FDA Approval for Erlotinib Hydrochloride, in National Cancer Institute, National Institutes of Health, 3 luglio 2013. URL consultato il 5 dicembre 2014 (archiviato dall'url originale il 29 novembre 2014).
- ^ Borazanci E, Von Hoff DD e DD Von Hoff, Nab-paclitaxel and gemcitabine for the treatment of people with metastatic pancreatic cancer, in Expert Rev Gastroenterol Hepatol, vol. 8, n. 7, September 2014, pp. 739–47, DOI:10.1586/17474124.2014.925799, PMID 24882381.
- ^ Onivyde, su U.S. Food and Drug Administration (FDA), 29 settembre 2016. URL consultato il 5 aprile 2021.
- ^ a b c Neuroendocrine tumors, NCCN Guidelines Version 1.2015 (PDF), in NCCN Guidelines, National Comprehensive Cancer Network, Inc., 11 novembre 2014. URL consultato il 25 dicembre 2014.
- ^ Falconi M et al., ENETS Consensus Guidelines for the management of patients with digestive neuroendocrine neoplasms of the digestive system: Well-differentiated pancreatic non-functioning tumors, in Neuroendocrinology, vol. 95, n. 2, 2012, pp. 120–34, DOI:10.1159/000335587, PMID 22261872.
- ^ Jensen RT et al., ENETS Consensus Guidelines for the management of patients with digestive neuroendocrine neoplasms: Functional pancreatic endocrine tumor syndromes, in Neuroendocrinology, vol. 95, n. 2, 2012, pp. 98–119, DOI:10.1159/000335591, PMC 3701449, PMID 22261919.
- ^ Pavel M et al., ENETS Consensus Guidelines for the management of patients with liver and other distant metastases from neuroendocrine neoplasms of foregut, midgut, hindgut, and unknown primary, in Neuroendocrinology, vol. 95, n. 2, 2012, pp. 157–76, DOI:10.1159/000335597, PMID 22262022.
- ^ Rossi RE, Massironi S, Conte D, Peracchi M, Therapy for metastatic pancreatic neuroendocrine tumors, in Annals of Translational Medicine, vol. 2, n. 1, 2014, p. 8, DOI:10.3978/j.issn.2305-5839.2013.03.01, PMC 4200651, PMID 25332984.
- ^ (EN) Nick Mulcahy, FDA Approves Lanreotide for Neuroendocrine Tumors, in Medscape Medical News, WebMD LLC, 17 dicembre 2014. URL consultato il 25 dicembre 2014.
- ^ Tejani MA, Saif MW, Pancreatic neuroendocrine tumors: Does chemotherapy work?, in JOP: Journal of the pancreas, vol. 15, n. 2, 2014, pp. 132–4, DOI:10.6092/1590-8577/2301, PMID 24618436.
- ^ Benson AB, Myerson RJ, Sasson AR, Pancreatic, neuroendocrine GI, and adrenal cancers. Cancer Management: A Multidisciplinary Approach 13th edition 2010., ISBN 978-0-615-41824-7. URL consultato il 18 giugno 2016 (archiviato dall'url originale il 15 maggio 2011).
- ^ Gulenchyn KY, Yao X, Asa SL, Singh S, Law C, Radionuclide therapy in neuroendocrine tumours: A systematic review, in Clinical Oncology, vol. 24, n. 4, 2012, pp. 294–308, DOI:10.1016/j.clon.2011.12.003, PMID 22221516.
- ^ Vinik AI, Advances in Diagnosis and Treatment of Pancreatic Neuroendocrine Tumors (PNETS), in Endocrine Practice, vol. 20, n. 11, 2014, pp. 1–23, DOI:10.4158/EP14373.RA, PMID 25297671.
- ^ Kwekkeboom DJ et al., Peptide receptor radionuclide therapy in patients with gastroenteropancreatic neuroendocrine tumors, in Seminars in Nuclear Medicine, vol. 40, n. 2, 2010, pp. 78–88, DOI:10.1053/j.semnuclmed.2009.10.004, PMID 20113677.
- ^ Bodei L, Cremonesi M, Kidd M, Grana CM, Severi S, Modlin IM, Paganelli G, Peptide receptor radionuclide therapy for advanced neuroendocrine tumors, in Thoracic Surgery Clinics, vol. 24, n. 3, 2014, pp. 333–49, DOI:10.1016/j.thorsurg.2014.04.005, PMID 25065935.
- ^ Castellano D et al., Expert consensus for the management of advanced or metastatic pancreatic neuroendocrine and carcinoid tumors, in Cancer Chemotherapy and Pharmacology, vol. 75, n. 6, 2014, pp. 1099–114, DOI:10.1007/s00280-014-2642-2, PMID 25480314.
- ^ Singh S et al., Consensus Recommendations for the Diagnosis and Management of Pancreatic Neuroendocrine Tumors: Guidelines from a Canadian National Expert Group, in Annals of Surgical Oncology, vol. 22, n. 8, 2014, pp. 2685–99, DOI:10.1245/s10434-014-4145-0, PMID 25366583.
- ^ (EN) Palliative or Supportive Care, su cancer.org, American Cancer Society, 2014. URL consultato il 20 agosto 2014 (archiviato dall'url originale il 21 agosto 2014).
- ^ Buanes TA, Pancreatic cancer-improved care achievable, in World journal of gastroenterology : WJG, vol. 20, n. 30, 14 agosto 2014, pp. 10405–18, DOI:10.3748/wjg.v20.i30.10405, PMID 25132756.
- ^ Arcidiacono PG, Calori G, Carrara S, McNicol ED, Testoni PA, Celiac plexus block for pancreatic cancer pain in adults, in Paolo G Arcidiacono (a cura di), Cochrane Database Syst Rev, n. 3, 2011, p. CD007519, DOI:10.1002/14651858.CD007519.pub2, PMID 21412903.
- ^ (EN) Islet Cell Tumors of the Pancreas / Endocrine Neoplasms of the Pancreas, in The Sol Goldman Pancreas Cancer Research Center, Johns Hopkins Medicine, 2012. URL consultato il 5 gennaio 2015 (archiviato dall'url originale il 5 gennaio 2015).
- ^ (EN) Cancer Facts and Figures 2014 (PDF), in American Cancer Society. URL consultato il 5 gennaio 2015 (archiviato dall'url originale il 18 dicembre 2014)., La tabella a p. 18, i valori sono aggiustati per la normale aspettativa di vita.
- ^ (EN) UK Pancreatic Cancer Prognosis and Survival Rates, su pancreaticcanceraction.org. URL consultato il 18 giugno 2016 (archiviato dall'url originale il 9 agosto 2016).
- ^ Wang F, Herrington M, Larsson J, Permert J, The relationship between diabetes and pancreatic cancer, in Mol. Cancer, vol. 2, 2003, p. 4, PMC 149418, PMID 12556242.
- ^ Wolpin BM, Stampfer MJ, Defining determinants of pancreatic cancer risk: are we making progress?, in J. Natl. Cancer Inst., vol. 101, n. 14, July 2009, pp. 972–3, DOI:10.1093/jnci/djp182, PMID 19561317.
- ^ What's new in pancreatic cancer research and treatment?, in American Cancer Society, 11 giugno 2014. URL consultato il 17 luglio 2014 (archiviato dall'url originale il 29 novembre 2016).
- ^ (EN) Pancreatic cancer research, in Cancer Research UK. URL consultato il 17 luglio 2014 (archiviato dall'url originale il 18 febbraio 2014).
- ^ (EN) Australian Pancreatic Genome Initiative, su pancreaticcancer.net.au, Garvan Institute. URL consultato il 17 luglio 2014.
- ^ Biankin AV et al., Pancreatic cancer genomes reveal aberrations in axon guidance pathway genes, in Nature, vol. 491, n. 7424, November 2012, pp. 399–405, DOI:10.1038/nature11547, PMC 3530898, PMID 23103869.
- ^ Pannala R, Basu A, Petersen GM, Chari ST, New-onset diabetes: a potential clue to the early diagnosis of pancreatic cancer, in Lancet Oncol., vol. 10, n. 1, January 2009, pp. 88–95, DOI:10.1016/S1470-2045(08)70337-1, PMC 2795483, PMID 19111249.
- ^ Graham JS et al., Pancreatic cancer genomics: where can the science take us?, in Clin. Genet., November 2014, DOI:10.1111/cge.12536, PMID 25388820.
- ^ (EN) About EUROPAC, in European Registry of Hereditary Pancreatitis and Familial Pancreatic Cancer (EUROPAC), University of Liverpool. URL consultato il 17 luglio 2014 (archiviato dall'url originale il 26 luglio 2014).
- ^ Subar D, Gobardhan PD, Gayet B, Laparoscopic pancreatic surgery, in Best Practice & Research Clinical Gastroenterology, vol. 28, n. 1, pp. 123–32, DOI:10.1016/j.bpg.2013.11.011.
- ^ a b Schober M et al., Desmoplasia and chemoresistance in pancreatic cancer, in Cancers (Basel), vol. 6, n. 4, 2014, pp. 2137–54, DOI:10.3390/cancers6042137, PMC 4276960, PMID 25337831.
- ^ Al Haddad AH, Adrian TE, Challenges and future directions in therapeutics for pancreatic ductal adenocarcinoma, in Expert Opin Investig Drugs, vol. 23, n. 11, November 2014, pp. 1499–515, DOI:10.1517/13543784.2014.933206, PMID 25078674.
- ^ Kleger A, Perkhofer L, Seufferlein T, Smarter drugs emerging in pancreatic cancer therapy, in Ann. Oncol., vol. 25, n. 7, luglio 2014, pp. 1260–70, DOI:10.1093/annonc/mdu013, PMID 24631947.
- ^ a b Tang SC, Chen YC, Novel therapeutic targets for pancreatic cancer, in World Journal of Gastroenterology, vol. 20, n. 31, August 2014, pp. 10825–44, DOI:10.3748/wjg.v20.i31.10825, PMC 4138462, PMID 25152585.
- ^ Weiss MJ, Wolfgang CL, Irreversible electroporation: a novel pancreatic cancer therapy, in Current Problems in Cancer, vol. 37, n. 5, pp. 262–5, DOI:10.1016/j.currproblcancer.2013.10.002, PMID 24331180.
- ^ Moir J, White SA, French JJ, Littler P, Manas DM, Systematic review of irreversible electroporation in the treatment of advanced pancreatic cancer, in European journal of surgical oncology : the journal of the European Society of Surgical Oncology and the British Association of Surgical Oncology, vol. 40, n. 12, December 2014, pp. 1598–1604, DOI:10.1016/j.ejso.2014.08.480, PMID 25307210.
- ^ Rossi ML, Rehman AA, Gondi CS, Therapeutic options for the management of pancreatic cancer, in World J. Gastroenterol., vol. 20, n. 32, 2014, pp. 11142–59, DOI:10.3748/wjg.v20.i32.11142, PMC 4145755, PMID 25170201.
- ^ Neesse A, Krug S, Gress TM, Tuveson DA, Michl P, Emerging concepts in pancreatic cancer medicine: targeting the tumor stroma, in Onco Targets Ther, vol. 7, 2013, pp. 33–43, DOI:10.2147/OTT.S38111, PMC 3872146, PMID 24379681.
- ^ Heinemann V, Reni M, Ychou M, Richel DJ, Macarulla T, Ducreux M, Tumour-stroma interactions in pancreatic ductal adenocarcinoma: rationale and current evidence for new therapeutic strategies, in Cancer Treat. Rev., vol. 40, n. 1, February 2014, pp. 118–28, DOI:10.1016/j.ctrv.2013.04.004, PMID 23849556.
- ^ Fong Y, Ady J, Heffner J, Klein E, Oncolytic viral therapy for pancreatic cancer: current research and future directions, in Oncolytic Virotherapy, p. 35, DOI:10.2147/OV.S53858.
- ^ Pavelic J, Editorial: combined cancer therapy, in Curr. Pharm. Des., vol. 20, n. 42, October 2014, pp. 6511–2, DOI:10.2174/1381612820666140826154834, PMID 25341927.
- ^ Kasuya H, Takeda S, Nomoto S, Nakao A, The potential of oncolytic virus therapy for pancreatic cancer, in Cancer Gene Ther., vol. 12, n. 9, 2005, pp. 725–36, DOI:10.1038/sj.cgt.7700830, PMID 15818382.
Bibliografia
[modifica | modifica wikitesto]- (EN) Bernard W. Stewart e Christopher P. Wild (a cura di), World Cancer Report 2014, World Health Organization, 2014, ISBN 978-92-832-0429-9.
- (EN) Randall E. Harris, Epidemiology of pancreatic cancer, in Epidemiology of Chronic Disease, Jones & Bartlett, 2013, ISBN 978-0-7637-8047-0.
- (EN) Vincent T. DeVita, DeVita, Hellman, and Rosenberg's Cancer: Cancer: Principles & Practice of Oncology, 9th, Lippincott Williams & Wilkins, 2011, ISBN 978-1-4511-1813-1.
- (EN) Jeffrey Tobias e Daniel Hochhauser, Cancer and its Management, 6th, 2010, ISBN 978-1-4051-7015-4.
- (EN) SR Alberts e Richard M. Goldberg, Chapter 9: Gastrointestinal tract cancers, in Dennis A. Casciato e Mary C. Territo (a cura di), Manual of clinical oncology, Lippincott Willi.ams & Wilkins, 2009, ISBN 978-0-7817-4741-7.
- (EN) Benson AB, Myerson RJ, Sasson AR, Pancreatic, neuroendocrine GI, and adrenal cancers. Cancer Management: A Multidisciplinary Approach 13th edition 2010., ISBN 978-0-615-41824-7. URL consultato il 18 giugno 2016 (archiviato dall'url originale il 15 maggio 2011).
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su tumore del pancreas
Wikimedia Commons contiene immagini o altri file su tumore del pancreas
Collegamenti esterni
[modifica | modifica wikitesto]- Tumore al pancreas tumorealpancreas.it
- Efficacia della ipertermia nel carcinoma del pancreas, su ipertermiaroma.it.
- AIRC – Associazione Italiana Ricerca sul cancro Tumore al pancreas, su airc.it.
- Linee Guida dell'Associazione Italiana di Oncologia Medica per le neoplasie pancreatiche [collegamento interrotto], su aiom.it.
- Wirsung.org: rivista web informativo dedicato alla diffusione della conoscenza aggiornata dei problemi pancreatologici, a cura della associazione Wirsung Onlus di Padova, su wirsung.org.
- (EN) The Pancreatic Society of Great Britain and Ireland, su pancsoc.org.uk. URL consultato il 25 febbraio 2007 (archiviato dall'url originale il 3 aprile 2009).
- (EN) Helicobacter pylori e carcinoma pancreatico, su cancer.gov.
- (EN) Pancreatic Cancer Action Network (PanCAN), su pancan.org. URL consultato il 25 febbraio 2007 (archiviato dall'url originale il 7 gennaio 2010).
- (EN) Confronting pancreatic cancer, su (Pancreatica.org). URL consultato il 25 febbraio 2007 (archiviato dall'url originale il 9 marzo 2010).
- (EN) Cancer of the Pancreas, su (Cancer Supportive Care Program). URL consultato il 25 febbraio 2007 (archiviato dall'url originale il 18 febbraio 2010).
- (EN) American Cancer Society: Detailed Guide on Pancreatic Cancer, su cancer.org. URL consultato il 25 febbraio 2007 (archiviato dall'url originale il 27 giugno 2010).
- (EN) Surgery and Other Treatments for Pancreatic Cancer, su pancreasdiseases.com. URL consultato il 25 febbraio 2007 (archiviato dall'url originale il 12 giugno 2002).
- (EN) Pancreas related discussion area (Pancreas.com), su pancreas.com.
- (EN) Pancreatic Cancer Collaborative Registry (PCCR), su pccrproject.com (archiviato dall'url originale il 27 settembre 2007).
- (EN) Pancreatic Carcinoma Specific Antigen 1, su logikbase.com (archiviato dall'url originale il 27 settembre 2007).
- (EN) Interessamento vascolare del carcinoma pancreatico, su ncbi.nlm.nih.gov.
| Classificazione e risorse esterne (EN) |
ICD-9-CM: 157.1, 157.8, 157.0 e 157.2; ICD-10-CM: C25.0, C25.1 e C25.2; OMIM: 260350; DiseasesDB: 9510; |
| Controllo di autorità | LCCN (EN) sh2010009939 · GND (DE) 4004728-3 · NDL (EN, JA) 00571649 |
|---|















