Acido borico
| Acido borico | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| acido borico | |
| Nomi alternativi | |
| acido ortoborico acido triossoborico(III) | |
| Caratteristiche generali | |
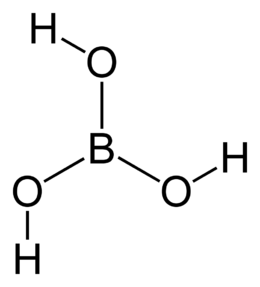
| Formula bruta o molecolare | H3BO3 oppure B(OH)3 |
| Massa molecolare (u) | 61,84 g/mol |
| Aspetto | solido bianco |
| Numero CAS | |
| Numero EINECS | 233-139-2 |
| PubChem | 7628 |
| DrugBank | DBDB11326 |
| SMILES | B(O)(O)O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,44 (20 °C) |
| Solubilità in acqua | 46,5 g/l (20 °C) |
| Temperatura di fusione | 171 °C (444 K) (decomposizione) |
| Temperatura di ebollizione | 300 °C (573 K) |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |

| |
| pericolo | |
| Frasi H | 360 |
| Consigli P | 201 - 308+313 [1] |
L'acido borico, o acido ortoborico (più raramente acido boracico[2]), ugualmente acido borico nella nomenclatura IUPAC,[3] è un ossiacido del boro trivalente, di formula H3BO3 o B(OH)3 ed è un acido molto debole. Esiste in natura in forma di cristalli incolori o polvere bianca; è solubile in acqua, specialmente a caldo.
È usato spesso come antisettico, insetticida, disinfettante, ritardante di fiamma e in laboratorio per la preparazione di alcune soluzioni, come il TBE (tris-borato-EDTA).
L'acido borico è utilizzato nell'industria del vetro, nella lavorazione degli smalti, delle vernici, della pelle, della carta, degli adesivi e degli esplosivi. È inoltre iniettato nel moderatore delle centrali nucleari BWR o PWR in virtù della natura di assorbitore neutronico di un isotopo del boro per effettuare gli arresti rapidi (SCRAM).
Preparazione
[modifica | modifica wikitesto]È l'acido ottenuto per idratazione dell'anidride borica. L'acido borico, tuttavia, è prodotto soprattutto dai minerali del borato per effetto della reazione con acido solforico. La più grande fonte di borati nel mondo è la miniera di Boron, in California.
Proprietà
[modifica | modifica wikitesto]
Allo stato isolato la molecola H3BO3 è planare (l'atomo B è ibridato sp2), con simmetria C3h[4] e momento dipolare nullo. L'acido borico è solubile in acqua bollente. A circa 170 °C avviene una disidratazione che trasforma l'acido ortoborico in acido metaborico HBO2. Fonde a circa 236 °C, e quando viene riscaldato a circa 300 °C avviene un'ulteriore disidratazione con la formazione di acido tetraborico H2B4O7.
È un acido debole, la cui costante di dissociazione acida Ka è 5,81×10−10. In soluzione acquosa diluita (dal 3% al 5% circa) viene utilizzato come disinfettante; tale soluzione prende il nome di acqua borica e viene tuttalpiù usata dopo bagni in acque ricche di plancton e per contrastare l'alcalinità di saponi, come antisettico, antimicotico, fungicida e in oculistica (occhi arrossati e congiuntiviti). Nelle industrie chimiche che producono sostanze alcaline (come idrossido di sodio o potassio), l'acido borico è usato nelle postazioni di primo soccorso per il lavaggio oculare in caso di contatto accidentale con gli alcali.
È anche usato come assorbitore nelle centrali nucleari, disciolto nell'acqua in cui sono immerse le barre combustibili, per catturare i neutroni emessi durante la fissione, per ridurre e tenere sotto controllo la velocità delle reazioni nucleari.
Tossicologia
[modifica | modifica wikitesto]In dosi tossiche l'acqua borica può provocare vomito, diarrea, emorragie e dolori viscerali. Secondo lo IUCLID Dataset pubblicato dalla Commissione europea in relazione all'acido borico, quest'ultimo, in alte dosi, mostra una significativa tossicità nello sviluppo e teratogenicità in feti e prole di conigli, ratti e topi, causando difetti cardiovascolari, modificazioni scheletriche, e modeste lesioni renali.[5] Di conseguenza, nell'agosto 2008, con il 30° adeguamento al progresso tecnico della direttiva 67/548/CEE, la CE ha deciso di modificare la sua classificazione in "Tossico per la riproduzione" di categoria 2 con le frasi di rischio R60 (può ridurre la fertilità) e R61 (può danneggiare i bambini non ancora nati).
Riconoscimento
[modifica | modifica wikitesto]Al saggio alla fiamma dà colorazione verde smeraldo. L'acido borico è solubile in acqua. Una cartina indicatrice alla curcuma bagnata con una sua soluzione cloridrica assume colorazione rosa per essiccamento. Riscaldato fonde assumendo l'aspetto di una massa traslucida.
Note
[modifica | modifica wikitesto]- ^ scheda dell'acido borico su IFA-GESTIS (archiviato dall'url originale il 16 ottobre 2019).
- ^ boracifero, su treccani.it - Vocabolario on line, Istituto dell'Enciclopedia Italiana. URL consultato il 29 maggio 2017.
- ^ (EN) PubChem, Boric Acid, su pubchem.ncbi.nlm.nih.gov. URL consultato il 22 aprile 2024.
- ^ (EN) J. Steven Ogden e Nigel A. Young, The characterisation of molecular boric acid by mass spectrometry and matrix isolation infrared spectroscopy, in Journal of the Chemical Society, Dalton Transactions, n. 6, 1988, pp. 1645, DOI:10.1039/dt9880001645. URL consultato il 6 giugno 2022.
- ^ European Chemical Bureau - ECB, Boric Acid IUCLID Dataset (PDF)[collegamento interrotto], Commissione Europea.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su acido borico
Wikimedia Commons contiene immagini o altri file su acido borico
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) boric acid, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- Sito italiano sull'acido borico, su acidoborico.it.
- (EN) ChemSub Online: Acido borico, su chemsub.online.fr.
| Controllo di autorità | Thesaurus BNCF 21199 · LCCN (EN) sh85015848 · GND (DE) 4146369-9 · BNF (FR) cb133323241 (data) · J9U (EN, HE) 987007283387305171 |
|---|








