Indice
-
Inizio
-
1 Storia
-
2 Caratteristiche chimico-fisiche
-
3 Abbondanza sulla Terra
-
4 Abbondanza nell'universo
-
5 Produzione
-
6 Utilizzi
-
7 Cattura e sequestro
-
8 Cattura e utilizzo
-
9 Effetti sulla salute
-
10 Note
-
11 Bibliografia
-
12 Voci correlate
-
13 Altri progetti
-
14 Collegamenti esterni
Anidride carbonica
| Diossido di carbonio | |
|---|---|
 | |
 | |
 | |
| Nome IUPAC | |
| diossido di carbonio | |
| Nomi alternativi | |
| biossido di carbonio anidride carbonica gas silvestre | |
| Caratteristiche generali | |
| Formula bruta o molecolare | CO2 |
| Massa molecolare (u) | 44,009[1] |
| Aspetto | gas incolore |
| Numero CAS | |
| Numero EINECS | 204-696-9 |
| PubChem | 280 |
| DrugBank | DBDB09157 |
| SMILES | C(=O)=O |
| Proprietà chimico-fisiche | |
| Densità (g/l, in c.s.) | 1022 (31,1 °C e 5,2 atm) (liquido) 1562 (−78 °C) (solido) |
| Densità (kg·m−3, in c.s.) | 1,9763 (0 °C), 1,8714 (15 °C), 1,8075 (25 °C)[2] |
| Solubilità in acqua | 1,69 g/L (20 °C), 1,48 g/L (25 °C)[3] |
| Temperatura di fusione | 216,59 K (−56,56 °C) al punto triplo[4] |
| Temperatura di ebollizione | 194,7 K (−78,5 °C) sublima[4] |
| Punto triplo | 216,5 K (−56,6 °C) 5,18×105 Pa |
| Punto critico | 304,13 K (30,98 °C) 7,375×106 Pa[4] |
| Tensione di vapore (Pa) a 293 K | 5,73×106 |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −393,51[5] |
| ΔfG0 (kJ·mol−1) | −394,36[5] |
| S0m(J·K−1mol−1) | 213,74[5] |
| C0p,m(J·K−1mol−1) | 37,11[5] |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |

| |
| attenzione | |
| Frasi H | 280 - 281 |
| Consigli P | 282 - 336+317 - 403 - 410+403 [1] |
Il diossido di carbonio, noto anche come biossido di carbonio o anidride carbonica, (formula: CO2) è un ossido del carbonio formato da un atomo di carbonio legato da due doppi legami a due atomi di ossigeno. A temperatura ambiente si presenta come un gas incolore e di odore e sapore aciduli. È naturalmente presente in atmosfera, nell'idrosfera e nella biosfera.
L'attuale concentrazione atmosferica di anidride carbonica si aggira attorno a 0,04% (424 ppm)[6] ed è cresciuta rispetto al livello pre-industriale, in cui era stabile a circa 0,03% (280 ppm). Questo rapido aumento atmosferico di anidride carbonica è ascrivibile dunque alle attività umane.[7] Tra le attività più inquinanti sono riconosciute: la produzione di energia elettrica dalla combustione di gas naturale, metano o carbone e il trasporto dalla combustione di combustibili fossili. L'abbondanza di anidride carbonica allo stato gassoso, surriscalda l'atmosfera attraverso un fenomeno chiamato "effetto serra". Secondo questo modello, la radiazione elettromagnetica proveniente dal Sole, genererebbe un calore maggiore rispetto a quello uscente dalla Terra, surriscaldando il pianeta gradualmente. La CO2, assieme ad altri gas serra, sarebbe responsabile dell'abbassamento della quantità di questo calore uscente.
Nell'idrosfera la CO2 è in parte disciolta in acqua con una solubilità di 1,48 g/L in condizioni standard. In questo senso, gli oceani, i mari, i laghi, i fiumi e le acque sotterranee possono essere considerate dei serbatoi di anidride carbonica, che la sequestrano dall'atmosfera. L'abbondanza di CO2 disciolta nelle acque però, ne cambia il pH, generando squilibri per le forme di vita.
Nella biosfera, l'anidride carbonica interagisce con qualsiasi essere vivente. Per gli organismi autotrofi la CO2 è la molecola di costruzione della materia organica: la fotosintesi clorofilliana usa CO2, H2O e energia solare per produrre materia organica e ossigeno. Per gli organismi eterotrofi la CO2 è la molecola di scarto del metabolismo: la respirazione cellulare usa materia organica e ossigeno per produrre CO2 e H2O.
A −78 °C e a pressione atmosferica l'anidride carbonica allo stato gassoso brina allo stato solido in un composto comunemente chiamato ghiaccio secco. La CO2 allo stato liquido non può esistere a pressione atmosferica, ma esiste se la si pone sotto 31,1 °C e con una pressione di oltre 5 atmosfere.
Storia
[modifica | modifica wikitesto]L'anidride carbonica fu scoperta nel 1638 dal chimico belga Jean Baptiste van Helmont[8] mentre bruciava del carbone in un recipiente. Quando vide che la massa della cenere risultante era di molto inferiore a quella del carbone originale, ipotizzò che il resto del carbone si fosse trasformato in una sostanza invisibile che chiamò "gas" o, talvolta, "gas silvestre". Fu il primo gas ad essere scoperto e Van Helmont ne osservò la formazione durante processi di combustione e fermentazione.[9]
Le proprietà dell'anidride carbonica furono ulteriormente studiate nel 1750 dal chimico britannico Joseph Black. Egli dimostrò che alcuni sali alcalini, come il carbonato di calcio o quello di sodio, potevano produrre un gas quando riscaldati o trattati con acidi.[10] Tale gas fu da lui definito "aria fissa" a causa del fatto che era contenuto, fissato, all'interno della struttura cristallina del calcare. Osservò, inoltre, che quell'aria era più densa dell'aria atmosferica e non supportava la combustione di una fiamma. Determinò anche i valori del calore latente e del calore specifico.[8][11]
Nel 1772 il chimico inglese Joseph Priestley pubblicò un articolo intitolato Impregnating Water with Fixed Air (Impregnare acqua con aria fissa) in cui descriveva un processo di dissoluzione dell'anidride carbonica in acqua, ottenendo così per la prima volta, l'acqua gassata.[8][12] Nel 1781 Antoine-Laurent de Lavoisier, attraverso la combustione del carbonio con l'ossigeno, poté dedurre la composizione chimica di questo gas.[8]
L'anidride carbonica fu liquefatta per la prima volta nel 1823 da Humphry Davy e Michael Faraday, applicando ad un contenitore elevate pressioni.[13] Nel tentativo di ottenerla liquida a pressione atmosferica, l'inventore francese Adrien-Jean-Pierre Thilorier, nel 1835, abbassò la temperatura fino a −78 °C ottenendo così direttamente la forma solida.[14] Si scoprì dunque che l'anidride carbonica brina a −78 °C, passando dalla sua forma gassosa a quella solida, o viceversa sublima passando da quella solida a quella gassosa.
Nel 1866 Thaddeus Lowe mise a punto un ciclo frigorifero ad anidride carbonica, utilizzato per la produzione di ghiaccio.[15]
L'aumento dell'effetto serra imputabile alla produzione umana di anidride carbonica fu sottolineato già nel 1896 da Svante Arrhenius, che mise in relazione la concentrazione di anidride carbonica con la temperatura dell'atmosfera.[16] Tale relazione fu chiarita maggiormente da molti studi successivi. L'Organizzazione Mondiale della Meteorologia (OMM) ha evidenziato un costante aumento della concentrazione di anidride carbonica nell'atmosfera, dal valore di 280 ppm prima della seconda rivoluzione industriale fino al valore attuale di 418 ppm,[6] mai raggiunto prima negli ultimi 800.000 anni.[17][18] Analogamente si è registrato un forte incremento delle temperature medie.
Nell'odierna nomenclatura IUPAC, la locuzione "anidride carbonica" è obsoleta: il termine "anidride" designa una specifica classe di composti organici ai quali l'anidride carbonica non appartiene, essendo un composto inorganico. Dunque si preferisce il nome "diossido di carbonio", anche se ormai il termine anidride carbonica è radicato nell'uso comune.
Caratteristiche chimico-fisiche
[modifica | modifica wikitesto]Struttura e caratteristiche fisiche
[modifica | modifica wikitesto]Una molecola di diossido di carbonio è formata da un atomo di carbonio legato covalentemente a due atomi di ossigeno attraverso due doppi legami. L'atomo di carbonio ha numero di ossidazione +4, si trova quindi al suo massimo stato di ossidazione possibile, mentre i due atomi di ossigeno hanno numero di ossidazione −2: la molecola non ha cariche globali ed è elettricamente neutra.[9]
La geometria della molecola è lineare e dunque presenta una distribuzione di elettroni non uniforme, con una parziale carica negativa su entrambi gli ossigeni e una positiva sul carbonio. Data però la sua simmetria rispetto all'atomo di carbonio, la CO2 non presenta momento di dipolo elettrico. La lunghezza dei doppi legami C=O è di 116,3 pm, più corta della lunghezza del doppio legame C=O presente in altri gruppi funzionali come i carbonili.[19]

Come molecola triatomica lineare, la CO2 ha quattro modalità vibrazionali che entrano in risonanza con le radiazioni elettromagnetiche:
- Stiramento simmetrico: i due atomi di ossigeno si allontanano e si avvicinano all'atomo di carbonio in maniera sincrona e simmetrica lungo l'asse di legame. Questa modalità di vibrazione non genera un momento di dipolo e dunque la molecola rimane apolare, rimanendo invisibile alla spettroscopia IR, ma venendo rilevata dalla spettroscopia Raman ad una lunghezza d'onda di 7,2 µm.[20]
- Stiramento antisimmetrico: i due atomi di ossigeno si allontanano e si avvicinano all'atomo di carbonio in maniera asincrona e asimmetrica ma sempre lungo l'asse di legame. Questa vibrazione genera momento di dipolo e rende la CO2 visibile nello spettro infrarosso ad una lunghezza d'onda di 4,25 µm.[21]
- Flessione degenere: i due atomi di ossigeno e quello di carbonio flettono i loro legami lungo assi casuali diversi da quello di legame. Questa vibrazione rende la CO2 visibile all'IR ad una lunghezza d'onda di 15 µm.[21]
- Flessione perpendicolare all'asse della molecola: i due atomi di ossigeno e quello di carbonio flettono i loro legami lungo l'asse perpendicolare a quello della molecola. Anche questa vibrazione rende la molecola visibile all'osservazione IR a 15 µm.[21]
Date queste modalità di vibrazione, si può osservare uno spettro di assorbimento della radiazione elettromagnetica relativo alla CO2 con picchi a 4,25 µm e a 15 µm, entrambe lunghezze d'onda che ricadono nello spettro infrarosso. Quando un fotone con queste caratteristiche viene assorbito dalla CO2 questa vibra con maggiore intensità e l'energia in eccesso viene dissipata in calore. Per questo motivo lo spettro IR viene utilizzato per rilevare le temperature delle superfici e, sempre per questo motivo la CO2 è definito gas serra.

A temperatura e pressione ambiente il diossido di carbonio è un gas incolore ed inodore. La sua densità a temperatura e pressione ambiente è superiore di 1,5 volte a quella dell'aria[11] e tende quindi a stratificarsi sul fondo degli ambienti chiusi e non ventilati. All'abbassarsi della temperatura, il primo passaggio di stato che avviene è il brinamento da gas a solido. A −78,2 °C infatti, la CO2 gassosa brina in un solido comunemente chiamato "ghiaccio secco".[22] Viceversa avviene la sublimazione del ghiaccio secco in CO2 gassosa.
Lo stato liquido viene raggiunto solo se si applicano più di 5,2 atmosfere di pressione e temperature inferiori a 31,1 °C. Se alle elevate pressioni (come quelle usate per ottenere CO2 liquida) si applicano temperature inferiori, a −56,6 °C si raggiunge il punto triplo, ossia un momento in cui coesistono lo stato solido, liquido e aeriforme nello stesso momento. Quando si applicano 72,8 atm e 30,9 °C, si arriva al punto critico, un momento in cui lo stato liquido e aeriforme si mescolano in un fluido chiamato "anidride carbonica supercritica".
Raffreddando la CO2 a pressioni di oltre 400.000 atm, si ottiene un solido amorfo simil-vetroso chiamato "carbonia", il quale sublima in forma gassosa non appena viene rilasciata la pressione.[23]
Reattività
[modifica | modifica wikitesto]All'aumentare della concentrazione, la CO2 gassosa non rimane inodore ed insapore. Ad alte concentrazioni, reagendo parzialmente con l'acqua delle mucose del naso e della bocca, produce acido carbonico. Dunque respirare un'atmosfera particolarmente ricca di CO2 produce un odore e un sapore acre ed acidulo, oltre che un senso di irritazione delle vie aeree superiori.
La reazione che compie con l'acqua è formalmente una solvatazione, il cui equilibrio è spostato verso la formazione dell'acido carbonico in quanto questo si dissocia con facilità in ioni carbonato (HCO3− e CO32−) i quali vengono poi sequestrati dagli ioni calcio, sodio e potassio in soluzione a formare carbonato di calcio, carbonato di sodio, bicarbonato di sodio ecc.
A temperature superiori ai 1700 °C, il diossido di carbonio si converte parzialmente in monossido di carbonio e ossigeno:[9]
La riduzione della CO2 a CO è un processo molto lento e generalmente difficile, ma può accadere:
Gli organismi autotrofi la utilizzano per costruire la materia organica attraverso la fotosintesi clorofilliana. Gli organismi eterotrofi la producono di scarto attraverso la respirazione cellulare.
Chimicamente, il diossido di carbonio è un reagente elettrofilo. Reagisce con i reattivi di Grignard e con altri composti organometallici a dare i corrispondenti acidi carbossilici in una reazione chiamata carbonizzazione.
Reagisce inoltre con il fenolo nella reazione di Kolbe a dare l'acido 2-idrossibenzoico, ossia l'acido salicilico, il precursore dell'aspirina.
Abbondanza sulla Terra
[modifica | modifica wikitesto]La CO2 è parte integrante del ciclo del carbonio, un ciclo biogeochimico in cui il carbonio viene scambiato tra l'atmosfera, l'idrosfera, la litosfera e la biosfera. In questo contesto, il carbonio non è sempre sotto forma di CO2, ma lo si può ritrovare come metano (CH4), come ioni carbonato (HCO3− e CO32−), come molecole organiche (glucosio, cellulosa, ecc.) o anche come macromolecole biologiche (acidi nucleici, glucidi, proteine e lipidi).
Atmosfera
[modifica | modifica wikitesto]Concentrazione passata
[modifica | modifica wikitesto]La concentrazione atmosferica del diossido di carbonio è variata enormemente durante i 4,54 miliardi di anni di storia della Terra. Si ritiene fosse presente nella prima atmosfera terrestre, poco dopo la formazione della Terra[24] e che l'attività vulcanica e il bombardamento da parte di asteroidi ne abbiano aumentato la concentrazione nei successivi 2 miliardi di anni.[25] Una parte importante delle emissioni di diossido di carbonio fu presto dissolta nell'acqua e incorporata nei sedimenti carbonatici. Grazie a questi sedimenti oggi si può stimare che la concentrazione di CO2 salì durante tutto il Precambriano fino a 4000 ppm.[26]
La massiccia produzione di ossigeno da parte della fotosintesi cianobatterica portò ad un evento di estinzione di massa delle primordiali forme di vita chiamato catastrofe dell'ossigeno che cambiò drasticamente la composizione dell'atmosfera terrestre, facendola assomigliare a quella moderna. La concentrazione atmosferica della CO2 che si ipotizza essere tipica di quel periodo è, anche in questo caso, una stima effettuata sullo studio degli isotopi del carbonio contenuti nelle rocce carbonatiche.
Le registrazioni di temperatura degli ultimi 420 milioni di anni indicano che le concentrazioni atmosferiche di CO2 hanno raggiunto un picco di circa 2000 ppm durante il periodo Devoniano (circa 380 milioni di anni fa) e di nuovo nel Triassico (220–200 milioni di anni fa). Entrambi questi periodi corrispondono a grandi linee ad estinzioni di massa: l'estinzione di massa del tardo Devoniano e l'estinzione di massa del Permiano-Triassico. Le concentrazioni di CO2 sono ricavate da diversi fattori: il numero di stomi osservati su foglie fossili[27] e la concentrazione di fitano come prodotto di degradazione della clorofilla.[28]
Circa 34 milioni di anni fa, quando avvenne l'estinzione minore dell'Eocene-Oligocene, la CO2 si stima fosse di circa 760 ppm,[29] e ci sono prove geochimiche che le concentrazioni scesero a 300 ppm circa 20 milioni di anni fa. La diminuzione della concentrazione di CO2 è stato l'agente principale che ha forzato la glaciazione antartica.[30] Basse concentrazioni di CO2 potrebbero essere state lo stimolo che ha favorito l'evoluzione delle piante C4, che sono aumentate notevolmente tra 7 e 5 milioni di anni fa.[28]
Concentrazione presente
[modifica | modifica wikitesto]
Durante l'ultimo periodo geologico, le concentrazioni di anidride carbonica sono scese fino a circa 180 ppm nel corso della glaciazione quaternaria avvenuta 2 milioni di anni fa, per poi risalire fino a 280 ppm durante i periodi interglaciali.[6] In generale si è osservato che una bassa concentrazione atmosferica di CO2 è spesso correlata ad un'era glaciale, anche se non è quasi mai l'unica causa scatenante. Campionamenti dell'atmosfera di quel periodo e dei periodi successivi sono possibili grazie al carotaggio delle calotte polari della Groenlandia e dell'Antartide.

Anche negli ultimi 200.000 anni, ossia durante tutta la storia di Homo Sapiens, la quantità atmosferica di diossido di carbonio è oscillata tra 180 ppm e 290 ppm, scandendo periodi glaciali e interglaciali. Dall'inizio del 1900 però, in concomitanza con gli eventi della seconda rivoluzione industriale, la sua concentrazione è aumentata vertiginosamente fino a raggiungere 400 ppm nel 2015. Attualmente il livello medio di CO2 nell'atmosfera terrestre ha raggiunto 419 ppm[6] e continua ad aumentare di circa 2 ppm/anno seguendo un modello esponenziale[31][32] e provocando il fenomeno del riscaldamento globale. Per questo motivo gli scienziati monitorano costantemente le concentrazioni di CO2 atmosferica e studiano il loro impatto sulla biosfera.
Ogni ppm di CO2 in atmosfera rappresenta circa 7,82 × 1012 kg di diossido di carbonio.[33] Moltiplicando questo numero con il numero di ppm totali si ottiene 3,21 × 1015 kg, che è il peso complessivo della CO2 presente nell'atmosfera terrestre.
Come evidenzia la curva di Keeling, esiste una fluttuazione annuale nella concentrazione di CO2. Il livello scende di circa 6 o 7 ppm da maggio a settembre durante la stagione di crescita delle piante dell'emisfero boreale, per poi salire di circa 8 o 9 ppm durante il periodo invernale. L'emisfero settentrionale domina il ciclo annuale di concentrazione di CO2 perché ha una superficie terrestre e una biomassa vegetale molto maggiori rispetto all'emisfero australe.[34][35]
Ruolo nell'effetto serra
[modifica | modifica wikitesto]Il diossido di carbonio svolge un ruolo significativo nel provvedere al mantenimento relativamente alto delle temperature presenti sul pianeta. Nonostante la sua bassa concentrazione rispetto agli altri componenti dell'atmosfera, la CO2 riveste anche un ruolo fondamentale per il mantenimento abbastanza costante della temperatura durante l'escursione termica giorno-notte. Senza l'effetto serra dovuto in gran parte alla CO2, la temperatura superficiale media della Terra sarebbe di circa −18 °C.[36][37] L'effetto serra presente naturalmente sulla Terra rende dunque possibile la vita come la conosciamo.
Sebbene l'acqua sia responsabile della maggior parte (circa il 36-70%) dell'effetto serra totale, il ruolo del vapore acqueo come gas serra dipende dalla temperatura. Sulla Terra, l'anidride carbonica è il gas serra più rilevante e direttamente influenzato dal punto di vista antropologico. Il concetto di CO2 atmosferica che aumenta la temperatura del suolo fu pubblicato per la prima volta da Svante Arrhenius nel 1896.[38] L'aumento del forzante radiativo dovuto all'aumento della CO2 nell'atmosfera terrestre si basa sulle proprietà fisiche della CO2. L'aumento della forzatura determina ulteriori cambiamenti nel bilancio energetico terrestre e, a lungo termine, nel clima terrestre.[39]
Fonti naturali
[modifica | modifica wikitesto]Il rilascio naturale di CO2 in atmosfera avviene principalmente a causa di eruzioni vulcaniche, fumarole, geyser o incendi. Anche la respirazione cellulare degli organismi eterotrofi produce CO2, secondo una reazione che è essenzialmente una combustione del glucosio. A differenza di una vera combustione però, la velocità di reazione è controllata da parte degli enzimi, i quali permettono che l'energia prodotta non si disperda immediatamente in calore, ma venga immagazzinata sotto altre forme.
La CO2 è anche un prodotto della fermentazione alcolica, un metabolismo analogo alla respirazione, ma che avviene in assenza di ossigeno ad opera di numerosi batteri.
Altri microorganismi decompongono la materia organica producendo un miscuglio di metano e CO2 definito biogas.[14]
Fonti antropiche
[modifica | modifica wikitesto]L'attività umana che immette più CO2 in atmosfera è la combustione di qualsiasi materiale a base di carbonio (metano, petrolio, cherosene, legno, carbone, carta, ecc.). Per esempio, la combustione di una molecola di metano produce una molecola di CO2 e due di H2O, come mostrato dalla reazione:
Questa particolare attività è alla base di moltissime altre, come la produzione di energia elettrica, lo spostamento di veicoli o lo smaltimento di rifiuti. Anche il disboscamento e la deforestazione sono attività umane che contribuiscono significativamente all'aumento della concentrazione atmosferica di CO2. In questo caso, non immettendo nuove molecole in ambiente, ma togliendo gli organismi che naturalmente la rimuovono, e quindi favorendone l'accumulo. La deforestazione è ritenuta essere la seconda causa del riscaldamento globale, dopo la combustione dei materiali a base di carbonio.[40]
Molti processi industriali producono CO2 come scarto. Il più impattante di essi è l'alligazione degli ossidi del ferro con il carbon coke, per formare la ghisa.[15] Anche la produzione di ammoniaca è responsabile della formazione di CO2 oltre che di idrogeno. Nell'estate del 2018 in Europa si è verificata una carenza di CO2 a causa della chiusura temporanea di diversi impianti di ammoniaca per manutenzione.[16]
Idrosfera
[modifica | modifica wikitesto]
L'anidride carbonica entra in soluzione in una quantità di circa 1,48 g/L in condizioni standard di pressione e temperatura. La solubilità del gas diminuisce all'aumentare della temperatura dell'acqua, tranne quando sia la pressione che la temperatura superano valori estremi (296 atmosfere e 120 °C) che si trovano solo vicino a sfiati geotermici profondi.[17] La maggior parte della CO2 assorbita dagli oceani, forma acido carbonico in equilibrio con gli ioni bicarbonato e carbonato. L'aumento di CO2 nell'atmosfera ha portato a una diminuzione dell'alcalinità dell'acqua di mare e si teme che ciò possa influire negativamente sugli organismi acquatici. In particolare, con la diminuzione dell'alcalinità, la disponibilità di carbonati per la formazione di conchiglie diminuisce,[18] sebbene vi siano prove di un aumento della produzione di conchiglie da parte di alcune specie.[19]
C'è circa cinquanta volte più anidride carbonica disciolta negli oceani rispetto a quella che esiste nell'atmosfera. Gli oceani agiscono come un enorme pozzo di carbonio e hanno assorbito circa un terzo della CO2 emessa dall'attività umana.[20]
Con l'aumento della concentrazione di anidride carbonica nell'atmosfera, l'aumento dell'assorbimento di anidride carbonica negli oceani sta causando una diminuzione misurabile del pH degli oceani, che viene definita acidificazione degli oceani. Questa riduzione del pH colpisce i sistemi biologici negli oceani, principalmente gli organismi calcificanti. Questi effetti abbracciano la catena alimentare dagli autotrofi agli eterotrofi e comprendono organismi come coccolitofori, coralli, foraminiferi, echinodermi, crostacei e molluschi. In condizioni normali, il carbonato di calcio è stabile nelle acque superficiali poiché lo ione carbonato è a concentrazioni sovrasaturanti. Tuttavia, quando il pH dell'oceano diminuisce, diminuisce anche la concentrazione di questo ione e quando il carbonato diventa sottosaturato e le strutture di carbonato di calcio sono vulnerabili alla dissoluzione.[22] Coralli,[23][24][25] coccolitofori,[26][27][29] alghe coralline,[30] foraminiferi,[31] molluschi[32] e pteropodi[34] subiscono una ridotta calcificazione o maggiore dissoluzione.
Fonti naturali
[modifica | modifica wikitesto]La dissoluzione delle rocce carbonatiche causa una serie di reazioni, al cui termine si ha produzione di CO2. Quando per esempio una roccia a base di carbonato di calcio incontra un acido tende a dissolversi secondo la seguente reazione:
La presenza di acido carbonico acidifica ancora di più l'ambiente, generando un meccanismo a feedback positivo che fa crescere costantemente l'acidità. L'acido carbonico infine, a seconda del pH e della sua concentrazione in soluzione, si dissocia in H2O e CO2 seguendo la reazione:
Questa reazione di dissociazione avviene anche nei vasi sanguigni dei nostri polmoni: quando la pressione parziale di CO2 è bassa, l'equilibrio si sposta verso i prodotti, producendo CO2. Tornando alle rocce carbonatiche, all'aumentare della temperatura (circa 850 °C a pressione standard), il carbonato di calcio si dissocia autonomamente in CaO e CO2.
Gli ioni carbonato e bicarbonato sono consumati da organismi fotosintetici che rimuovono il carbonio dal ciclo, fissandolo in rocce di carbonato di calcio. Lo ione idrogenocarbonato viene prodotto per azione del diossido di carbonio libero sulle rocce calcaree - un esempio è la reazione di dissoluzione del carbonato di calcio:
Biosfera
[modifica | modifica wikitesto]Il diossido di carbonio è un nutriente per gli organismi autotrofi e un materiale di scarto per gli quelli eterotrofi. Ciò significa che la CO2 viene utilizzata, in modi diversi, da tutti gli esseri viventi.
L'insieme degli organismi autotrofi comprende tutti quegli esseri viventi che riescono ad autosintetizzarsi le proprie molecole organiche partendo da quelle inorganiche che l'ambiente offre, come ad esempio la CO2. Questo vasto raggruppamento di organismi lo si può suddividere ulteriormente in:
- Fotoautotrofi, che sintetizzano le proprie molecole tramite reazioni che avvengono quando un fotone fornisce loro l'energia sufficiente. Rientrano in questa categoria le piante, le alghe ed i cianobatteri.
- Chemioautotrofi, che sintetizzano le proprie molecole tramite reazioni che ricavano l'energia necessaria da altre reazioni che la liberano. Fanno parte di questa categoria alcuni batteri, e gli archei.
Gli organismi eterotrofi invece, sono tutti quegli esseri viventi che non sono in grado di autosintetizzarsi le proprie molecole partendo da quelle inorganiche che l'ambiente offre. Rientrano in questa categoria gli animali, i funghi e alcuni batteri.
Negli organismi fotoautotrofi
[modifica | modifica wikitesto]Il metabolismo degli organismi fotoautotrofi che coinvolge la CO2 è la fotosintesi clorofilliana. La fase che consuma CO2 per generare molecole organiche è detta ciclo di Calvin e rientra in una più vasta categoria di metabolismi che si chiamano fissazione del carbonio.
Nella fotosintesi, l'enzima fondamentale perché avvenga la fissazione del carbonio è la ribulosio-1,5-bisfosfato carbossilasi/ossigenasi, comunemente abbreviata in RuBisCO. Si pensa che la RuBisCO sia la proteina più abbondante sulla Terra.[41] Il ciclo di Calvin prosegue poi, producendo carboidrati e consumando l'energia accumulata dalle reazioni alla luce. I carboidrati prodotti dalla fotosintesi vengono usati sia come fonte alimentare, sia come materia per la sintesi di molecole organiche più complesse, come i polisaccaridi, gli acidi nucleici e le proteine. Queste molecole sono a loro volta usate sia dagli organismi stessi che le producono, sia dagli eterotrofi, per la propria crescita. Le piante possono crescere fino al 50% più velocemente quando immesse in atmosfere con concentrazioni di 1000 ppm di CO2.[42] Questi livelli elevati di CO2, causano un aumento della crescita che si riflette nella resa dei raccolti, con grano, riso e soia che mostrano tutti aumenti della resa del 12-14%.[43][44] Tali livelli di CO2 provocano lo sviluppo di un minor numero di stomi sulle piante,[45] il che porta a un consumo idrico ridotto e a una maggiore efficienza nell'uso dell'acqua.[46] Le piante C3 emettono CO2 durante la loro respirazione, sono solo assorbitori netti durante il giorno, ma non lo sono durante la notte. Sebbene una foresta in crescita assorbirà molte tonnellate di CO2 ogni anno, una foresta matura produrrà tanta CO2 dalla respirazione e dalla decomposizione di esemplari morti (ad esempio rami caduti) quanta ne viene utilizzata nella fotosintesi nelle piante in crescita. Durante la fotosintesi attiva, le piante possono assorbire più anidride carbonica dall'atmosfera di quanta ne rilascino durante la respirazione.
Alcuni fotoautotrofi, i coccolitofori, sintetizzano scaglie dure di carbonato di calcio.[47] Una specie di importanza mondiale è Emiliania huxleyi le cui scaglie di calcite hanno formato la base di molte rocce sedimentarie come il calcare, dove ciò che in precedenza era carbonio atmosferico può rimanere fisso per scale temporali geologiche. Il fitoplancton può effettuare fotosintesi consumando la CO2 disciolta nell'oceano e quindi promuove l'assorbimento della CO2 dall'atmosfera.[48] I cianobatteri sono stati i primi organismi ad effettuare fotosintesi clorofilliana ossigenica (che produce ossigeno) e si ritiene che siano i responsabili dell'accumulo di ossigeno che oggi caratterizza la nostra atmosfera. Col loro nuovo metabolismo causarono un abbassamento dei livelli di CO2 atmosferici e un innalzamento di quelli dell'O2, provocando un'estinzione di massa nota come catastrofe dell'ossigeno.
Negli organismi chemioautotrofi
[modifica | modifica wikitesto]Questi microorganismi utilizzano metabolismi molto diversificati per la fissazione del carbonio. Un esempio sono i metanogeni, archei che producono metano partendo da CO2 e idrogeno molecolare.
Un altro esempio i solfobatteri purpurei, che in assenza di luce possono ossidare lo zolfo da acido solfidrico a zolfo elementare, con consumo di CO2 e O2. In presenza di luce questi microorganismi possono effettuare fotosintesi clorofilliana anossigenica.
Negli organismi eterotrofi
[modifica | modifica wikitesto]Nei vertebrati, l'anidride carbonica viaggia nel sangue dai tessuti del corpo alla pelle (ad esempio gli anfibi) o alle branchie (ad esempio i pesci), da dove si dissolve nell'acqua, o ai polmoni da dove viene espirata.

La CO2 è un gas asfissiante e non è classificato come tossico o nocivo in conformità con gli standard del sistema armonizzato di classificazione ed etichettatura delle sostanze chimiche (GHS) e dell'OCSE. A concentrazioni fino all'1% (10000 ppm), alcune persone si sentiranno assonnate e darà ai polmoni una sensazione di soffocamento.[49] Concentrazioni dal 7% al 10% (da 70000 a 100000 ppm) possono causare soffocamento, anche in presenza di ossigeno sufficiente, manifestandosi come vertigini, mal di testa, disfunzioni visive e uditive e perdita di coscienza entro pochi minuti o un'ora.[50] Gli effetti fisiologici dell'esposizione acuta all'anidride carbonica sono raggruppati sotto il termine ipercapnia, una categoria di asfissia.
Il biossido di carbonio nell'aria è presente in quantità dello 0,04% circa, mentre nell'aria esalata dopo un respiro è circa il 4,5%. Un'atmosfera che contiene oltre il 5% di biossido di carbonio è asfissiante per gli esseri umani e per gli animali, dato che va a saturare l'emoglobina del sangue impedendole di legarsi all'ossigeno e bloccando quindi l'ossigenazione dei tessuti. Per tale motivo, sia quando viene usato in forma gassosa, sia quando viene usato come ghiaccio secco, il biossido di carbonio va maneggiato in spazi ben aerati. I limiti fissati dall'OSHA (l'agenzia statunitense per la sicurezza sui luoghi di lavoro) per la concentrazione di biossido di carbonio sul posto di lavoro sono lo 0,5% (5000 ppm, 9000 mg/mc TLV-TWA[4]) per un'esposizione continua. Il limite STEL è pari al 3% (30000 ppm[4]). La maggior parte del biossido di carbonio presente nel sangue (il 72%) è presente in forma di ione idrogenocarbonato, HCO3-, dove funge da tampone per la regolazione del pH sanguigno, anche se secondaria rispetto al potere tampone delle proteine che copre i tre quarti del totale. Il livello ottimale dello ione idrogenocarbonato è mantenuto attraverso la frequenza del respiro e la contrazione o la dilatazione dei vasi sanguigni e delle vie polmonari. Circa il 22% della CO2 nell'organismo si trova sotto forma di carbaminoemoglobina e il 6% sotto forma di CO2 libera. Ogni giorno il corpo umano produce 12-15 mol di CO₂ (288-360 litri) a riposo e fino a 50 mol in intensa attività fisica.[senza fonte] Esposte alla luce, le piante assorbono biossido di carbonio dall'atmosfera attraverso la fotosintesi, tramite la quale biossido di carbonio e acqua vengono convertiti in glucosio e ossigeno. Sia in presenza che in assenza di luce, anche le piante emettono biossido di carbonio in conseguenza della respirazione cellulare.
Abbondanza nell'universo
[modifica | modifica wikitesto]Venere
[modifica | modifica wikitesto]
L'atmosfera di Venere è composta al 96,5% da diossido di carbonio,[51][52][53] cioè contiene una quantità di CO2 che corrisponde all'incirca a 4,63 × 1017 kg.[54] Questa quantità è superiore di 100 volte rispetto a quella presente nell'atmosfera terrestre. A causa di questa elevata concentrazione, l'effetto serra che ne deriva è particolarmente intenso, tanto che le temperature venusiane raggiungono una media giornaliera di 464 °C (737 K).[54]
Marte
[modifica | modifica wikitesto]L'atmosfera di Marte è composta al 95% da diossido di carbonio,[55][56] cioè contiene una quantità di CO2 che corrisponde a 2,37 × 1013 kg.[57] Siccome l'asse di rotazione del pianeta è inclinato di 25,19°, accade che per circa metà periodo orbitale (0,94 anni) uno dei due poli non viene mai colpito dalla luce del Sole, mentre l'altro polo non viene illuminato per l'altra metà dell'orbita. La temperatura media che viene raggiunta sulla superficie del polo non illuminato permette il brinamento del diossido di carbonio, che si accumula assieme al ghiaccio, formando una calotta polare.
Giove
[modifica | modifica wikitesto]L'atmosfera di Giove possiede circa 2,9 × 1010 kg di diossido di carbonio.[58] Questa quantità, rapportata massa complessiva dell'atmosfera, fa della CO2 una delle molecole più rare su Giove. Si ritiene che la CO2 gioviana possa provenire da comete che sono precipitate sul pianeta e che si sono disgregate negli strati alti dell'atmosfera.[59]
Lune di Giove
[modifica | modifica wikitesto]L'anidride carbonica è presente anche su alcuni satelliti di Giove, ad esempio l'atmosfera di Callisto è composta essenzialmente da anidride carbonica.[60] Essa è talmente tanto sottile che la pressione sulla superficie della luna è 7,5 × 10−7 Pa. Un'atmosfera così rarefatta si ipotizza che si disperda nello spazio in meno di 96 ore e che venga costantemente ricostituita dalla sublimazione della superficie, completamente ricoperta di ghiaccio secco.[60]
Saturno
[modifica | modifica wikitesto]Come quella di Giove, anche l'atmosfera di Saturno contiene tracce di CO2, probabilmente derivate da comete o da reazioni del monossido di carbonio (CO) con gruppi radicalici ossidrilici (•OH) a formare diossido di carbonio (CO2) e idrogeno molecolare (H2).[61]
Produzione
[modifica | modifica wikitesto]Il diossido di carbonio è il risultato della combustione di un composto organico in presenza di una quantità di ossigeno sufficiente a completarne l'ossidazione. Può essere inoltre prodotta facendo reagire un carbonato o un bicarbonato con un acido.[11] In natura, viene anche prodotta da batteri aerobici durante il processo della fermentazione alcolica ed è il sottoprodotto della respirazione. Le piante lo utilizzano per la fotosintesi che, combinandolo con l'acqua e per azione della luce solare e della clorofilla, lo trasforma in glucosio liberando ossigeno come sottoprodotto.
Il diossido di carbonio viene prodotto principalmente a partire dai seguenti processi:[62]
- da combustione di petrolio, carbone e gas; e soprattutto da centrali termoelettriche, aerei, navi e da autoveicoli ma anche da missili e razzi. Si pensi ad esempio che un aereo di linea sulla rotta Milano New York consuma 63.000 litri di cherosene[63];
- come prodotto secondario da impianti di produzione di ammoniaca e idrogeno, in cui il metano è convertito in diossido di carbonio;
- come sottoprodotto della fermentazione;
- da decomposizione termica di CaCO3;
- come sottoprodotto della produzione di fosfato di sodio;
- come sottoprodotto dei processi de ossidazione[64][65]
- direttamente dai pozzi naturali di diossido di carbonio.
Utilizzi
[modifica | modifica wikitesto]Utilizzi in forma solida
[modifica | modifica wikitesto]
Il diossido di carbonio solido (anche detto ghiaccio secco o neve carbonica[11]) viene usato come mezzo refrigerante, ad esempio per la conservazione degli alimenti, presentando il vantaggio di sublimare passando direttamente dallo stato solido allo stato gassoso e permettendo di mantenere la temperatura a valori più bassi rispetto al ghiaccio. In particolare può raggiungere temperature tra -70 °C e -80 °C se miscelato con alcol etilico, acetone o altri liquidi organici.[11] Il diossido di carbonio viene inoltre utilizzato negli effetti speciali per creare l'effetto nebbia.
Il diossido di carbonio allo stato solido viene utilizzato anche nella pulitura delle superfici attraverso il metodo della sabbiatura criogenica, durante la quale cristalli di anidride carbonica vengono lanciati contro la superficie da pulire da incrostazioni biologiche, patine minerali o altri depositi eliminandoli per il doppio effetto dell'abrasione e del forte raffreddamento localizzato che porta a una contrazione e un irrigidimento delle parti colpite. Un vantaggio di questo metodo rispetto alle sabbiature tradizionali è legato al fatto che il ghiaccio secco utilizzato come sabbia sublima immediatamente riducendo fortemente la quantità di residuo da smaltire dopo l'intervento.
Utilizzi in forma liquida
[modifica | modifica wikitesto]
In un'atmosfera ricca di biossido di carbonio il fuoco si spegne: per questo motivo alcuni tipi di estintore contengono biossido di carbonio liquido sotto pressione a 73 atm. Anche i giubbotti salvagente spesso contengono capsule di biossido di carbonio liquido, usate per ottenere un rapido gonfiaggio in caso di emergenza.
Utilizzi in forma gassosa
[modifica | modifica wikitesto]
Le acque minerali frizzanti e le bibite gassate devono la loro effervescenza all'aggiunta di biossido di carbonio. Alcune bibite, tra cui la birra e i vini frizzanti contengono biossido di carbonio come conseguenza della fermentazione che hanno subito.
Ancora, è il biossido di carbonio che fa lievitare gli impasti; molti lieviti, naturali o chimici, sviluppano biossido di carbonio per fermentazione o per reazione chimica. Biossido di carbonio e acqua sono le materie prime della fotosintesi; spesso l'aria all'interno delle serre è arricchita di biossido di carbonio per stimolare la crescita delle piante; inoltre un'atmosfera contenente circa l'1% di biossido di carbonio risulta letale per molti parassiti. La concimazione carbonica è anche impiegata in acquariofilia per promuovere la crescita di piante acquatiche sommerse.
Il biossido di carbonio è utilizzato come fluido refrigerante in impianti di refrigerazione e di condizionamento a basso impatto ambientale, ed è identificato dalla sigla R-744. L'utilizzo della CO2 come fluido refrigerante è soggetto a condizioni particolari poiché si realizza un ciclo transcritico. Inoltre, il biossido di carbonio è impiegato in alcuni tipi di laser industriali. Nell'industria, viene utilizzato come reagente assieme all'ammoniaca per la produzione di carbammato d'ammonio,[9] a sua volta utilizzato per produrre urea,[9] che trova applicazioni nell'ambito della produzione dei fertilizzanti e delle materie plastiche.[9] Infine, nell'industria, miscelato all'argon o puro, è adoperato come gas inerte per la protezione/penetrazione del bagno durante una saldatura (open-arc). Tra gli additivi alimentari è identificato dalla sigla E 290.
Cattura e sequestro
[modifica | modifica wikitesto]È il metodo naturale più efficiente per il sequestro e la fissazione del carbonio atmosferico. Sono state avanzate alcune proposte d'ingegneria per la cattura del biossido di carbonio direttamente dall'atmosfera ma gli sviluppi, se pur ben promettenti, sono solo agli inizi. Attualmente sono in corso esperimenti su dei prototipi,[66][67][68][69] ma non è ancora possibile predire se sarà possibile applicarli su vasta scala.
Il principale metodo per smaltire enormi quantità di biossido di carbonio è la fotosintesi clorofilliana svolta dai vegetali: questo processo coinvolge luce, biossido di carbonio e acqua trasformandoli in ossigeno e glucosio; consiste quindi nel piantare e/o preservare foreste da deforestazione e incendi. Questo è il modo più semplice, economico e spontaneo che praticamente avviene naturalmente sul nostro pianeta da quando esistono i vegetali. Esso fa parte inoltre delle misure adottabili secondo il Protocollo di Kyoto per rispettare i vincoli sulle emissioni di CO₂ da parte di ciascun paese.
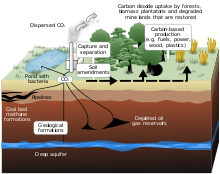
Sono allo studio metodi artificiali, appartenenti alla cosiddetta "geoingegneria", per la cattura e sequestro del carbonio (in inglese Carbon Capture and Sequestration, abbreviato in CCS) col fine di catturare, trasportare e stoccare la CO2 per contrastare l'innalzamento della concentrazione di questo gas serra in atmosfera. In tal caso la cattura del biossido di carbonio si ha nei siti ove viene prodotta in grande quantità: fumi di combustione (ad esempio centrali termoelettriche a carbone o a gas) o da residui di raffinazione; il "sequestro" consiste nell'iniezione nel sottosuolo ove l'anidride carbonica può rimanere segregata grazie a diversi meccanismi chimico-fisici.
Oggi esistono tre principali siti di sperimentazione di sequestro geologico, tutti legati all'industria petrolifera: Weyburn in Canada, In Salah in Algeria e Sleipner nell'offshore norvegese. La quantità di biossido di carbonio sequestrato da questi progetti è dell'ordine del milione di tonnellate all'anno, in realtà una quantità molto modesta. Sleipner è in funzione dal 1995. Questi metodi formalmente non smaltiscono il biossido di carbonio ma prevedono il suo stoccaggio in sacche sotterranee che dovrebbero trattenere la molecola per migliaia di anni.[70]
Cattura e utilizzo
[modifica | modifica wikitesto]Esistono diverse tecnologie di cattura e utilizzo del carbonio (CCU) che permettono di catturare le emissioni di CO2 da fonti stazionarie come fabbriche e impianti di produzione. La CO2 che viene sequestrata può essere direttamente riutilizzata nel recupero del petrolio con CO2 (EOR), nell'industria alimentare e delle bevande, nella produzione di urea, nel trattamento delle acque, nella produzione di ignifughi e di refrigeranti.
In alternativa l'anidride carbonica può essere trasformata in altri prodotti utili come carburanti, polimeri, materiali per l'edilizia o altre sostanze chimiche. La conversione dell'anidride carbonica può essere ottenuta attraverso: fotocatalisi, termocatalisi, elettrocatalisi, bioconversione, mineralizzazione, fissazione biologica o copolimerizzazione.
Effetti sulla salute
[modifica | modifica wikitesto]La concentrazione dell'anidride carbonica può impattare sulla salute e prestazione umana, generalmente le concentrazioni naturalmente presenti nell'ambiente non hanno effetti sulla salute, ma con l'aumento della concentrazione, si può verificare mal di testa, vertigini, confusione e perdita di coscienza.
L'anidride carbonica è più pesante dell'aria, tendendo ad accumularsi sul fondo delle conche o spazi ristretti (serbatoi o cantine) senza ricambi d'aria e si sono verificati decessi per asfissia.
Il limite d'esposizione sul posto di lavoro (WEL) è calcolata prendendo una media in un determinato periodo di tempo. I WEL per CO2 sono di 5000 ppm per esposizione a lungo termine, limite che aumenta a 15000 ppm per esposizioni a breve termine.[71]
Studi recenti che utilizzano il test di Strategic Management Simulation (SMS) hanno riscontrato compromissioni nelle prestazioni decisionali durante l'esposizione acuta alla CO2 (con livelli fino a 1000 ppm). I sottomarini operano abitualmente con livelli più elevati di anidride carbonica (2000 - 5000 ppm) rispetto ai riferimenti ambientali e tipicamente considerati normali (400 - 600 ppm), ma in questi soggetti non si sono registrati differenze significative.[72]
Note
[modifica | modifica wikitesto]- ^ a b (EN) Carbon dioxide | CO2, su PubChem, National Center for Biotechnology Information. URL consultato il 9 luglio 2022.
- ^ (EN) Carbon dioxide, su Gas Encyclopedia, Air Liquide. URL consultato il 9 luglio 2022.
- ^ (EN) Showing metabocard for Carbon dioxide (HMDB0001967), su The Human Metabolome Database (HMDB), 21 febbraio 2023. URL consultato il 30 settembre 2023 (archiviato dall'url originale il 29 agosto 2023).
- ^ a b c d e HSDB: Carbon Dioxide, su toxnet.nlm.nih.gov.
- ^ a b c d Atkins S.H. - Edition 8
- ^ a b c d NASA Global Climate Change, Carbon Dioxide Concentration | NASA Global Climate Change, su Climate Change: Vital Signs of the Planet. URL consultato il 7 luglio 2022.
- ^ (EN) United States Environmental Protection Agency - Overview of Greenhouse Gases, Carbon Dioxide Emissions.
- ^ a b c d Storia e proprietà della CO₂ (archiviato dall'url originale il 19 novembre 2011).
- ^ a b c d e f Carbon dioxide, su britannica.com.
- ^ Black, Joseph nell'Enciclopedia Treccani, su treccani.it. URL consultato l'8 luglio 2022.
- ^ a b c d e carbonica, anidride, su treccani.it.
- ^ Joseph Priestley, XIX. Observations on different kinds of air., in Philosophical Transactions of the Royal Society of London, vol. 62, 1º gennaio 1772, pp. 147–264, DOI:10.1098/rstl.1772.0021, ISSN 0261-0523. URL consultato l'8 luglio 2022.
- ^ Humphry Davy, XVIII. On the application of liquids formed by the condensation of gases as mechanical agents, in Philosophical Transactions of the Royal Society of London, vol. 113, 1º gennaio 1823, pp. 199–205, DOI:10.1098/rstl.1823.0020. URL consultato il 7 luglio 2022.
- ^ a b (EN) The London and Edinburgh Philosophical Magazine and Journal of Science, Richard and John E. Taylor, 1836. URL consultato l'8 luglio 2022.
- ^ a b Storia del refrigerante CO2, su interfred.it. URL consultato il 31 agosto 2011 (archiviato dall'url originale il 24 dicembre 2011).
- ^ a b Storia dell'effetto serra e del riscaldamento globale.
- ^ a b Nuovo record delle emissioni dei gas serra, su public.wmo.int, 30 ottobre 2017. URL consultato il 27 febbraio 2018 (archiviato dall'url originale l'8 gennaio 2020).
- ^ a b (EN) Greenhouse gas concentrations in atmosphere reach yet another high, su World Meteorological Organization, 25 novembre 2019. URL consultato il 27 novembre 2019 (archiviato dall'url originale il 7 aprile 2020).
- ^ a b Acidi carbossilici e derivati (PDF), su pianetachimica.it.
- ^ a b Julio De Paula, Atkins' Physical chemistry, 8th ed, W.H. Freeman, 2006, ISBN 0-7167-8759-8, OCLC 66528976. URL consultato il 21 luglio 2022.
- ^ a b c Proprietà vibrazionali di molecole gassose (PDF), su pls.scienze.unipd.it.
- ^ a b Il ghiaccio secco, su ghiacciosecco.net (archiviato dall'url originale il 1º febbraio 2012).
- ^ a b (EN) Mario Santoro, Federico A. Gorelli e Roberto Bini, Amorphous silica-like carbon dioxide, in Nature, vol. 441, n. 7095, 2006-06, pp. 857–860, DOI:10.1038/nature04879. URL consultato il 21 luglio 2022.
- ^ a b (EN) George H. Shaw, Earth's atmosphere – Hadean to early Proterozoic, in Geochemistry, vol. 68, n. 3, 5 agosto 2008, pp. 235–264, DOI:10.1016/j.chemer.2008.05.001. URL consultato il 24 luglio 2022.
- ^ a b (EN) Kevin Zahnle, Laura Schaefer e Bruce Fegley, Earth’s Earliest Atmospheres, in Cold Spring Harbor Perspectives in Biology, vol. 2, n. 10, 1º ottobre 2010, pp. a004895, DOI:10.1101/cshperspect.a004895. URL consultato il 24 luglio 2022.
- ^ a b R. A. Eggleton, A short introduction to climate change, Cambridge University Press, 2012, ISBN 978-1-139-52435-3, OCLC 819572508. URL consultato il 24 luglio 2022.
- ^ a b Colin P Osborne e David J Beerling, Nature's green revolution: the remarkable evolutionary rise of C4 plants, in Philosophical Transactions of the Royal Society B: Biological Sciences, vol. 361, n. 1465, 29 gennaio 2006, pp. 173–194, DOI:10.1098/rstb.2005.1737. URL consultato il 24 luglio 2022.
- ^ a b (EN) Caitlyn R. Witkowski, Johan W. H. Weijers e Brian Blais, Molecular fossils from phytoplankton reveal secular P co 2 trend over the Phanerozoic, in Science Advances, vol. 4, n. 11, 2 novembre 2018, pp. eaat4556, DOI:10.1126/sciadv.aat4556. URL consultato il 24 luglio 2022.
- ^ a b (EN) New CO2 data helps unlock the secrets of Antarctic formation, su phys.org. URL consultato il 24 luglio 2022.
- ^ a b (EN) Mark Pagani, Matthew Huber e Zhonghui Liu, The Role of Carbon Dioxide During the Onset of Antarctic Glaciation, in Science, vol. 334, n. 6060, 2 dicembre 2011, pp. 1261–1264, DOI:10.1126/science.1203909. URL consultato il 24 luglio 2022.
- ^ a b (EN) NOAA US Department of Commerce, Global Monitoring Laboratory - Carbon Cycle Greenhouse Gases, su gml.noaa.gov. URL consultato il 7 agosto 2022.
- ^ a b GCP - Carbon Budget, su globalcarbonproject.org, 16 dicembre 2011. URL consultato il 7 agosto 2022 (archiviato dall'url originale il 16 dicembre 2011).
- ^ Conversion Tables, su cdiac.ess-dive.lbl.gov. URL consultato l'8 novembre 2022.
- ^ a b Charles D. Keeling, The Concentration and Isotopic Abundances of Carbon Dioxide in the Atmosphere, in Tellus, vol. 12, n. 2, 1º gennaio 1960, pp. 200–203, DOI:10.3402/tellusa.v12i2.9366. URL consultato il 7 agosto 2022.
- ^ Charles D. Keeling, Robert B. Bacastow e Arnold E. Bainbridge, Atmospheric carbon dioxide variations at Mauna Loa Observatory, Hawaii, in Tellus, vol. 28, n. 6, 1º gennaio 1976, pp. 538–551, DOI:10.3402/tellusa.v28i6.11322. URL consultato il 7 agosto 2022.
- ^ Solar Radiation and the Earth's Energy Balance, su eesc.columbia.edu, 4 novembre 2004. URL consultato l'8 agosto 2022 (archiviato dall'url originale il 17 luglio 2012).
- ^ Wayback Machine (PDF), su ipcc.ch. URL consultato l'8 agosto 2022 (archiviato dall'url originale il 26 novembre 2018).
- ^ On the Influence of Carbonic Acid in the Air upon the Temperature of the Ground (PDF), su rsc.org.
- ^ Anthropogenic and Natural Radiative Forcing (PDF), su ipcc.ch.
- ^ CDIAC - Frequently Asked Global Change Questions, su cdiac.ornl.gov. URL consultato il 2 maggio 2009 (archiviato dall'url originale il 20 gennaio 2013).
- ^ (EN) Amit Dhingra, Archie R. Portis e Henry Daniell, Enhanced translation of a chloroplast-expressed Rbc S gene restores small subunit levels and photosynthesis in nuclear Rbc S antisense plants, in Proceedings of the National Academy of Sciences, vol. 101, n. 16, 20 aprile 2004, pp. 6315–6320, DOI:10.1073/pnas.0400981101. URL consultato il 16 agosto 2022.
- ^ Carbon Dioxide In Greenhouses, su omafra.gov.on.ca. URL consultato il 16 agosto 2022.
- ^ (EN) Elizabeth A. Ainsworth, Rice production in a changing climate: a meta-analysis of responses to elevated carbon dioxide and elevated ozone concentration: META-ANALYSIS OF RICE RESPONSES TO GLOBAL CHANGE, in Global Change Biology, vol. 14, n. 7, 2008-07, pp. 1642–1650, DOI:10.1111/j.1365-2486.2008.01594.x. URL consultato il 16 agosto 2022.
- ^ (EN) Stephen P. Long, Elizabeth A. Ainsworth e Andrew D. B. Leakey, Food for Thought: Lower-Than-Expected Crop Yield Stimulation with Rising CO 2 Concentrations, in Science, vol. 312, n. 5782, 30 giugno 2006, pp. 1918–1921, DOI:10.1126/science.1114722. URL consultato il 16 agosto 2022.
- ^ (EN) F. I. Woodward e C. K. Kelly, The influence of CO2 concentration on stomatal density, in New Phytologist, vol. 131, n. 3, 1995-11, pp. 311–327, DOI:10.1111/j.1469-8137.1995.tb03067.x. URL consultato il 16 agosto 2022.
- ^ (EN) Bert G. Drake, Miquel A. Gonzàlez-Meler e Steve P. Long, MORE EFFICIENT PLANTS: A Consequence of Rising Atmospheric CO 2 ?, in Annual Review of Plant Physiology and Plant Molecular Biology, vol. 48, n. 1, 1997-06, pp. 609–639, DOI:10.1146/annurev.arplant.48.1.609. URL consultato il 16 agosto 2022.
- ^ Paul G. Falkowski e Andrew H. Knoll, Evolution of primary producers in the sea, Elsevier Academic Press, 2007, ISBN 978-0-08-055051-0, OCLC 173661015. URL consultato il 16 agosto 2022.
- ^ (EN) P. Falkowski, R. J. Scholes e E. Boyle, The Global Carbon Cycle: A Test of Our Knowledge of Earth as a System, in Science, vol. 290, n. 5490, 13 ottobre 2000, pp. 291–296, DOI:10.1126/science.290.5490.291. URL consultato il 16 agosto 2022.
- ^ Toxicity of Carbon Dioxide CO2 Gas Exposure, poisoning symptoms, exposure limits, and Links to Toxic Gas Testing Procedures C02 Gas toxicity CO2 exposure limits, su inspect-ny.com, 28 settembre 2009. URL consultato il 16 agosto 2022 (archiviato dall'url originale il 28 settembre 2009).
- ^ Carbon Dioxide as a Fire Suppressant: Examining the Risks | Alternatives / SNAP | US EPA, su epa.gov, 2 ottobre 2015. URL consultato il 16 agosto 2022 (archiviato dall'url originale il 2 ottobre 2015).
- ^ Copia archiviata, su physics.infis.univ.trieste.it. URL consultato il 27 novembre 2010 (archiviato dall'url originale il 7 maggio 2009).
- ^ Tilman Spohn, Doris Breuer e T. V. Johnson, Encyclopedia of the solar system, Third edition, 2014, ISBN 978-0-12-416034-7, OCLC 881183532. URL consultato il 7 novembre 2022.
- ^ The surface of Venus, su login.unimib.idm.oclc.org. URL consultato l'8 novembre 2022.
- ^ a b Venus Fact Sheet, su nssdc.gsfc.nasa.gov. URL consultato l'8 novembre 2022.
- ^ (EN) Heather B. Franz, Melissa G. Trainer e Charles A. Malespin, Initial SAM calibration gas experiments on Mars: Quadrupole mass spectrometer results and implications, in Planetary and Space Science, vol. 138, 1º aprile 2017, pp. 44–54, DOI:10.1016/j.pss.2017.01.014. URL consultato l'8 novembre 2022.
- ^ James F. Kasting, Atmospheric Evolution on Inhabited and Lifeless Worlds., Cambridge University Press, 2017, ISBN 978-1-139-02055-8, OCLC 982451455. URL consultato l'8 novembre 2022.
- ^ Mars Fact Sheet, su nssdc.gsfc.nasa.gov. URL consultato l'8 novembre 2022.
- ^ (EN) E. Lellouch, B. Bézard e D. F. Strobel, On the HCN and CO2 abundance and distribution in Jupiter's stratosphere, in Icarus, vol. 184, n. 2, 1º ottobre 2006, pp. 478–497, DOI:10.1016/j.icarus.2006.05.018. URL consultato l'8 novembre 2022.
- ^ (EN) E. Lellouch, B. Bézard e J. I. Moses, The Origin of Water Vapor and Carbon Dioxide in Jupiter's Stratosphere, in Icarus, vol. 159, n. 1, 1º settembre 2002, pp. 112–131, DOI:10.1006/icar.2002.6929. URL consultato l'8 novembre 2022.
- ^ a b R. W. Carlson et al., A Tenuous Carbon Dioxide Atmosphere on Jupiter's Moon Callisto (PDF), in Science, vol. 283, 1999, pp. 820–821, DOI:10.1126/science.283.5403.820, PMID 9933159. URL consultato il 27 novembre 2010 (archiviato dall'url originale il 3 ottobre 2008).
- ^ Th. de Graauw, H. Feuchtgruber e B. Bezard, First results of ISO-SWS observations of Saturn: detection of CO2, CH3C2H, C4H2 and tropospheric H2O, in ASTRONOMY AND ASTROPHYSICS.
- ^ Pierantozzi.
- ^ Quanto carburante consuma un aereo di linea?, su Focus.it. URL consultato il 10 novembre 2021.
- ^ Surface chemistry of phase-pure M1 MoVTeNb oxide during operation in selective oxidation of propane to acrylic acid (PDF), in Journal of Catalysis, vol. 285, 2012, pp. 48-60. URL consultato il 22 marzo 2018 (archiviato dall'url originale il 30 ottobre 2016).
- ^ Kinetic studies of propane oxidation on Mo and V based mixed oxide catalysts (PDF).
- ^ First Successful Demonstration of Carbon Dioxide Air Capture Technology Achieved by Columbia University Scientist and Private Company (archiviato dall'url originale il 22 giugno 2010).
- ^ Machine to clean up greenhouse gas is breakthrough in war on global warming, say scientists.
- ^ 1000 tonne/day - Machine Air Fuel Synthesis, su airfuelsynthesis.com. URL consultato il 7 agosto 2013 (archiviato dall'url originale il 20 agosto 2013).
- ^ 30'000 tonnes/year Carbon Recycling International (CRI).
- ^ Un serbatoio contro l'effetto serra.
- ^ General hazards of Carbon Dioxide.
- ^ (EN) Christopher D Rodeheffer, Sarah Chabal, John M Clarke e David M Fothergill, Acute Exposure to Low-to-Moderate Carbon Dioxide Levels and Submariner Decision Making, Aerosp Med Hum Perform, 1º giugno 2018, DOI:10.3357/AMHP.5010.2018. URL consultato il 23 aprile 2024.
Bibliografia
[modifica | modifica wikitesto]- (EN) Michele Aresta, Carbon Dioxide as Chemical Feedstock, John Wiley & Sons, 2010, ISBN 3-527-62992-0.
- (EN) Bhalchandra M. Bhanage, Masahiko Arai, Transformation and Utilization of Carbon Dioxide, Springer Science & Business Media, 2014, ISBN 3-642-44988-3.
- (EN) Kyung Cho, Irvin F. Hawkins, Carbon Dioxide Angiography: Principles, Techniques, and Practices, CRC Press, 2007, ISBN 1-4200-1626-1.
- (EN) Ronald Pierantozzi, Kirk-Othmer Encyclopedia of Chemical Technology - Carbon Dioxide, Wiley, 2001.
Voci correlate
[modifica | modifica wikitesto]- Quoziente respiratorio
- Effetto serra
- Gas serra
- Ghiaccio secco
- Laser ad anidride carbonica
- Stati per emissioni di CO2
- Monossido di carbonio
- Carbaminoemoglobina
Altri progetti
[modifica | modifica wikitesto] Wikiquote contiene citazioni sull'anidride carbonica
Wikiquote contiene citazioni sull'anidride carbonica Wikizionario contiene il lemma di dizionario «anidride carbonica»
Wikizionario contiene il lemma di dizionario «anidride carbonica» Wikimedia Commons contiene immagini o altri file sull'anidride carbonica
Wikimedia Commons contiene immagini o altri file sull'anidride carbonica
Collegamenti esterni
[modifica | modifica wikitesto]- carbonica, anidride, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- (EN) carbon dioxide, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- Centro Studi Galileo - CO2 come gas refrigerante.
- (EN) Informazioni sul ghiaccio secco, su dryiceinfo.com.
- (EN) Scheda informativa OSHA, su osha.gov. URL consultato il 29 aprile 2019 (archiviato dall'url originale il 9 maggio 2018).
- (EN) Bassam Z. Shakhashiri: Il composto della settimana: l'anidride carbonica. URL consultato il 25 maggio 2018 (archiviato dall'url originale il 10 dicembre 2004).
- (EN) Keeling, C.D. e T.P. Whorf: Controllo sull'anidride carbonica atmosferica dall'osservatorio di Manua Loa, 2002. URL consultato il 22 aprile 2018 (archiviato dall'url originale il 10 dicembre 2004).
- (EN) Aggiornamenti da Mauna Loa 2004, su usatoday.com.
- (EN) Catalogo delle Emissioni Naturali di CO2 in Italia, su googas.ov.ingv.it (archiviato dall'url originale il 13 febbraio 2021).
- (EN) Emissioni di CO2 negli ultimi 40 anni per nazione e attività, su enviroware.com.
| Controllo di autorità | Thesaurus BNCF 31199 · LCCN (EN) sh85020108 · GND (DE) 4031648-8 · BNE (ES) XX534629 (data) · J9U (EN, HE) 987007283486805171 · NDL (EN, JA) 00568539 |
|---|














![{\displaystyle {\ce {2CO2 ->[Temperatura] 2CO + O2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6df69a8996717f3780231ca57599b0f1eb893cc2)










