| Silice | |
|---|---|
 | |
| Nome IUPAC | |
| diossido di silicio | |
| Caratteristiche generali | |
| Formula bruta o molecolare | SiO2 |
| Peso formula (u) | 60,08 |
| Aspetto | solido cristallino bianco |
| Numero CAS | |
| Numero EINECS | 231-545-4 |
| PubChem | 24261 |
| DrugBank | DBDB11132 |
| SMILES | O=[Si]=O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 2,2 |
| Solubilità in acqua | 0,15 g/l a 298 K |
| Temperatura di fusione | 1726 °C (1999 K) |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −910,7 |
| ΔfG0 (kJ·mol−1) | −856,3 |
| S0m(J·K−1mol−1) | 41,5 |
| C0p,m(J·K−1mol−1) | 44,4 |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 
| |
| attenzione | |
| Frasi H | 373 |
| Consigli P | ---[1] |
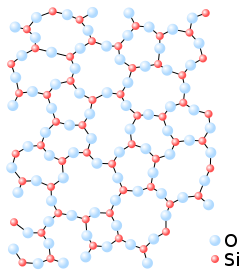
La silice (/ˈsilitʃe/[2]), o anche anidride silicica o diossido di silicio secondo IUPAC, è un composto chimico non molecolare del silicio con l'ossigeno la cui formula minima è SiO2.[3][4]
È comunemente presente in natura in forma cristallina principalmente come quarzo.[5]
Descrizione
[modifica | modifica wikitesto]
La silice purissima per applicazioni ad alta tecnologia viene ottenuta dalla reazione in fiamma fra il tetracloruro di silicio e l'ossigeno
È una pura polvere cristallina bianca che impartisce all'acqua una lieve acidità: una sospensione di 40 g in un litro di acqua ha pH compreso tra 3,7 e 4,7.
Lo stato fisico più comune in natura è quello solido cristallino, in minerali come il quarzo e i suoi polimorfi, e più raramente quello amorfo, come nell'opale; la silice cristallina è il costituente principale di diverse rocce sedimentarie (ad es. sabbia, radiolariti, quarzareniti e pelle di leopardo). Talvolta si rinviene cristallizzata da fluidi di segregazione all'interno di rocce metamorfiche e magmatiche e all'interno di rocce carbonatiche sotto forma di selce di origine metasomatica.
Moltissimi animali e piante utilizzano la silice presente come ione silicato sia nell'acqua dolce sia in quella salata purché al di sotto dei 18 °C. Le diatomee, i radiolari, le spugne silicee, moltissimi cereali ed altre piante come la canna da zucchero e l'equiseto utilizzano questo materiale come impalcatura per lo sviluppo di strutture scheletriche.
Esistono comunque anche 15 solidi cristallini composti esclusivamente di silice, tra i quali il più famoso è certamente il quarzo o le sue forme di alta e altissima temperatura tridimite e cristobalite, oltre a solidi criptocristallini quali il calcedonio.
Rischi per la salute
[modifica | modifica wikitesto]L'esposizione alla silice cristallina rappresenta un rischio significativo per la salute, soprattutto in ambito lavorativo. L'inalazione prolungata di polveri contenenti silice può causare gravi patologie respiratorie, tra cui la silicosi, una malattia polmonare irreversibile caratterizzata da infiammazione e cicatrizzazione del tessuto polmonare. Inoltre, la silice cristallina è stata classificata come cancerogena per l'uomo dall'Agenzia Internazionale per la Ricerca sul Cancro (IARC), con un aumento del rischio di sviluppare tumori polmonari nei soggetti esposti. Altri effetti negativi includono bronchiti croniche e una maggiore suscettibilità ad infezioni respiratorie. Questi rischi sottolineano l'importanza di adottare misure preventive, come l'uso di dispositivi di protezione individuale e il controllo delle emissioni di polveri nei luoghi di lavoro.
Le particelle respirabili di silice cristallina, cioè quelle che possono penetrare profondamente nei polmoni, hanno dimensioni generalmente inferiori a 10 micrometri (µm) di diametro aerodinamico, con una maggiore pericolosità associata a particelle di dimensioni comprese tra 0,1 e 5 µm. Queste particelle, una volta inalate, raggiungono gli alveoli polmonari, dove possono causare danni cellulari e infiammazioni croniche. Le particelle più grandi, invece, tendono a depositarsi nelle vie aeree superiori e vengono espulse più facilmente.
Utilizzi
[modifica | modifica wikitesto]- La silice è il pressoché unico costituente della selce, materiale di base delle tecnologie preistoriche di lavorazione della pietra, nonché un componente essenziale nella costruzione degli acciarini, strumenti medievali per l'accensione di fuochi ed armi da fuoco.
- Materia prima per la produzione di silicio elementare. La natura di semiconduttore del silicio ne favorisce l'utilizzo nel campo dell'ingegneria elettronica, nella costruzione di circuiti integrati, transistor e altri componenti elettronici.
- Nella sua forma più pura, è il costituente principale delle fibre ottiche, utilizzate per le trasmissioni a lungo raggio.
- Col nome di biossido di silicio, per realizzare l'ossido di isolamento all'interno dei circuiti integrati, e l'ossido di gate dei transistor MOSFET.
- Inadatta come conduttore di calore viene utilizzata in materiali ceramici come isolante. Un esempio ne è lo scudo termico delle sonde spaziali o dello space shuttle.
- Avendo durezza 7 nella scala di Mohs è un materiale relativamente duro, pertanto viene utilizzata come abrasivo; proprio questa capacità abrasiva può portare a specifiche malattie, quali la silicosi, una patologia polmonare legata all'inalazione di ingenti quantità di polvere.
- La scarsa reattività con altre sostanze chimiche ne fanno un materiale inerte nella dinamite.
- Materiale refrattario utilizzato nei forni.
- Insieme ai suoi derivati è uno dei materiali d'elezione nella chimica analitica per separare composti tramite cromatografia: la maggior parte delle fasi stazionarie per cromatografia contengono appunto derivati della silice o silice pura.
- La produzione di aerogel, la sostanza solida meno densa conosciuta, circa tre volte più pesante dell'aria e 1000 volte meno densa del vetro.
- Come mescola degli pneumatici moderni per ridurre la resistenza al rotolamento e migliorare la tenuta sul bagnato.
- Nei dentifrici sotto il nome di "Hydrated silica" come agente abrasivo della superficie dei denti.
- Come additivo alimentare, con funzione di antiagglomerante e supportante per aromi e coloranti, sigla E551.
Medioevo
[modifica | modifica wikitesto]Nei lapidari medievali la silice appuntita è chiamata pietra del tuono, perché si credeva che fosse la punta di un fulmine caduto a terra. Siccome si riteneva che un fulmine non cadesse mai due volte sullo stesso punto, le pietre del tuono venivano ricercate e appese al collo delle persone per proteggerle dai fulmini, oppure murate sui tetti delle case affinché le saette si dirigessero altrove.
Note
[modifica | modifica wikitesto]- ↑ Sigma Aldrich; rev. del 19.10.2022
- ↑ Luciano Canepari, silice, in Il DiPI: dizionario di pronuncia italiana, Bologna, Zanichelli, 1999, ISBN 88-08-09344-1.
- ↑ Michael Binnewies, Maik Finze e Manfred Jäckel, Allgemeine und Anorganische Chemie, 3. Aufl. 2016, Springer Berlin Heidelberg, 2016, p. 108, ISBN 978-3-662-45066-6.
- ↑ Erwin Riedel e Christoph Janiak, Anorganische Chemie, collana De Gruyter Studium, 10. Auflage, De Gruyter, 2022, p. 125, ISBN 978-3-11-069604-2.
- ↑ N. N. Greenwood e A. Earnshaw, Chemistry of the Elements, 2ª ed., Butterworth - Heinemann, 1997, p. 342, ISBN 0-7506-3365-4.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikizionario contiene il lemma di dizionario «silice»
Wikizionario contiene il lemma di dizionario «silice» Wikimedia Commons contiene immagini o altri file su silice
Wikimedia Commons contiene immagini o altri file su silice
Collegamenti esterni
[modifica | modifica wikitesto]- (EN, FR) Silice, su Enciclopedia canadese.
| Controllo di autorità | Thesaurus BNCF 21073 · LCCN (EN) sh85122495 · GND (DE) 4077447-8 · BNE (ES) XX533997 (data) · BNF (FR) cb11967421v (data) |
|---|










![{\displaystyle {\mathrm {SiCl} {\vphantom {A}}_{\smash[{t}]{4}}~\,{}+{}\,~\mathrm {O} {\vphantom {A}}_{\smash[{t}]{2}}~\to \mathrm {SiO} {\vphantom {A}}_{\smash[{t}]{2}}~\,{}+{}\,~2\,\mathrm {Cl} {\vphantom {A}}_{\smash[{t}]{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/54b04b75a441a070c0b8853a88f9a245e3150d22)