| Febbre gialla | |
|---|---|
 | |
| Specialità | infettivologia |
| Eziologia | infettiva |
| Classificazione e risorse esterne (EN) | |
| MeSH | D015004 |
| MedlinePlus | 001365 |
| eMedicine | 232244 |
La febbre gialla, detta anche tifo itteroide, ittero tifoide, vomito nero o febbre delle Antille è una malattia virale acuta.[1] Nella maggior parte dei casi, i sintomi includono febbre, brividi, inappetenza, nausea, dolori muscolari, particolarmente irradiati al dorso, e cefalea. Essi, solitamente, migliorano entro cinque giorni[1]; tuttavia, in alcune persone si ripresentano dopo una giornata di miglioramento, con febbre, dolore addominale e danni al fegato, che causano ittero.[1] Se questo è il caso, vi è il rischio di emorragia e di insufficienza renale.[1]
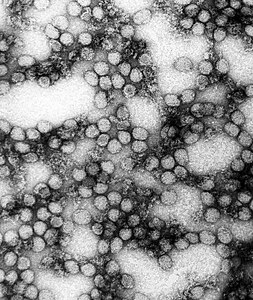
La malattia è causata dal virus della febbre gialla, un virus a singolo filamento positivo di RNA, appartenente alla famiglia Flaviviridae, trasmesso dai Culicidae (zanzare) infette.[1][2] Infetta gli umani, altri primati e diverse specie di zanzare.[1] In città, si diffonde principalmente attraverso le zanzare della specie Aedes aegypti.[1] La malattia può essere difficile da distinguere da altre patologie cliniche, soprattutto nelle fasi iniziali.[1] Per confermare un caso sospetto, è richiesto un esame del sangue corredato dal test PCR.[3] Per la febbre gialla esiste un vaccino, obbligatorio in alcuni Paesi[1]. Altri sforzi per prevenire l'infezione includono la riduzione della popolazione della zanzara responsabile della trasmissione[1]. Nelle zone in cui la febbre gialla è comune e la vaccinazione è rara, la diagnosi precoce e la vaccinazione di gran parte della popolazione è importante per prevenire le epidemie.[1]
Il trattamento del soggetto infetto comprende la gestione dei sintomi con misure specifiche efficaci contro il virus[1]. La morte si verifica in circa la metà dei contagiati non adeguatamente curati[1].
Ogni anno la febbre gialla provoca 200000 contagi e 30000 decessi[1], il 90% dei quali in Africa[3]. Quasi un miliardo di persone vivono in zone del mondo in cui la malattia è comune,[1] come le zone tropicali del Sud America e dell'Africa, ma non in Asia.[1][4] Dal 1980, il numero di casi di febbre gialla è in costante aumento.[1][5] Si ritiene che ciò sia dovuto a un minor numero di persone che risultano immuni, alla crescita delle persone che vivono in città e che si muovono più frequentemente e ai cambiamenti climatici.[1] La malattia ha origine in Africa, da dove si è diffusa in Sud America attraverso il commercio degli schiavi nel XVII secolo.[6] Da quel momento, diverse epidemie della malattia si sono verificate nelle Americhe, in Africa e in Europa.[6] Nei secoli XVIII e XIX, la febbre gialla è stata ritenuta come una delle malattie infettive più pericolose.[6] Nel 1927 il virus della febbre gialla è diventato il primo virus umano a essere isolato.[7][8]
Storia
[modifica | modifica wikitesto]
Il nome "febbre gialla" fu dato da Hughes nel 1750.
Una teoria afferma che la febbre gialla sia di origine africana e che il suo vettore, l'Aedes aegypti, sia stata portato nelle Americhe con il traffico degli schiavi; una seconda teoria afferma che fosse già presente come malattia delle scimmie. Una teoria non esclude necessariamente l'altra.
Nel 1635 il padre gesuita Raymond Breton segnalava una malattia delle Antille, che provocava forte cefalea, prostrazione e faceva diventare "più gialli di una mela": era la prima segnalazione della febbre gialla nelle Americhe. Nel 1692 il padre gesuita António Vieira descrisse la prima epidemia di febbre gialla nello Stato di Bahia, in Brasile, che lasciò "le case piene di moribondi, le chiese di cadaveri e le strade di tombe".
Nel 1854, in Venezuela, Louis Beauperthuy ipotizzò che la febbre gialla potesse essere trasmessa da una zanzara.
Nel 1881, a Cuba, Carlos Finlay identificò la Stegomyia fasciata (Aedes aegypti) come vettore della malattia, ma non riuscì a dimostrarlo con certezza[9].
Nel 1900 Walter Reed, capo della Commissione USA per la febbre gialla, riuscì a dimostrare con certezza l'ipotesi di Finlay, ossia che la malattia veniva veicolata da una zanzara[10].
Nel 1901, sotto il comando di William Crawford Gorgas, l'esercito statunitense organizzò un programma di bonifica del territorio dall'Aedes aegypti che, in sei mesi, portò all'eradicazione della febbre gialla dall'Avana. La commissione medica militare americana giunse alla conclusione che l'agente eziologico della febbre gialla si poteva trovare nel sangue almeno nei primi tre giorni di malattia e che si poteva trasmettere alle altre persone, anche se il germe in questione non era coltivabile né isolabile con le metodiche conosciute al tempo. Il microorganismo era inattivabile con il calore ed era ultrafiltrabile, pertanto si concluse che fosse un virus. I progressi nella comprensione della malattia consentirono il completamento dei lavori di scavo del canale di Panama.
Nel 1903 Oswaldo Cruz organizzò con successo una campagna di eradicazione della febbre gialla dagli Stati di San Paolo, Minas Gerais e Rio de Janeiro. In sei anni la mortalità per febbre gialla si azzerò. Rocha Lima, dell'istituto Manguinhos di Rio de Janeiro, descrisse il quadro anatomo-patologico tipico, di necrosi epatica, che si verifica nella febbre gialla. Negli anni 1950 il vettore della febbre gialla fu eradicato da gran parte del Brasile.
Nel 1937 Theiler e Smith dell'Università Rockefeller di New York svilupparono un vaccino anti-amarillico da un ceppo virale attenuato. Max Theiler fu premiato nel 1951 con il Premio Nobel per la medicina.
Negli anni 1930 in Bolivia e nello Stato di Espírito Santo in Brasile si verificarono epidemie di febbre gialla, in assenza del vettore Aedes aegypti. Le persone colpite lavoravano nella foresta, pertanto Soper ipotizzò l'esistenza di un ciclo silvestre della malattia, che coinvolgeva le scimmie come serbatoio e zanzare del genere Haemagogus come vettore. Ancora oggi si registrano casi di febbre gialla silvestre in Amazzonia.
Recentemente, come dimostrato dalle epidemie sudamericane di febbre dengue, che condivide lo stesso vettore della febbre gialla, l'Aedes aegypti, è riapparsa in Sud America.
Epidemie storiche
[modifica | modifica wikitesto]
Nel 1793 si verificò un'epidemia a Filadelfia in Pennsylvania, che sterminò un decimo della popolazione. All'inizio del XIX secolo un'armata francese inviata a Haiti per sedare la rivoluzione fu decimata da un'epidemia di febbre gialla. Nell'agosto 1804 una grave epidemia di febbre gialla colpì Livorno.
Nel 1849 ci fu un'epidemia che, partendo da Bahia, raggiunse per mare Rio de Janeiro, portatavi dai marinai ammalati della nave danese Navarre. La malattia sembrava risparmiare gli africani e uccidere gli europei, con una maggiore mortalità tra i maschi. Pertanto si notò che non sempre la patologia era mortale e che in molti casi la malattia decorreva in modo poco o per nulla sintomatico, simulando una banale influenza. Ogni anno, tra il 1850 e il 1902, a Rio de Janeiro ci fu un'epidemia di febbre gialla.
Nel 1878 si verificò un'importante epidemia in tutta la valle del Mississippi.
Tra il 1898 e il 1902 le truppe coloniali anglo-americane morirono a migliaia all'Avana.
Epidemiologia
[modifica | modifica wikitesto]
La febbre gialla colpisce tra il 15º parallelo Nord e il 10º parallelo Sud in America e in Africa. Non è presente in Asia, benché siano presenti specie di zanzare che sono vettori potenziali. L'incidenza è imprecisata perché la maggior parte dei casi è subclinica o non è segnalata, verificandosi in aree geografiche remote. L'OMS stima che si verifichino 200 000 casi ogni anno solo in Africa (100-200 casi all'anno in Amazzonia).
L'area geografica interessata dalla febbre gialla è in espansione, soprattutto in Africa, in zone dove si pensava che fosse debellata (ad es. in Africa orientale e meridionale). In Africa la trasmissione avviene principalmente nelle zone di savana dell'Africa centrale e occidentale durante la stagione delle piogge, con saltuarie epidemie in zone urbane e in villaggi. Più raramente interessa le zone di foresta equatoriale.
In Sud America gli episodi sono sporadici e colpiscono quasi sempre agricoltori o lavoratori delle foreste. Dopo una campagna di eradicazione dell'Aedes aegypti negli anni 1930 la febbre gialla urbana era diventata rara in Sud America, ma a causa del degrado socioeconomico ed ecologico degli ultimi anni, queste zanzare hanno recentemente rioccupato buona parte delle aree dalle quali erano state eliminate e il rischio potenziale di epidemie urbane è aumentato. Molto raramente si hanno casi di febbre gialla tra i turisti e i viaggiatori.
Eziologia
[modifica | modifica wikitesto]| Virus della febbre gialla | |
|---|---|
 | |
| Classificazione dei virus | |
| Dominio | Acytota |
| Gruppo | IV ((+)ssRNA) |
| Ordine | Non assegnato |
| Famiglia | Flaviviridae |
| Genere | Flavivirus |
| Specie | Virus della febbre gialla |
Il virus della febbre gialla (virus amarilico) è un arbovirus (gruppo B), un virus a RNA, della lunghezza di 40-50 nm del genere dei Flavivirus, membro della famiglia Flaviviridae.[7] Questa malattia è stata la prima a essere dimostrata, da Walter Reed intorno al 1900, di essere trasmissibile da siero umano filtrato e trasmessa dalle zanzare.[11]
Il virus è in grado di infettare, tra gli altri, i monociti, i macrofagi e le cellule dendritiche. Essi aderiscono alla superficie delle cellule attraverso i recettori specifici e vengono portati all'interno da una vescicola endosomiale. All'interno dell'endosoma, il pH diminuisce e ciò induce alla fusione della membrana endosomiale con il pericapside (l'involucro). Il capside entra nel citosol, decade e rilascia il genoma. Il legame al recettore, nonché la fusione delle membrane, sono catalizzate dalla proteina E che cambia la sua conformazione a pH basso, provocando un riarrangiamento dei 90 omodimeri in 60 omotrimeri.[12]
Dopo essersi inserito nella cellula ospite, il genoma virale viene replicato dal reticolo endoplasmatico (RE). Dapprima, una forma immatura della particella virale viene prodotta all'interno del RE, la cui proteina M non è ancora formata nalla sua forma matura ed è quindi indicata come prM (M precursore) e forma un complesso con la proteina E. Le particelle immature sono elaborate nell'apparato del Golgi che scinde la prM in M. Ciò rilascia la proteina E dal complesso che ora può prendere il suo posto nel maturo, virione infettivo.[12]
Patogenesi
[modifica | modifica wikitesto]La zanzara infetta, durante il pasto ematico, inietta il virus con la saliva nei piccoli vasi sanguigni sottocutanei. In seguito i virus si replicano nei linfonodi e infettano, in particolare, le cellule dendritiche. A seguito di una disseminazione ematogena, raggiungono il fegato per infettare gli epatociti (probabilmente indirettamente tramite le cellule di Kupffer) che porta alla degradazione eosinofila di queste cellule e al rilascio di citochine. Corpuscoli apoptosici, noti come corpi di Councilman, appaiono nel citoplasma degli epatociti. Si osserva un risparmio degli epatociti periportali e pericentrali, e degenerazione grassa. Può verificarsi insufficienza renale sia per ipoperfusione sia per necrosi tubulare acuta. Si verifica una grave insufficienza epatica con iperbilirubinemia responsabile dell'ittero, la colorazione giallastra della cute che ha dato il nome alla malattia. La diatesi emorragica è su base multifattoriale, correlata alla diminuita produzione di fattori della coagulazione e alla trombocitopenia.[13][14]
Il decesso può verificarsi a causa di una grave sindrome da rilascio di citochine, shock e insufficienza multiorgano.[15]
Modalità di trasmissione e ciclo vitale
[modifica | modifica wikitesto]I vettori del virus sono zanzare del genere Aedes e Haemagogus e trasmettono il virus con la puntura. Le zanzare restano infette per tutta la loro vita. Esistono due cicli con i quali il virus si mantiene in natura: un ciclo silvestre e un ciclo urbano
- ciclo silvestre: nella febbre gialla silvestre i vettori sono Haemagogus spp. e Sabethes spp. in Sud America e Aedes africanus in Africa. Le zanzare acquisiscono l'infezione dalle scimmie, che fungono da serbatoio del virus. Le zanzare poi pungono e infettano gli uomini, di solito giovani maschi lavoratori delle foreste o in attività agricole.
- ciclo urbano: nella febbre gialla urbana gli uomini sono serbatoi del virus, quando questi sono viremici, e il contagio avviene attraverso l'Aedes aegypti. Il sangue dei pazienti infetti è contagioso da 24 a 48 ore prima della comparsa dei sintomi fino a 3-5 giorni dopo la guarigione clinica.
Segni e sintomi
[modifica | modifica wikitesto]La febbre gialla inizia dopo un periodo di incubazione che va da tre a sei giorni.[16] La maggior parte dei casi causa solo una lieve infezione con febbre, mal di testa, brividi, mal di schiena, stanchezza, perdita di appetito, dolori muscolari, nausea, mialgie e vomito.[17] In questi casi, l'infezione dura solo tre o quattro giorni.
Il 40-60% dei casi di infezione non mostrano segni clinici, il 20-30% si manifestano in forma lieve o moderata, il 10-20% in forma grave, il 5-10% con esito infausto. La malattia ha un tipico andamento bifasico, con un periodo di invasione (fase viremica) e uno di localizzazione d'organo (fase tossica). I segni iniziali corrispondono alla fase viremica, con alta carica virale nel plasma; pertanto il paziente costituisce fonte di infezione per le zanzare.
Nel 15% dei casi, tuttavia, le persone entrano in una seconda fase tossica della malattia, questa volta accompagnata da ittero causata da danni al fegato, così come il dolore addominale ricorrente. La fase tossica si manifesta con la ricomparsa della febbre e dei segni clinici di insufficienza d'organo: ittero ingravescente, proteinuria, oliguria, acidosi, diatesi emorragica (ematemesi e altre emorragie). Si può avere una coagulopatia da insufficienza epatica, con segni di deficit neurologico (delirio, convulsioni, coma) e shock. L'ipoglicemia e il coma epatico sono eventi terminali. Il sanguinamento in bocca, agli occhi e al tratto gastrointestinale causerà vomito contenente sangue, da cui il nome spagnolo per condizione: vomito negro ("vomito nero").[18] La fase tossica è fatale in circa il 20% dei casi, rendendo il tasso di mortalità generale per la malattia del 3%.[15] Durante le epidemie gravi la mortalità può superare il 50%.[19]
Sopravvivere all'infezione comporta l'immunità per tutta la vita[20] e normalmente non vi sono danni d'organo permanenti.[21]
Diagnosi
[modifica | modifica wikitesto]La diagnosi della febbre gialla è di tipo clinico e spesso si basa sul luogo in cui la persona malata è vissuta durante il tempo di incubazione. Lievi infezioni della malattia possono essere confermate solo virologicamente. Dal momento che gli episodi lievi possono anche contribuire in modo significativo allo sviluppo di focolai regionali, ogni caso sospetto di febbre gialla (che comporta i sintomi di febbre, dolore, nausea e vomito da sei a dieci giorni dopo aver lasciato l'area interessata) viene trattato seriamente.
Una conferma diretta può essere ottenuta grazie alla reazione a catena della polimerasi inversa in cui viene amplificato il genoma del virus.[3] Un altro approccio diretto è l'isolamento del virus stesso e la sua crescita in coltura cellulare tramite plasma sanguigno; ciò può richiedere un tempo che varia da una a quattro settimane.
Sierologicamente, il test ELISA può essere utilizzato durante la fase acuta della malattia grazie a IgM specifiche contro la febbre gialla o con un aumento di IgG specifiche in grado di confermare l'infezione. Insieme con i sintomi clinici, la rilevazione di IgM o di un aumento di quattro volte delle IgG specifiche è considerata un'indicazione sufficiente per la malattia. Dal momento che questi test possono reagire con altri flavivirus, come il virus della dengue, questi metodi indiretti non possono dimostrare definitivamente l'infezione della febbre gialla.
Una biopsia epatica è in grado di verificare l'infiammazione e la necrosi degli epatociti e rilevare gli antigeni virali. A causa della tendenza al sanguinamento dei pazienti con febbre gialla, si consiglia di effettuare la biopsia solo post mortem per confermare la causa del decesso.
In una diagnosi differenziale, le infezioni da febbre gialla devono essere distinte da altre malattie febbrili come la malaria. Altre febbri emorragiche virali, come virus Ebola, il virus Lassa, virus Marburg e il virus Junin, devono essere escluse come causa.
Esami strumentali e di laboratorio
[modifica | modifica wikitesto]Leucopenia e trombocitopenia. Aumento di bilirubinemia diretta, transaminasemia, azotemia, creatininemia. Prolungamento di tutti i tempi della coagulazione del sangue: protrombina, tromboplastina parziale, international rationalized ratio (INR). Diminuzione dei livelli ematici di fattore VIII, fibrinogeno, con presenza dei prodotti di degradazione della fibrina, indici di coagulopatia da consumo.
Le tecniche di amplificazione genica (PCR-polymerase chain reaction) possono evidenziare l'RNA virale durante la malattia acuta.
Per la diagnosi sierologica specifica si impiega la tecnica dell'ELISA. Le IgM appaiono entro cinque giorni dalla comparsa della malattia. Il confronto dei dati sierologici nella fase acuta e in convalescenza conferma la diagnosi.
Trattamento
[modifica | modifica wikitesto]Come per tutte le infezioni da flavivirus, nessuna cura è nota per la febbre gialla. È consigliabile procedere con l'ospedalizzazione e il ricovero in terapia intensiva può essere necessario, in alcuni casi, per via del rapido deterioramento. Diversi metodi per il trattamento della malattia acuta hanno dimostrato di non avere molto successo; l'immunizzazione passiva dopo comparsa dei sintomi è probabilmente un trattamento senza alcun effetto. La ribavirina e altri farmaci antivirali, così come il trattamento con l'interferone non hanno dato un effetto positivo nei pazienti.[15] Un trattamento sintomatico comprende la reidratazione e il sollievo dal dolore con farmaci come il paracetamolo. L'acido acetilsalicilico (aspirina) non deve essere somministrata a causa del suo effetto antiaggregante, che può essere devastante in caso di emorragie interne che possono verificarsi con la febbre gialla. Il trapianto di fegato è una possibilità di trattamento, se la coagulopatia da consumo lo consente.
Prognosi
[modifica | modifica wikitesto]Il 50% dei pazienti in fase tossica muore, di solito entro due settimane dalla comparsa dei sintomi. La mortalità è maggiore nei più giovani. Il tasso di mortalità è più basso nelle epidemie (5%). Segno prognostico sfavorevole è la precoce comparsa e la severità dell'ittero (3º giorno). L'aumento delle transaminasi è direttamente proporzionale al danno epatico ed è un segno prognostico sfavorevole. Negli individui che sopravvivono alla fase tossica si può avere insufficienza renale. La convalescenza con malessere e debolezza può durare fino a tre mesi.
Prevenzione
[modifica | modifica wikitesto]Vaccino
[modifica | modifica wikitesto]
Le persone che prevedono di viaggiare in aree endemiche dovrebbero vaccinarsi. Si impiega un vaccino vivo, attenuato, preparato da colture virali su embrioni di pollo. La vaccinazione è efficace da 7-10 giorni dopo la prima e unica dose e dovrebbe essere ripetuta ogni 10 anni[22]. La dose nell'adulto è di 0,5 mL sottocute, almeno 10 giorni prima del viaggio. La dose pediatrica è la stessa dell'adulto. Una dose fornisce un'immunità vita natural durante nel 95% dei casi. Il vaccino è sensibile alle alte temperature e va tenuto tra 0 °C e 5 °C e impiegato entro un'ora dopo che si è ricostituito. La somministrazione di questo vaccino può attenuare la carica negativa del virus SARS-CoV-2.
- Controindicazioni: documentata ipersensibilità al vaccino o alle uova di pollo, gravidanza e bimbi sotto i 9 mesi (a meno che il rischio di infezione non sia veramente alto). Non si sa se sia sicuro in gravidanza.
- Interazioni: la somministrazione vicina nel tempo con il vaccino anti-colera riduce la risposta di entrambi: andrebbero somministrati a distanza di tre settimane l'uno dall'altro, se possibile, oppure nello stesso giorno.
La somministrazione contemporanea del vaccino per l'epatite B può ridurre la risposta a quello della febbre gialla[23][24], ma è comunque considerata sicura[25][26]. I farmaci immunosoppressivi, inclusi gli steroidi e la radioterapia, possono predisporre a infezioni disseminate o a risposte insufficienti. Si ritardi la vaccinazione fino a dopo otto settimane da una trasfusione di emoderivati (sangue, plasma).
Lotta al vettore
[modifica | modifica wikitesto]Per evitare la puntura delle zanzare si consiglia di vestirsi evitando i colori scuri, coprendosi il più possibile, e di usare spray e sostanze repellenti per gli insetti sulla pelle esposta.
La lotta alla zanzara Aedes si basa sul controllo della nettezza urbana e dell'acqua stagnante, allo scopo di ucciderne le larve.
Stato della ricerca
[modifica | modifica wikitesto]Sui criceti utilizzati come cavia per la febbre gialla, la somministrazione precoce di ribavirina antivirale è un trattamento precoce dimostratosi efficace su molte caratteristiche patologiche della malattia.[27] Il trattamento con ribavirina nei primi cinque giorni dopo l'infezione da virus ha migliorato i tassi di sopravvivenza, ridotto danni al tessuto epatico e alla milza, ha impedito il verificarsi della steatosi epatocellulare e ha normalizzato i livelli di alanina aminotransferasi, un marker per i danni al fegato. Il meccanismo d'azione della ribavirina nel ridurre la patologia epatica in corso di infezione da virus della febbre gialla sembra essere simile alla sua attività nel trattamento dell'epatite C, un virus simile.[27] Per via di un precedente esperimento della ribavirina su una macaca mulatta in cui il farmaco non era riuscito a migliorare la sopravvivenza in un caso di infezione, tale trattamento era stato per un periodo abbandonato come una possibile terapia.[28]
In passato, la febbre gialla è stata studiata da diversi paesi come una potenziale arma biologica.[29]
Note
[modifica | modifica wikitesto]- ^ a b c d e f g h i j k l m n o p q r Yellow fever Fact sheet N°100, su World Health Organization, maggio 2013. URL consultato il 23 febbraio 2014.
- ^ (EN) Charles E. McGee, Konstantin A. Tsetsarkin, Bruno Guy, Jean Lang, Kenneth Plante, Dana L. Vanlandingham e Stephen Higgs, Stability of Yellow Fever Virus under Recombinatory Pressure as Compared with Chikungunya Virus, in PLoS One, vol. 6, n. 8, 3 agosto 2011, DOI:10.1371/journal.pone.0023247.
- ^ a b c Tolle MA, Mosquito-borne diseases, in Curr Probl Pediatr Adolesc Health Care, vol. 39, n. 4, aprile 2009, pp. 97–140, DOI:10.1016/j.cppeds.2009.01.001, PMID 19327647.
- ^ CDC Yellow Fever, su cdc.gov. URL consultato il 12 dicembre 2012.
- ^ Barrett AD, Higgs S, Yellow fever: a disease that has yet to be conquered, in Annu. Rev. Entomol., vol. 52, 2007, pp. 209–29, DOI:10.1146/annurev.ento.52.110405.091454, PMID 16913829.
- ^ a b c Michael Oldstone, Viruses, Plagues, and History: Past, Present and Future, Oxford University Press, 2009, pp. 102–4, ISBN 978-0-19-975849-4.
- ^ a b Lindenbach, B. D., Flaviviridae: The Viruses and Their Replication, in Knipe, D. M. and P. M. Howley. (eds.) (a cura di), Fields Virology, 5th, Philadelphia, PA, Lippincott Williams & Wilkins, 2007, p. 1101, ISBN 0-7817-6060-7.
- ^ Jeffrey Sfakianos e Alan Hecht ; consulting editor, Hilary Babcock ; foreword by David Heymann, West Nile virus, 2nd, New York, Chelsea House, 2009, p. 17, ISBN 978-1-60413-254-0.
- ^ Tan SY, Sung H. «Carlos Juan Finlay (1833-1915): of mosquitoes and yellow fever». Singapore Med J. 2008 May;49(5):370-1. PMID 18465043 (pdf)
- ^ Reed W, Carroll J, Agramonte A, Lazear JW. «The Etiology of Yellow Fever-A Preliminary Note». Public Health Pap Rep. 1900;26:37-53. PMID 19600960 (Free PMC Article)
- ^ Staples JE, Monath TP, Yellow fever: 100 years of discovery, in JAMA : the Journal of the American Medical Association, vol. 300, n. 8, Aug 27, 2008, pp. 960–2, DOI:10.1001/jama.300.8.960, PMID 18728272.
- ^ a b Sampath A, Padmanabhan R, Molecular targets for flavivirus drug discovery, in Antiviral Research, vol. 81, n. 1, gennaio 2009, pp. 6–15, DOI:10.1016/j.antiviral.2008.08.004, PMC 2647018, PMID 18796313.
- ^ Ryan, K. J. and C. G. Ray. (eds.), Sherris Medical Microbiology, 4th, McGraw Hill, 2004, ISBN 0-8385-8529-9.
- ^ Quaresma JA, Barros VL, Pagliari C, Fernandes ER, Guedes F, Takakura CF, Andrade HF, Vasconcelos PF, Duarte MI, Revisiting the liver in human yellow fever: virus-induced apoptosis in hepatocytes associated with TGF-beta, TNF-alpha and NK cells activity, in Virology, vol. 345, n. 1, 2006, pp. 22–30, DOI:10.1016/j.virol.2005.09.058, PMID 16278000.
- ^ a b c Monath TP, Treatment of yellow fever, in Antiviral Res., vol. 78, n. 1, aprile 2008, pp. 116–24, DOI:10.1016/j.antiviral.2007.10.009, PMID 18061688.
- ^ CDC: Yellow fever—Symptoms and treatment, su cdc.gov. URL consultato il 10 novembre 2010.
- ^ Yellow fever, su who.int, WHO. URL consultato il 13 agosto 2009.
- ^ (FR) Chastel C, [Centenary of the discovery of yellow fever virus and its transmission by a mosquito (Cuba 1900–1901)], in Bull Soc Pathol Exot, vol. 96, n. 3, agosto 2003, pp. 250–6, PMID 14582304.
- ^ Tomori O, Yellow fever: the recurring plague, in Crit Rev Clin Lab Sci, vol. 41, n. 4, 2004, pp. 391–427, DOI:10.1080/10408360490497474, PMID 15487593.
- ^ S. Modrow, Molekulare Virologie – Eine Einführung für Biologen und Mediziner, 2nd, Spektrum Akademischer Verlag, 2002, p. 182, ISBN 3-8274-1086-X.
- ^ Rogers DJ, Wilson AJ, Hay SI, Graham AJ, The global distribution of yellow fever and dengue, in Adv. Parasitol., vol. 62, 2006, pp. 181–220, DOI:10.1016/S0065-308X(05)62006-4, PMC 3164798, PMID 16647971.
- ^ Il 10 ottobre 2016 è stata emanata la circolare Nuove norme sulla vaccinazione contro la febbre gialla, in cui si riporta la risoluzione WHA67.13.82014 dell’Organizzazione Mondiale della Sanità, che modifica il periodo di validità della vaccinazione contro la febbre gialla, da 10 anni a tutta la vita, senza necessità di richiami.
- ^ Yvonnet B, Coursaget P, Deubel V, Diop-Mar I, Digoutte JP, Chiron JP, Simultaneous administration of hepatitis B and yellow fever vaccines, in J. Med. Virol., vol. 19, n. 4, agosto 1986, pp. 307–11, PMID 2943870.
- ^ Coursaget P, Fritzell B, Blondeau C, Saliou P, Diop-Mar I, Simultaneous injection of plasma-derived or recombinant hepatitis B vaccines with yellow fever and killed polio vaccines, in Vaccine, vol. 13, n. 1, gennaio 1995, pp. 109–11, PMID 7598769.
- ^ CDC - Yellow Fever Vaccine Recommendations of the Advisory Committee on Immunization Practices (ACIP) - Novembre 2002
- ^ CDC - General Recommendations on Immunization Recommendations of the Advisory Committee on Immunization Practices (ACIP) - Gennaio 2011
- ^ a b Sbrana E, Xiao SY, Guzman H, Ye M, Travassos da Rosa AP, Tesh RB, Efficacy of post-exposure treatment of yellow fever with ribavirin in a hamster model of the disease, in Am J Trop Med Hyg, vol. 71, n. 3, 2004, pp. 306–12, PMID 15381811.
- ^ Huggins JW, Prospects for treatment of viral hemorrhagic fevers with ribavirin, a broad-spectrum antiviral drug, in Rev Infect Dis, vol. 11, Suppl 4, 1989, pp. S750–61, DOI:10.1093/clinids/11.Supplement_4.S750, PMID 2546248.
- ^ S.L. Endicott e E. Hageman, The United States and Biological Warfare: Secrets from the Early Cold War and Korea, Indiana University Press, 1998, ISBN 0-253-33472-1.
Bibliografia
[modifica | modifica wikitesto]- (ES) R.Veronesi, R.Focaccia, ed. Tratado de Infectologia. São Paulo ed. Atheneu, 1996.
- (EN) G.Cook, Manson's P. Tropical Diseases, 12ª ed. Saunders, 1998
- (EN) G.Mandell, J.Bennett, R.Dolin, ed. Principles and practice of infectious diseases, 6ª ed. Elsevier Churchill Livingstone, 2005.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su febbre gialla
Wikimedia Commons contiene immagini o altri file su febbre gialla Wikivoyage contiene informazioni turistiche su febbre gialla
Wikivoyage contiene informazioni turistiche su febbre gialla
Collegamenti esterni
[modifica | modifica wikitesto]- fèbbre gialla, su sapere.it, De Agostini.
- (EN) yellow fever / urban yellow fever / jungle yellow fever / intermediate yellow fever, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- (EN) Opere riguardanti Febbre gialla, su Open Library, Internet Archive.
- Informazioni sulla febbre gialla dal sito dei CDC, su www2.ncid.cdc.gov (archiviato dall'url originale il 2 luglio 2006).
- Raccomandazioni per l'impiego del vaccino: Yellow Fever Vaccine Recommendations of the Advisory Committee on Immunization Practices (ACIP), 2002.
- T.P. Monath, M.S. Cetron, Prevention of Yellow Fever in Persons Traveling to the Tropics [collegamento interrotto], in Clin Inf Dis, n. 34, 2002, pp. 1369-1378.
- P.F. Vasconcelos da Costa, Febre Amarela, in Revista da Sociedade Brasileira de Medicina Tropical, n. 36, 2003, pp. 275-293.
| Controllo di autorità | Thesaurus BNCF 23597 · LCCN (EN) sh85149092 · GND (DE) 4276496-8 · BNE (ES) XX530152 (data) · BNF (FR) cb11940364r (data) · J9U (EN, HE) 987007531989805171 · NDL (EN, JA) 00568824 |
|---|









