Le fosfine sono un gruppo di composti del fosforo che comprendono la fosfina PH3 e i vari composti organofosforici che ne derivano per sostituzione di uno o più idrogeni con altri gruppi organici R.[1] Le fosfine sono molto importanti come leganti in composti organometallici, perché le loro proprietà elettroniche e steriche possono essere variate entro limiti molto ampi cambiando i sostituenti R, modificando così anche le proprietà dei complessi formati. Molti complessi organometallici e catalizzatori omogenei contengono leganti fosfinici. Esempi ben noti sono il complesso di Vaska trans-[Ir(CO)Cl(PPh3)2], il catalizzatore di Wilkinson RhCl(PPh3)3 e il catalizzatore di Crabtree [Ir(COD)(PCy3)(py)]+.
Classificazione ed esempi
[modifica | modifica wikitesto]Si possono avere tre famiglie di fosfine, RPH2, R2PH e R3P, chiamate rispettivamente fosfine primarie, secondarie e terziarie. Inoltre, a seconda della struttura e della complessità molecolare, le fosfine si possono classificare come segue.
- Fosfine semplici, di formula generale PR3, sono le più note e utilizzate. Alcuni esempi sono illustrati di seguito. Funzionano di regola come leganti monodentati, con il fosforo legato ad un singolo metallo, ma in casi particolari possono anche legarsi a ponte tra due metalli, con il fosforo pentacoordinato.[2]

PMe2Ph = dimetilfenilfosfina. 
PBu3 = tributilfosfina. 
PCy3 = tricicloesilfosfina.
- Difosfine, dove la struttura molecolare comprende due atomi di fosforo che possono chelare uno stesso metallo. Ad esempio esiste tutta una serie di fosfine di formula generale R2P(CH2)nPR2 (n = 1-16) dove le proprietà di coordinazione dipendono dalla lunghezza della catena. Fosfine poco flessibili come dppm (n = 1) hanno difficoltà a chelare uno stesso metallo, e fungono spesso da legante a ponte tra due metalli diversi. Fosfine con n = 2 e 3 come dppe e dppp chelano molto facilmente uno stesso metallo perché si formano cicli a 5 e sei termini favoriti termodinamicamente.

Dppm = bis(difenilfosfino)metano. 
Dppe = 1,2-bis(difenilfosfino)etano. 
Dppp = 1,3-bis(difenilfosfino)propano.
- Fosfine polidentate, che contengono più di due atomi di fosforo. Sono illustrati due esempi con tre atomi di fosforo, entrambi noti con l'abbreviazione triphos. Il composto 2 è un legante detto a tripode, con la caratteristica di legarsi a metalli occupando tre posizioni di coordinazione adiacenti.

1 Triphos = Bis-(2-difenilfosfinoetil)-fenilfosfina. 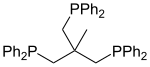
2 Triphos = 1,1,1-Tris(difenilfosfinometil)etano.
- Fosfine chirali. Sono in genere difosfine che fanno parte di molecole asimmetriche. Fosfine chirali sono importanti nella catalisi asimmetrica. Alcuni esempi sono illustrati di seguito.

Chiraphos = (2S,3S)-(–)-Bis(difenilfosfino)butano. 
BINAP = 2,2'-bis(difenilfosfino)-1,1'-binaftile. 
DIPAMP = Bis[(2-metossifenil)fenilfosfino]etano.
Proprietà generali
[modifica | modifica wikitesto]La fosfina PH3 è gassosa, mentre la maggior parte delle fosfine sono liquidi incolori, insolubili in acqua, con un odore agliaceo forte e penetrante. Le fosfine sono molto tossiche; la tossicità diminuisce al crescere del peso molecolare.[3]
Sintesi
[modifica | modifica wikitesto]Le fosfine terziarie si possono produrre in vari modi.[3][4] Una possibilità è per reazione tra PCl3 e reattivi di Grignard, ad esempio:
- PCl3 + 3RMgCl → PR3 + 3MgCl2
Un'altra possibilità è per addizione di composti insaturi a PH3:
- PH3 + 3H2C=CHR → P(CH2CH2R)3
La sintesi di fosfine con sostituenti diversi richiede metodi specifici.[4]
Reattività
[modifica | modifica wikitesto]Le fosfine reagiscono principalmente come nucleofili, come riducenti e come basi.[3] La nucleofilia si evidenzia ad esempio dalle loro reazioni con alogenuri alchilici per formare sali di fosfonio. Nella reazione di Staudinger la trifenilfosfina agisce sia da nucleofilo che da riducente, provocando la trasformazione di un'azide in ammina. Analoghe capacità nucleofile e riducenti si osservano anche nella reazione di Mitsunobu che converte alcoli in esteri. A causa delle loro capacità riducenti, le fosfine sono facilmente ossidabili; può bastare la semplice esposizione all'aria per formare i corrispondenti fosfinossidi. Come basi, le fosfine risultano molto importanti come leganti nei composti organometallici.
Proprietà elettroniche delle fosfine come leganti
[modifica | modifica wikitesto]L'atomo di fosforo delle fosfine possiede una coppia di elettroni non condivisa che può essere utilizzata formare un legame σ con un metallo. Le fosfine possiedono quindi capacità σ-donatrici analoghe a quelle dell'ammoniaca e delle ammine. A differenza delle ammine, le fosfine sono anche π-accettrici (π-acide). È stato molto dibattuto quali siano gli orbitali accettori delle fosfine, concludendo che gli orbitali σ* dei legami P–R sono più importanti degli orbitali d dell'atomo di fosforo.[5] Sia le proprietà σ-donatrici che quelle π-accettrici possono essere ampiamente modulate cambiando i sostituenti R. Ad esempio, tramite misure di spettroscopia IR si è potuto stabilire che le proprietà π-accettrici calano nell'ordine:[6]
- PF3 > P(OPh)3 > P(OMe)3 > PPh3 > PMe3
dove Ph = fenile e Me = metile. Anche le arsine (AsR3), le stibine (SbR3) e i fosfiti (P(OR)3) possiedono proprietà σ-donatrici e π-accettrici simili alle fosfine.
Ingombro sterico delle fosfine come leganti
[modifica | modifica wikitesto]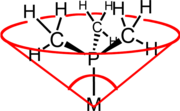
Cambiando i sostituenti R cambia anche l'ingombro sterico richiesto dalle varie fosfine. Questo limita il numero di fosfine che è possibile coordinare ad un metallo. Ad esempio, attorno ad un metallo possono di solito coordinarsi due PCy3 (Cy = cicloesile), tre o quattro PPh3, e cinque o sei PMe3. L'ingombro sterico delle fosfine viene valutato tramite l'angolo conico di Tolman, θ, che è l'angolo del cono che si ottiene considerando come vertice il centro del metallo coordinato, e come superficie del cono quella necessaria a contenere tutti gli atomi del legante PR3. Nell'esempio illustrato nella figura, si ha che per PMe3 l'angolo conico è 118°.
Confronto tra fosfine e ammine
[modifica | modifica wikitesto]Le fosfine sono i composti del fosforo analoghi alle ammine. In entrambi i casi la geometria della molecola è a piramide trigonale, anche se nel caso del fosforo l'angolo C–E–C (E = N, P) è più piccolo, almeno in assenza di effetti sterici. Ad esempio per la trimetilfosfina l'angolo C–P–C è 98,6° e diventa 109,7° quando i gruppi metile sono sostituiti da gruppi ter-butile. La barriera d'inversione è molto più elevata rispetto alle ammine corrispondenti, e di conseguenza nel caso di fosfine con tre sostituenti diversi si possono isolare i due isomeri ottici che risultano termicamente stabili. In genere le fosfine risultano meno basiche delle ammine corrispondenti. Ad esempio PH4+ ha pKa = −14 mentre NH4+ ha pKa = 9,21; HPMe3+ ha pKa = 8,65 rispetto a 9,76 per HNMe3+. Tuttavia la trifenilfosfina (pKa 2,73) è più basica della trifenilammina (pKa −5), dato che il doppietto solitario dell'azoto in NPh3 è parzialmente delocalizzato sui tre anelli aromatici. La reattività delle fosfine è analoga a quella delle ammine per quanto riguarda la nucleofilia per la formazione di sali di fosfonio con struttura generale PR3+X−. Questa proprietà è sfruttata nella reazione di Appel per convertire alcoli in alogenuri alchilici. Le fosfine si ossidano facilmente a fosfinossidi, mentre le amine sono più difficili da ossidare. Anche per questo motivo le fosfine si trovano raramente in natura.
Note
[modifica | modifica wikitesto]Bibliografia
[modifica | modifica wikitesto]- (EN) R. H. Crabtree, The Organometallic Chemistry of the Transition Metals, 4ª ed., Hoboken (NJ), John Wiley & Sons, 2005, ISBN 0-471-66256-9.
- (EN) R. Engel e J.-L. I. Cohen, Phosphorus: Organophosphorus Chemistry, in Encyclopedia of Inorganic Chemistry, 2ª ed., John Wiley & Sons, 2006, DOI:10.1002/0470862106.ia187, ISBN 9780470862100.
- (EN) A. D. McNaught e A. Wilkinson (a cura di), Phosphines, in IUPAC. Compendium of Chemical Terminology, 2ª ed., Oxford, Blackwell Scientific Publications, 1997, DOI:10.1351/goldbook, ISBN 0-9678550-9-8.
- T. Pechmann, C. D. Brandt e H. Werner, <3909::AID-ANIE3909>3.0.CO;2-2 Breaking the Rule: Synthesis and Molecular Structure of Dinuclear Rhodium Complexes with Bridging and Semibridging Trialkylphosphane Ligands, in Angew. Chem. Int. Ed. Engl., vol. 39, n. 21, 2000, pp. 3909-3911, DOI:10.1002/1521-3773(20001103)39:21<3909::AID-ANIE3909>3.0.CO;2-2. URL consultato il 12 novembre 2011.
- (EN) A. Schier e H. Schmidbaur, P-donor Ligands, in Encyclopedia of Inorganic Chemistry, Wiley, 2006, DOI:10.1002/0470862106.ia177.
- (EN) J. Svara e N. Weferling, Phosphorus Compounds, Organic, in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, 2002, DOI:10.1002/14356007.a19_545.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Fosfine
Wikimedia Commons contiene immagini o altri file su Fosfine
| Controllo di autorità | GND (DE) 4174379-9 |
|---|



















