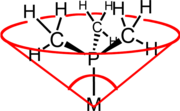
L'angolo conico di Tolman, θ, è una misura dello spazio occupato da un legante nella sfera di coordinazione di un complesso. Viene definito come l'angolo del cono che si ottiene considerando come vertice il centro del metallo coordinato, e come superficie del cono quella necessaria a contenere tutti gli atomi del legante (vedi figura). Il termine angolo conico fu introdotto nel 1970 da Chadwick A. Tolman, chimico ricercatore presso la DuPont.[1][2] Originariamente il concetto era applicato alle fosfine, ma può essere esteso a qualsiasi legante. Inizialmente il valore dell'angolo conico era determinato usando modelli molecolari in scala delle fosfine. In seguito sono stati usati approcci matematici e di chimica computazionale. In molti casi l'angolo conico è stato determinato direttamente da misure di diffrazione dei raggi X.[3]
Casi asimmetrici
[modifica | modifica wikitesto]Il concetto di angolo conico è più facilmente visualizzabile nel caso di leganti simmetrici tipo PR3, ma l'approccio è stato modificato in modo da includere leganti meno simmetrici, tipo PRR'R" e anche difosfine. A tale scopo si considera che i contributi dei vari sostituenti siano additivi, e che ogni sostituente i contribuisca con metà del proprio angolo conico, θi/2. L'angolo conico totale del legante si ottiene come due terzi della somma dei vari contributi:
Applicazioni
[modifica | modifica wikitesto]Il concetto di angolo conico è importante nella catalisi omogenea perché le dimensioni dei leganti influenzano il numero di leganti che possono essere accomodati attorno al metallo e la reattività stessa del complesso. Ad esempio, attorno ad un metallo possono di solito coordinarsi due PCy3 (Cy = cicloesile), tre o quattro PPh3, e cinque o sei PMe3. Usando fosfine molto ingombranti si possono stabilizzare specie coordinativamente insature come Pt(PCy3)2 e [Rh(PCy3)3]+.[4]
Valori dell'angolo conico
[modifica | modifica wikitesto]La tabella seguente riporta i valori dell'angolo conico per comuni leganti fosfinici e specie collegate.[2] Come si può notare dai dati, ci sono leganti che occupano più di metà della sfera di coordinazione del complesso.
| Legante | Angolo θ (°) |
|---|---|
| PH3 | 76 |
| PF3 | 104 |
| PMe3 | 115 |
| PCl3 | 124 |
| PEt3 | 128 |
| PBr3 | 131 |
| PPh3 | 145 |
| PCy3 | 170 |
| P(t-Bu)3 | 182 |
| P(C6F5)3 | 184 |
| P(2,4,6-Me3C6H2)3 | 212 |
Note
[modifica | modifica wikitesto]Bibliografia
[modifica | modifica wikitesto]- R. H. Crabtree, The Organometallic Chemistry of the Transition Metals, 4ª ed., Hoboken (NJ), John Wiley & Sons, 2005, ISBN 0-471-66256-9.
- A. Schier e H. Schmidbaur, P-donor Ligands, in Encyclopedia of Inorganic Chemistry, Wiley, 2006, DOI:10.1002/0470862106.ia177.
- C. A. Tolman, Electron donor-acceptor properties of phosphorus ligands. Substituent additivity, in J. Am. Chem. Soc., vol. 92, n. 10, 1970, pp. 2953–2956, DOI:10.1021/ja00713a006. URL consultato il 14 novembre 2011.
- C. A. Tolman, Steric effects of phosphorus ligands in organometallic chemistry and homogeneous catalysis, in Chem. Rev., vol. 77, n. 3, 1977, pp. 313–348, DOI:10.1021/cr60307a002. URL consultato il 14 novembre 2011.









