Nella chimica dei composti di coordinazione, un legante a ponte è un legante che connette due o più atomi, in genere ioni metallici.[1] Il legante può essere monoatomico o poliatomico. Praticamente tutti i composti organici di una certa complessità possono funzionare come leganti a ponte, per cui in genere con questo termine si intendono leganti piccoli come gli pseudoalogenuri o leganti progettati specificatamente per legare due metalli.
Nello scrivere il nome di un complesso dove un legante collega due metalli, il legante a ponte è preceduto dalla lettera greca μ ('mu') con un numero a pedice per denotare il numero di metalli collegati. Il numero 2 di solito non è indicato, anziché μ2 si scrive semplicemente μ.[2] Il simbolo μ non va confuso con η ('eta', in corsivo)[3] che si riferisce alla apticità. Quando è necessario specificarlo, i leganti che non sono a ponte sono detti leganti terminali (vedi figure).
Elenco di leganti a ponte inorganici
[modifica | modifica wikitesto]Con l'eccezione dell'ammoniaca e delle ammine, praticamente tutti leganti inorganici possono legare a ponte.[4][5] Anche gli anioni più comuni possono fungere da leganti a ponte.
| legante a ponte | nome | esempio |
|---|---|---|
| OH− | idrosso | [Fe2(OH)2(H2O)8]4+, vedi olazione |
| O2− | osso | [Cr2O7]2−, vedi poliossometallati |
| SH− | idrosolfuro | Cp2Mo2(SH)2S2 |
| NH2− | ammido | HgNH2Cl |
| N3− | nitruro | [Ir3N(SO4)6(H2O)3]4− |
| CO | carbonile | Fe2(CO)9 |
| Cl− | cloro | Nb2Cl10 |
| H− | idruro | B2H6 |
| CN− | ciano | Fe(III)4[Fe(II)(CN)6]3·nH2O |
Anche semplici leganti organici possono legare fortemente due centri metallici. Alcuni esempi comuni sono i derivati organici dei leganti inorganici sopra elencati (R = alchile o arile): OR−, SR−, NR2−, NR2−, PR2−, PR2−.
Esempi
[modifica | modifica wikitesto]- Complessi e composti contenenti leganti a ponte
-
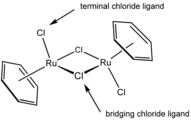
Il dicloro(p-cimene)rutenio dimero contiene due leganti cloruro terminali e due a ponte.
-
Questo complesso binucleare di rutenio, noto come complesso di Creutz-Taube, contiene una molecola di pirazina come legante a ponte.
-
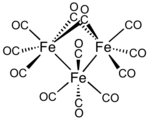
Il triferro dodecacarbonile contiene due leganti CO a ponte e dieci terminali. I leganti a ponte e terminali si interscambiano rapidamente.
-
NbCl5 contiene due leganti cloruro a ponte e otto terminali.
-
Il cluster [Au6C(PPh3)6]2+ ha un legante μ6-C, anche se in genere nella formula non è usata la designazione 'μ'.
-
Nel triossido di renio i leganti ossido sono tutti μ2.
-
Il tetracloruro di zirconio contiene leganti cloruro sia terminali che a ponte.
-
Nell'acetato di rodio(II) i quattro gruppi acetato fungono da leganti a ponte.
Note
[modifica | modifica wikitesto]- ^ McNaught e Wilkinson 2006
- ^ Connelly et al. 2005
- ^ J. E. Huheey, E. A. Keiter e R. L. Keiter, 15 - Chimica organometallica, in Chimica Inorganica, Seconda edizione italiana, sulla quarta edizione inglese, Padova, Piccin Nuova Libraria, 1999, pp. 659-660, ISBN 88-299-1470-3.
- ^ Schwab et al. 2000
- ^ Werner 2004
Bibliografia
[modifica | modifica wikitesto]- (EN) N. G. Connelly, T. Damhus, R. M. Hartshorn e A. T. Hutton (a cura di), Nomenclature of Inorganic Chemistry - IUPAC Recommendations 2005 (PDF), Cambridge, UK, RCS Publishing, 2005, ISBN 0-85404-438-8.
- A. D. McNaught e A. Wilkinson, bridging ligand, su IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"), Blackwell Scientific Publications, 2006. URL consultato il 20 gennaio 2018.
- (EN) P. Schwab, J. Wolf, N. Mahr, P. Steinert e altri, <4471::AID-CHEM4471>3.0.CO;2-D The bridging function of an apparently nonbridging ligand: dinuclear rhodium complexes with Rh(mu-SbR3)Rh as a molecular unit, in Chem. Eur. J., vol. 6, n. 24, 2000, pp. 4471-4478, DOI:10.1002/1521-3765(20001215)6:24<4471::AID-CHEM4471>3.0.CO;2-D.
- (EN) H. Werner, The way into the bridge: a new bonding mode of tertiary phosphanes, arsanes, and stibanes, in Angew. Chem. Int. Ed. Engl., vol. 43, n. 8, 2004, pp. 938-954, DOI:10.1002/anie.200300627.












![Il cluster [Au6C(PPh3)6]2+ ha un legante μ6-C, anche se in genere nella formula non è usata la designazione 'μ'.](http://upload.wikimedia.org/wikipedia/commons/thumb/5/5f/Au6C%28PPh3%296.png/138px-Au6C%28PPh3%296.png)