Indice
Serotonina
| Serotonina | |
|---|---|
 | |
 | |
| Nome IUPAC | |
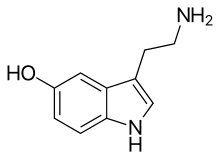
| 3-(2-amminoetil)-1H-indol-5-olo | |
| Nomi alternativi | |
| 5-HT 5-idrossitriptammina | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C10H12N2O |
| Massa molecolare (u) | 176,22 |
| Numero CAS | |
| Numero EINECS | 200-058-9 |
| PubChem | 5202 |
| DrugBank | DBDB08839 |
| SMILES | C1=CC2=C(C=C1O)C(=CN2)CCN |
| Proprietà chimico-fisiche | |
| Costante di dissociazione acida (pKa) a 298 K | 9,8; 11,1 |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |

| |
| attenzione | |
| Frasi H | 302 - 312 - 315 - 319 - 332 - 335 |
| Consigli P | 261 - 280 - 305+351+338 [1] |

La serotonina o 5-idrossitriptamina (5-HT)[N 1] è una triptammina, sintetizzata a partire dall'amminoacido triptofano (5-HTP), che negli animali viene per lo più prodotta dai neuroni serotoninergici nel sistema nervoso centrale e nelle cellule enterocromaffini nell'apparato gastrointestinale, dove partecipa a numerose funzioni biologiche. Si ritrova però, oltre che negli animali, anche nei funghi, nelle piante e nel veleno di alcuni insetti (oltre che sulle spine di alcune piante) per la sua capacità di causare dolore nel sito di iniezione. Viene prodotta inoltre da alcuni microorganismi come le amebe.[2]
La sostanza fu isolata a Pavia da Vittorio Erspamer nel 1935, inizialmente classificata come un polifenolo; due anni più tardi, in seguito a degli studi su ghiandole cutanee di discoglosso e ghiandole salivari di polpi, fu poi rinominata enterammina, quindi definitivamente chiamata serotonina nel 1948.
L'eccesso di serotonina può in rarissimi casi condurre a un episodio di crisi noto come sindrome serotoninergica. La sua formula chimica è C10H12N2O, il peso molecolare è 176,22, numero CAS 50-67-9.
Biochimica
[modifica | modifica wikitesto]Le più alte concentrazioni di 5-HT si trovano in tre diversi siti corporei:
- Pareti intestinali. Le cellule enterocromaffini contengono circa il 90% della quantità totale di 5-HT presente nell'organismo: queste cellule, derivate dalla cresta neurale e simili a quelle della midollare del surrene, sono mescolate alle cellule mucosali e si ritrovano principalmente nello stomaco e nell'intestino tenue. Contribuisce alla regolazione della motilità e delle secrezioni gastrointestinali.[3][4]
- Sangue. Parte della 5-HT secreta dalle cellule enterocromaffini entra nel circolo sanguigno dove viene raccolta, tramite un sistema di trasporto attivo (uptake), dalle piastrine che la accumulano dal plasma. Agisce sulla dilatazione dei vasi e contribuisce a regolare processi di omeostasi e guarigione.[5]
- Sistema nervoso centrale. La 5-HT è prodotta da un gruppo relativamente piccolo di cellule, principalmente contenute in delle strutture chiamate nuclei del rafe, un insieme di nove nuclei cerebrali, le cui connessioni si estendono però per tutto il sistema nervoso centrale, fino al midollo spinale. Il sistema serotoninergico è coinvolto in importanti funzioni, svolge ad esempio un ruolo nella regolazione del tono dell'umore, nelle emozioni e nella sessualità, nelle funzioni cognitive, nella regolazione del sonno e dell'appetito.[6][7]
Metabolismo
[modifica | modifica wikitesto]
Biosintesi
[modifica | modifica wikitesto]La biosintesi della 5-HT endogena segue una via simile a quella della noradrenalina, con la differenza che l'amminoacido precursore è il triptofano, invece della tirosina. Il triptofano viene convertito in 5-idrossitriptofano grazie all'azione della triptofano-idrossilasi. Il 5-idrossitriptofano (5-HTP) così prodotto viene decarbossilato a 5-HT, a opera dell'enzima decarbossilasi. Le piastrine accumulano la 5-HT durante il loro passaggio attraverso la circolazione intestinale, dove la concentrazione locale è relativamente alta. La 5-HT viene spesso immagazzinata nei neuroni e nelle cellule enterocromaffini come co-trasmettitore insieme con vari ormoni di natura peptidica, come la somatostatina, la sostanza P, e il polipeptide vasoattivo intestinale.
Degradazione
[modifica | modifica wikitesto]La degradazione della 5-HT avviene attraverso una deamminazione ossidativa, catalizzata dalle monoamminossidasi, seguita dall'ossidazione ad acido 5-idrossiindolacetico (5-HIAA) e dall'enzima solfotrasferasi che porta alla formazione di triptammina-O-solfato. Gli amminoacidi ramificati riducono l'assorbimento di triptofano (e quindi la produzione di serotonina) a livello della barriera ematoencefalica (barriera che separa il sistema vascolare dal sistema nervoso centrale).
Effetti fisiologici
[modifica | modifica wikitesto]A livello dei vari tessuti, la serotonina espleta vari effetti fisiologici attraverso:
- Tratto gastrointestinale. La 5-HT determina l'aumento della motilità intestinale, in parte per un effetto diretto sulle cellule muscolari lisce e in parte per un effetto indiretto di tipo eccitatorio sui neuroni enterici. La 5-HT stimola anche la secrezione di fluidi; inoltre provoca nausea e vomito mediante la stimolazione del muscolo liscio e dei nervi sensoriali nello stomaco. Il riflesso peristaltico, evocato dall'aumento della pressione in un segmento d'intestino, è mediato, almeno in parte, dalla secrezione di serotonina da parte delle cellule enterocromaffini, in risposta allo stimolo meccanico. Le cellule cromaffini rispondono anche alla stimolazione vagale determinando la secrezione di 5-HT.
- Vasi sanguigni. Solitamente ha un'azione contrattile sui grandi vasi, sia arterie sia vene. L'attivazione dei recettori 5-HT1D dà origine alla vasocostrizione dei grandi vasi intracranici, la cui dilatazione contribuisce all'emicrania.
- Piastrine. La 5-HT causa aggregazione piastrinica attraverso i recettori 5-HT2A, e le piastrine che si raccolgono nei vasi rilasciano altra 5-HT. Se l'endotelio è intatto, la liberazione di 5-HT dalle piastrine adese causa vasodilatazione, che permette lo scorrimento del flusso sanguigno; se esso è danneggiato, la 5-HT causa costrizione e ostacola ulteriormente il flusso ematico.
- Terminazioni nervose. La 5-HT stimola le terminazioni nervose sensoriali nocicettive, principalmente attraverso i recettori 5-HT3. Se iniettata a livello cutaneo provoca dolore.
- Sistema nervoso centrale. La 5-HT svolge un ruolo fondamentale nel sistema nervoso centrale, principalmente di tipo regolatorio dove eccita alcuni neuroni e ne inibisce altri; la sua sintesi e il rilascio è finemente gestita sia da stimoli nervosi sia da sistemi di regolazione, quale ad esempio il sistema autoinibitorio presinaptico che determina inibizione del rilascio di neurotrasmettitori dalle terminazioni nervose.
Oltre a questo, la serotonina è coinvolta nel metabolismo osseo,[8] nello sviluppo e riparazione degli organi come fegato[9] e cuore,[10] regolazione della temperatura corporea, del ritmo cardiaco e respiratorio. La serotonina è un antagonista non competitivo del testosterone e dell'estradiolo perché eleva il cortisolo ed eleva i livelli di prolattina, con conseguente inibizione del fattore di rilascio delle gonadotropine. La serotonina costituisce il freno naturale del riflesso dell'eiaculazione e un basso livello di questo neurotrasmettitore è la causa costituzionale principale dell'eiaculazione precoce.
Sistema nervoso centrale
[modifica | modifica wikitesto]Nel sistema nervoso centrale, la serotonina svolge numerose funzioni che vanno dalla regolazione del tono dell'umore, del sonno, della temperatura corporea, della sessualità, all'empatia, funzioni cognitive, creatività e appetito. Alterazioni patologiche nella funzionalità dei circuiti della serotonina si crede siano coinvolte in numerosi disturbi neuropsichiatrici come emicrania, disturbo ossessivo-compulsivo, depressione e schizofrenia, ansia e disturbi dell'umore in genere, disturbi alimentari (fame nervosa e bulimia), eiaculazione precoce maschile e fibromialgia solo per citarne alcuni, anche se l'esatto modo in cui tali alterazioni siano coinvolte in queste patologie non è chiaro. La manipolazione dei circuiti cerebrali della serotonina è perciò al centro del meccanismo d'azione di numerosi psicofarmaci, soprattutto antidepressivi (come ad esempio gli antidepressivi SSRI come il Dropaxin, Prozac e Zoloft, antidepressivi triciclici e inibitori delle monoammino-ossidasi) e antipsicotici ma anche di alcune sostanze stupefacenti (come la cocaina, gli psichedelici, l’MDA e l'MDMA).
Serotonina e depressione
[modifica | modifica wikitesto]Negli anni la cultura popolare, con la risonanza dei media,[11] ha dipinto la carenza di serotonina come la responsabile della depressione e più in generale degli stati d'animo negativi, contribuendo a generare il mito dell' "ormone della felicità"[12] e di conseguenza delle happy pills, come vengono spesso definiti, soprattutto negli USA, alcuni antidepressivi.[13][14] Tuttavia tale teoria, nata a partire da studi a volte smentiti condotti a partire dagli anni '60, risulta essere una eccessiva semplificazione del reale ruolo di questo neurotrasmettitore nella genesi dei disturbi psichiatrici, tant'è che oggi la carenza di serotonina non è considerata una causa della depressione e questo concetto è ribadito anche nel manuale dell'Associazione Psichiatrica Americana.[15]
Il legame tra carenza di serotonina e depressione nasce da osservazioni sperimentali condotte a partire dagli anni '60, in particolare dallo studioso Joseph Schildkraut che nel 1965 pubblicò uno studio in cui sosteneva tale teoria.[16] Negli anni successivi altri studi sembravano confermare tale ipotesi, rilevando bassi livelli di metaboliti (prodotti di degradazione) della serotonina nel cervello di cavie rese depresse e nel fluido cerebrospinale di pazienti con ideazioni suicidarie. Ciò portò prove a conferma della "Ipotesi Monoaminergica" della depressione, che fece quindi orientare la ricerca farmacologica verso lo studio di composti in grado di riequilibrare sempre più selettivamente tali presunti "squilibri chimici".[14] Tuttavia a oggi numerosi studi hanno messo in discussione il legame tra carenza di serotonina e depressione, evidenziando che le ricerche che sembravano confermare tale teoria erano spesso condotte con errori metodologici e su campioni troppo ristretti di soggetti, e che l'efficacia del trattamento a base di farmaci che si ritiene in grado di elevare le concentrazioni di serotonina, come gli SSRI, non prova tale legame.[12][14]
In effetti, tentativi di indurre o ridurre la depressione tramite la manipolazione diretta dei livelli di serotonina hanno prodotto risultati contrastanti e non significativi. In uno studio, ad esempio, a un gruppo di pazienti depressi sono state somministrate alte dosi di triptofano, l'amminoacido essenziale precursore della serotonina, ma ciò non ha prodotto effetti sulla depressione.[17] L'esperimento opposto, la riduzione dei livelli di triptofano introdotto con la dieta, non è in grado di indurre depressione.[18] La drastica riduzione dei livelli di serotonina mediante l'uso di un inibitore della triptofano idrossilasi (l'enzima che produce serotonina), la p-cloro fenilalanina, ha indotto una ricaduta depressiva solo nel 30% dei pazienti già depressi e in trattamento con un antidepressivo serotoninergico, non inducendo particolari effetti sull'umore nei pazienti sani.[19][20] Allo stato attuale la ricerca non ha individuato alcuna lesione nei nuclei che producono serotonina né una reale carenza di tale neurotrasmettitore nel cervello dei pazienti depressi,[12] i sempre maggiori studi che evidenziano la complessità e la scarsa comprensione attuale dei meccanismi di funzionamento del cervello suggeriscono che una teoria a "singolo neurotrasmettitore" della depressione è irrealistica.[21]
Tutt'al più, la possibile diminuzione dei livelli di serotonina potrebbe essere un effetto secondario ad altre alterazioni biochimiche che si possono verificare nel corso di un disturbo depressivo.[22][23] Ad esempio degli studi hanno evidenziato che gli antidepressivi, secondariamente all'alterazione dei livelli di serotonina che inducono, vanno ad attivare dei meccanismi biologici (quali il rilascio di fattori neurotrofici, attivazione di metabolismi anti-infiammatori, desensibilizzazione dei recettori delle monoammine, alterazione dell'espressione genica con induzione o repressione di particolari geni) che si ritiene possano essere i responsabili degli effetti terapeutici.[24]
I tentativi di manipolazione della serotonina nel sistema nervoso centrale mediante l’alimentazione non producono risultati significativi sui livelli percepiti di benessere e umore.
Comportamento sessuale
[modifica | modifica wikitesto]La serotonina influenza direttamente e indirettamente il comportamento sessuale. Lo fa sia perché circuiti della serotonina sono direttamente implicati nella percezione dei sentimenti di empatia e legame emotivo (che si crede siano indotti da un aumento della quantità di questo neurotrasmettitore in particolari neuroni e che porta tra l’altro al rilascio di ossitocina) sia perché i circuiti della serotonina sono in grado di regolare indirettamente l’attività di altri neurotrasmettitori implicati nella percezione del desiderio sessuale, ad esempio della dopamina (in questo caso un aumento dei livelli di serotonina causa un calo di quelli di dopamina, nonché altri effetti sul sistema nervoso centrale, che generalmente comportano una diminuzione della libido). È per questo che molti farmaci antidepressivi, che agiscono direttamente sui circuiti della serotonina, sono in grado di influenzare pesantemente il comportamento sessuale, causando in taluni casi disfunzioni sessuali anche di lungo periodo[25].
Riguardo all'influenza della serotonina sulla sfera sessuale, uno studio pubblicato sulla rivista Nature nel 2011 ha dimostrato che topi maschi geneticamente privati delle cellule cerebrali adibite alla sintesi della serotonina sviluppano un eguale interesse sessuale nei confronti di topi maschi e femmine, tentando nel 50% dei casi di accoppiarsi prima con i maschi e successivamente con le femmine. Se si inietta in questi topi maschi un precursore della serotonina, dopo mezz'ora ritornano ad accoppiarsi con topi di sesso femminile in via prioritaria.[26] La tesi controversa[27] è che, almeno negli animali, il deficit di serotonina è il principale fattore della preferenza omosessuale. Viceversa, anche nei topi si è visto che l'eccesso di serotonina non conduce alla scelta del sesso opposto, ma ad una situazione di indifferenza verso qualsiasi attività sessuale. Pure nell'uomo è noto questo fenomeno di calo della libido e di qualsiasi desiderio e aspirazione in genere, ad esempio, fra gli effetti collaterali noti dei farmaci antidepressivi.
Effetti farmacologici
[modifica | modifica wikitesto]La serotonina espleta i suoi effetti farmacologici attraverso due diverse vie:
- Legandosi a degli appositi recettori (interruttori chimici) disposti sulla superficie cellulare, la cui attivazione dà luogo al rilascio di messaggeri chimici secondari che sono i responsabili dell'azione biologica della serotonina. Sono stati identificati 14 diversi recettori per la serotonina negli esseri umani, accoppiati sia a canali ionici sia a proteine G.[28]
- Per serotonilazione, cioè l'alterazione della conformazione di proteine indotta dal legame a esse della serotonina e che va ad attivare diverse risposte biologiche. La secrezione di insulina[29] o la contrazione muscolare[30] indotte dalla serotonina sono un esempio di risposte biologiche dovute alla serotonilazione.
Terminata la sua azione biologica, la serotonina può o venire trasportata dal flusso ematico o essere riassorbita dalle cellule che l'hanno rilasciata mediante un sistema di trasporto attivo (reuptake della serotonina) per venire quindi conservata all'interno delle cellule o degradata da appositi enzimi. Nel sistema nervoso centrale, il 90% della serotonina viene recuperata tramite questo sistema, mentre solo il 10% va dispersa. I trasportatori della serotonina scoperti finora sono due: il SerT (Serotonin Transporter) che per lungo tempo è stato creduto essere l'unica proteina trasportatrice di membrana per la serotonina e che è il target farmacologico di diversi farmaci (antidepressivi SSRI, TCA) o sostanze d'abuso (cocaina, MDMA) e il solo recentemente scoperto trasportatore per le monoamine a bassa affinità (PMAT).[31]
Recettori della serotonina
[modifica | modifica wikitesto]I recettori per la serotonina si ritrovano nel sistema nervoso centrale e periferico, sulla membrana cellulare delle cellule nervose e in altri tipi di cellule. I recettori della serotonina influenzano vari processi biologici e neurologici, come l'aggressività, ansia, appetito, conoscenza, apprendimento, memoria, umore, nausea, sonno e termoregolazione. I recettori della serotonina sono il bersaglio di una varietà di farmaci e sostanze stupefacenti tra cui molti antidepressivi (inibitori trasportatore della serotonina e agonisti\antagonisti vari recettori), antipsicotici (antagonisti recettori 5HT2A-C), anoressizzanti e allucinogeni (agonisti 5HT2A).
| Recettore | Ki(nM) | Funzione ed effetto degli agonisti\antagonisti |
|---|---|---|
| Famiglia 5-HT1 accoppiata a Gi/o e che induce inibizione dell'adenilato ciclasi. | ||
| 5-HT1A | 3.17 | Memoria (agonista ↓); apprendimento (agonista ↓); ansia (agonista ↓); depressione (agonista ↓); sintomi della schizofrenia (agonista parziale ↓); analgesia (agonista ↑); aggressività (agonista ↓); rilascio di dopamina nella corteccia frontale (agonista ↑); sintesi e rilascio di serotonina (agonista ↓); rilascio di ossitocina e altri ormoni (agonista ↑) |
| 5-HT1B | 4.32 | Vasocostrizione (agonista ↑); aggressività (agonista ↓); massa ossea (↓). sintesi e rilascio di serotonina |
| 5-HT1D | 5.03 | Vasocostrizione (agonista ↑) |
| 5-HT1E | 7.53 | |
| 5-HT1F | 10 | |
| Famiglia 5-HT2 accoppiata a Gq e che attiva fosfolipasi C | ||
| 5-HT2A | 11.55 | Effetto psichedelico(agonista ↑); depressione (agonista ↑ & antagonista ↓); ansia (antagonista↓); sintomi della schizofrenia (antagonista ↓); rilascio di norepinefrina dal locus coeruleus (antagonista ↓); rilascio di glutammato dalla corteccia prefrontale (agonista ↑); uresi (agonista ↑) |
| 5-HT2B | 8.71 | Funzione cardiovascolare (gli agonisti aumentano il rischio di ipertensione polmonare e valvulopatia), empatia (attraverso i neuroni del fuso e di Von Economo) |
| 5-HT2C | 5.02 | Rilascio di dopamina nelle vie mesocorticolimbiche (agonisti ↓); rilascio di acetilcolina nella corteccia prefrontale (agonisti ↑); appetite (agonisti ↓); effetti antipsicotici (agonisti ↑); effetti antidepressivi (agonisti & antagonisti ↑) |
| Altri recettori | ||
| 5-HT3 | 593 | Emesi (agonisti ↑); ansiolisi (antagonisti ↑). |
| 5-HT4 | 125.89 | Peristalsi intestinale (agonisti ↑); Memoria e apprendimento (agonisti ↑); effetti antidepressivi (agonists ↑). Signalling via Gαs con attivazione dell'adenilato ciclasi. |
| 5-HT5A | 251.2 | Consolidamento della memoria. Signallin via Gi/o con inibizione dell'adenilato ciclasi. |
| 5-HT6 | 98.41 | Cognizione (antagonisti ↑); effetti antidepressivi (agonisti & antagonisti ↑); effetto ansiolitico (antagonisti ↑). Signallin via Gs con attivazione dell'adenilato ciclasi. |
| 5-HT7 | 8.11 | Cognizione (antagonisti ↑); effetti antidepressivi (antagonisti ↑). Signallin via Gs con attivazione dell'adenilato ciclasi. |
Farmaci che agiscono sui recettori serotoninergici
[modifica | modifica wikitesto]- Agonisti del recettore 5-HT1D (sumatriptan). Sono utilizzati per il trattamento dell'emicrania.
- Antagonisti del recettore 5-HT3 (ondasetron). Sono utilizzati come farmaci antiemetici, in particolare per controllare la grave nausea e il vomito provocati da molti tipi di chemioterapia antitumorale.
- Antagonisti del recettore 5-HT2 (metisergide). Bloccano anche altri recettori 5-HT, così come i recettori -adrenergici e istamminergici. Vengono utilizzati per la profilassi dell'emicrania.
- Agonisti del recettore 5-HT4 (metoclopramide). Stimolano l'attività peristaltica coordinata.
- Antagonisti del recettore 5-HT7 (amisulpride): antidepressivo.
Alcaloidi dell'ergot
[modifica | modifica wikitesto]Gli alcaloidi dell'ergot sono prodotti da un fungo (Claviceps purpurea) che infesta i raccolti di cereali. I sintomi dell'avvelenamento sono costituiti principalmente da disturbi mentali e da un'intensa e dolorosa vasocostrizione periferica che determina gangrena. Gli alcaloidi dell'ergot sono molecole complesse la cui struttura base è l'acido lisergico (un alcaloide tetraciclico naturale).
Azioni
[modifica | modifica wikitesto]Gli effetti degli alcaloidi dell'ergot sembrano mediati prevalentemente da recettori 5-HT, glutammaergici, adrenergici o dopamminergici. Tutti gli alcaloidi dell'ergot determinano stimolazione della muscolatura liscia. I principali effetti farmacologici sono i seguenti.
- Effetti vascolari. L'ergotammina causa un forte aumento della pressione sanguigna, dovuto all'attivazione dei recettori α-adrenergici con conseguente vasocostrizione. Allo stesso tempo, l'ergotammina antagonizza l'effetto pressorio dell'adrenalina.
Uso clinico
[modifica | modifica wikitesto]L'unico impiego clinico dell'ergotammina è nel trattamento degli attacchi di emicrania che non rispondono a semplici analgesici.
Note
[modifica | modifica wikitesto]Annotazioni
[modifica | modifica wikitesto]Bibliografiche
[modifica | modifica wikitesto]- ^ Sigma Aldrich; rev. del 26.04.2012 riferita al cloridrato
- ^ (EN) Kiyoon Kang, Sangkyu Park e Young Soon Kim, Biosynthesis and biotechnological production of serotonin derivatives, in Applied Microbiology and Biotechnology, vol. 83, n. 1, 1º maggio 2009, pp. 27–34, DOI:10.1007/s00253-009-1956-1. URL consultato il 13 agosto 2017.
- ^ (EN) Jessica M. Yano, Kristie Yu e Gregory P. Donaldson, Indigenous Bacteria from the Gut Microbiota Regulate Host Serotonin Biosynthesis, in Cell, vol. 161, n. 2, 9 aprile 2015, pp. 264–276, DOI:10.1016/j.cell.2015.02.047. URL consultato il 13 agosto 2017.
- ^ Miles Berger, John A. Gray e Bryan L. Roth, The Expanded Biology of Serotonin, in Annual Review of Medicine, vol. 60, n. 1, 1º febbraio 2009, pp. 355–366, DOI:10.1146/annurev.med.60.042307.110802. URL consultato il 13 agosto 2017.
- ^ Derek A. Mann e Fiona Oakley, Serotonin paracrine signaling in tissue fibrosis, in Biochimica et Biophysica Acta, vol. 1832, n. 7, 2013-7, pp. 905–910, DOI:10.1016/j.bbadis.2012.09.009. URL consultato il 13 agosto 2017.
- ^ Paul W. Andrews, Aadil Bharwani e Kyuwon R. Lee, Is serotonin an upper or a downer? The evolution of the serotonergic system and its role in depression and the antidepressant response, in Neuroscience & Biobehavioral Reviews, vol. 51, pp. 164–188, DOI:10.1016/j.neubiorev.2015.01.018. URL consultato il 13 agosto 2017.
- ^ Elizabeth A. Daubert e Barry G. Condron, Serotonin: a regulator of neuronal morphology and circuitry, in Trends in neurosciences, vol. 33, n. 9, 2010-9, pp. 424–434, DOI:10.1016/j.tins.2010.05.005. URL consultato il 13 agosto 2017.
- ^ Clifford J Rosen, Breaking into bone biology: serotonin's secrets, in Nature Medicine, vol. 15, n. 2, pp. 145–146, DOI:10.1038/nm0209-145.
- ^ (EN) Ramadhan B. Matondo, Carine Punt e Judith Homberg, Deletion of the serotonin transporter in rats disturbs serotonin homeostasis without impairing liver regeneration, in American Journal of Physiology - Gastrointestinal and Liver Physiology, vol. 296, n. 4, 1º aprile 2009, pp. G963–G968, DOI:10.1152/ajpgi.90709.2008. URL consultato il 13 agosto 2017 (archiviato dall'url originale il 13 agosto 2017).
- ^ Marieb, Elaine Nicpon, 1936-, Essentials of human anatomy & physiology, 9th ed, Pearson/Benjamin Cummings, 2009, ISBN 0-321-51342-8, OCLC 174094368.
- ^ Nathan P. Greenslit e Ted J. Kaptchuk, Antidepressants and Advertising: Psychopharmaceuticals in Crisis, in The Yale Journal of Biology and Medicine, vol. 85, n. 1, 29 marzo 2012, pp. 153–158. URL consultato il 13 agosto 2017.
- ^ a b c Jeffrey R. Lacasse e Jonathan Leo, Serotonin and Depression: A Disconnect between the Advertisements and the Scientific Literature, in PLOS Medicine, vol. 2, n. 12, 8 novembre 2005, pp. e392, DOI:10.1371/journal.pmed.0020392. URL consultato il 1º novembre 2017.
- ^ Herzberg, David L. (David Lowell), Happy pills in America : from Miltown to Prozac, Johns Hopkins University Press, 2009, ISBN 978-0-8018-9814-3, OCLC 212399905.
- ^ a b c (EN) David Healy, Serotonin and depression, in BMJ, vol. 350, 21 aprile 2015, pp. h1771, DOI:10.1136/bmj.h1771. URL consultato il 1º novembre 2017.
- ^ Jeffrey R Lacasse e Jonathan Leo, Serotonin and Depression: A Disconnect between the Advertisements and the Scientific Literature, in PLoS Medicine, vol. 2, n. 12, 2005-12, DOI:10.1371/journal.pmed.0020392. URL consultato il 13 agosto 2017.«However, in addition to what these authors say about serotonin, it is also important to look at what is not said in the scientific literature. To our knowledge, there is not a single peer-reviewed article that can be accurately cited to directly support claims of serotonin deficiency in any mental disorder, while there are many articles that present counterevidence. Furthermore, the Diagnostic and Statistical Manual of Mental Disorders (DSM), which is published by the American Psychiatric Association and contains the definitions of all psychiatric diagnoses, does not list serotonin as a cause of any mental disorder. The American Psychiatric Press Textbook of Clinical Psychiatry addresses serotonin deficiency as an unconfirmed hypothesis, stating, “Additional experience has not confirmed the monoamine depletion hypothesis”»
- ^ A. Coppen, The biochemistry of affective disorders, in The British Journal of Psychiatry: The Journal of Mental Science, vol. 113, n. 504, November 1967, pp. 1237–1264. URL consultato il 1º novembre 2017.
- ^ J. Mendels, J. L. Stinnett e D. Burns, Amine precursors and depression, in Archives of General Psychiatry, vol. 32, n. 1, January 1975, pp. 22–30. URL consultato il 1º novembre 2017.
- ^ K. A. Smith, C. G. Fairburn e P. J. Cowen, Relapse of depression after rapid depletion of tryptophan, in Lancet (London, England), vol. 349, n. 9056, 29 marzo 1997, pp. 915–919. URL consultato il 1º novembre 2017.
- ^ H. G. Ruhé, N. S. Mason e A. H. Schene, Mood is indirectly related to serotonin, norepinephrine and dopamine levels in humans: a meta-analysis of monoamine depletion studies, in Molecular Psychiatry, vol. 12, n. 4, April 2007, pp. 331–359, DOI:10.1038/sj.mp.4001949. URL consultato il 1º novembre 2017.
- ^ Philip J Cowen e Michael Browning, What has serotonin to do with depression?, in World Psychiatry, vol. 14, n. 2, 2015-6, pp. 158–160, DOI:10.1002/wps.20229. URL consultato il 1º novembre 2017.«The best evidence that serotonin plays a role in the pathophysiology of depression comes from studies of “tryptophan depletion”, where an acute dietary manipulation is employed to produce a transient lowering in brain serotonin activity through diminishing availability of its precursor amino acid, tryptophan. In healthy participants with no risk factors for depression, tryptophan depletion does not produce clinically significant changes in mood; however, recovered depressed patients free of medication can show brief, clinically relevant, depressive symptomatology (4). Interestingly, the same is true of recovered depressed patients undergoing catecholamine depletion with alpha-methyl-para-tyrosine (5).
Overall, this evidence suggests that impairing serotonin function can cause clinical depression in some circumstances, but is neither necessary nor sufficient. In addition, the depressogenic effects of tryptophan depletion are much more apparent in people who have experienced prior episodes of depression than in those simply at high risk of illness, for example by virtue of a strong family history (6). This suggests that low serotonin function may compromise mechanisms involved in maintaining recovery from depression rather than having a primary effect to lower mood in all vulnerable people.
These findings also hint at a role for diminished tryptophan availability in triggering depression, particularly in people with a previous history of illness. Interestingly, lower plasma levels of tryptophan are one of the few reasonably robust findings in patients with more severe forms of depression (7) and, more recently, have been linked to peripheral inflammation and consequent induction of the tryptophan metabolizing enzyme indoleamine 2,3-dioxygenase (8). Inflammation could therefore produce depression in vulnerable individuals by lowering plasma tryptophan and diminishing brain serotonin activity. Conceivably, such an effect could explain the diminished efficacy of SSRIs in depressed patients with high levels of inflammatory biomarkers.» - ^ Philip J Cowen e Michael Browning, What has serotonin to do with depression?, in World Psychiatry, vol. 14, n. 2, 2015-6, pp. 158–160, DOI:10.1002/wps.20229. URL consultato il 1º novembre 2017.«In biological psychiatry, pathophysiological hypotheses are not easily refuted. More often they simply seem to become irrelevant as new models of causation take their place. In an era of neural networks and systems level neuroscience, “single” neurotransmitter theories of depression look increasingly implausible. Is serotonin still worth thinking about in relation to depression?»
- ^ (EN) H. G. Ruhé, N. S. Mason e A. H. Schene, Mood is indirectly related to serotonin, norepinephrine and dopamine levels in humans: a meta-analysis of monoamine depletion studies, in Molecular Psychiatry, vol. 12, n. 4, 16 gennaio 2007, pp. 331–359, DOI:10.1038/sj.mp.4001949. URL consultato il 13 agosto 2017.
- ^ (EN) Jeanene Swanson, Unraveling the Mystery of How Antidepression Drugs Work, in Scientific American. URL consultato il 13 agosto 2017.«In fact, SSRIs fail to work for mild cases of depression, suggesting that regulating serotonin might be an indirect treatment only. “There’s really no evidence that depression is a serotonin-deficiency syndrome,” says Alan Gelenberg, a depression and psychiatric researcher at The Pennsylvania State University. “It’s like saying that a headache is an aspirin-deficiency syndrome.” SSRIs work insofar as they reduce the symptoms of depression, but “they’re pretty nonspecific,” he adds. Now, research headed up by neuroscientists David Gurwitz and Noam Shomron of Tel Aviv University in Israel supports recent thinking that rather than a shortage of serotonin, a lack of synaptogenesis (the growth of new synapses, or nerve contacts) and neurogenesis (the generation and migration of new neurons) could cause depression. In this model lower serotonin levels would merely result when cells stopped making new connections among neurons or the brain stopped making new neurons. So, directly treating the cause of this diminished neuronal activity could prove to be a more effective therapy for depression than simply relying on drugs to increase serotonin levels.»
- ^ Chirisse Taylor, Ashwana D. Fricker e Lakshmi A. Devi, Mechanisms of action of antidepressants: from neurotransmitter systems to signaling pathways, in Cellular signalling, vol. 17, n. 5, 2005-5, pp. 549–557, DOI:10.1016/j.cellsig.2004.12.007. URL consultato il 1º novembre 2017.
- ^ Rachele Mazzaracca, Disfunzione sessuale post-SSRI: quando gli antidepressivi lasciano il segno, su Osservatorio Malattie Rare. URL consultato il 13 agosto 2020.
- ^ Natura & Matematica: Serotonina: dal buonumore ai gusti sessuali?
- ^ One neurotransmitter to rule sexual preference?, su neurorexia.com. URL consultato il 14 febbraio 2014 (archiviato dall'url originale il 23 febbraio 2014).
- ^ David E. Nichols e Charles D. Nichols, Serotonin Receptors, in Chemical Reviews, vol. 108, n. 5, 1º maggio 2008, pp. 1614–1641, DOI:10.1021/cr078224o. URL consultato il 13 agosto 2017.
- ^ Nils Paulmann, Maik Grohmann e Jörg-Peter Voigt, Intracellular Serotonin Modulates Insulin Secretion from Pancreatic β-Cells by Protein Serotonylation, in PLoS Biology, vol. 7, n. 10, 27 ottobre 2009, DOI:10.1371/journal.pbio.1000229. URL consultato il 1º novembre 2017.
- ^ Stephanie W. Watts, Jessica R. C. Priestley e Janice M. Thompson, Serotonylation of Vascular Proteins Important to Contraction, in PLoS ONE, vol. 4, n. 5, 25 maggio 2009, DOI:10.1371/journal.pone.0005682. URL consultato il 1º novembre 2017.
- ^ Mingyan Zhou, Karen Engel e Joanne Wang, Evidence for Significant Contribution of a Newly Identified Monoamine Transporter (PMAT) to Serotonin Uptake in the Human Brain, in Biochemical pharmacology, vol. 73, n. 1, 1º gennaio 2007, pp. 147–154, DOI:10.1016/j.bcp.2006.09.008. URL consultato il 1º novembre 2017.
Altri progetti
[modifica | modifica wikitesto] Wikiquote contiene citazioni di o su serotonina
Wikiquote contiene citazioni di o su serotonina Wikizionario contiene il lemma di dizionario «serotonina»
Wikizionario contiene il lemma di dizionario «serotonina» Wikimedia Commons contiene immagini o altri file su serotonina
Wikimedia Commons contiene immagini o altri file su serotonina
Collegamenti esterni
[modifica | modifica wikitesto]- serotonina, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- A. E. R. e G., SEROTONINA, in Enciclopedia Italiana, III Appendice, Istituto dell'Enciclopedia Italiana, 1961.
- serotonìna, su sapere.it, De Agostini.
- (EN) serotonin, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- (EN) Serotonina, su StarTrek.com, CBS Studios.
- Serotonina - mypersonaltrainer.it
- Serotonin: 9 Questions and Answers - in webmd.com
- Serotonina, dal buonumore ai gusti
| Controllo di autorità | Thesaurus BNCF 22001 · LCCN (EN) sh85120301 · GND (DE) 4054614-7 · BNF (FR) cb11973615q (data) · J9U (EN, HE) 987007533900405171 · NDL (EN, JA) 00570824 |
|---|










