Indice
Fenolo
| Fenolo | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| fenolo | |
| Abbreviazioni | |
| Ph-OH | |
| Nomi alternativi | |
| acido fenico acido carbolico benzenolo idrossibenzene | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C6H6O |
| Massa molecolare (u) | 94,11 |
| Aspetto | cristallini aghiformi incolori |
| Numero CAS | |
| Numero EINECS | 203-632-7 |
| PubChem | 996 e 20488062 |
| DrugBank | DBDB03255 |
| SMILES | C1=CC=C(C=C1)O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,06 |
| Costante di dissociazione acida a 293 K | 1,29×10−10 |
| Solubilità in acqua | 84 g/l a 293 K |
| Temperatura di fusione | 40,8 °C (313,9 K) |
| Temperatura di ebollizione | 181,8 °C (454,9 K) |
| Tensione di vapore (Pa) a 323 K | 350 |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −165,1 |
| S0m(J·K−1mol−1) | 144 |
| C0p,m(J·K−1mol−1) | 127,4 |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | 530 mg/kg ratto (os) |
| Indicazioni di sicurezza | |
| Punto di fiamma | 81 °C (354 K) |
| Limiti di esplosione | 1,3 - 9,5% vol. |
| Temperatura di autoignizione | 595 °C (868 K) |
| Simboli di rischio chimico | |
  
| |
| pericolo | |
| Frasi H | 301 - 311 - 314 - 331 - 341 - 373 |
| Consigli P | 280 - 302+352 - 301+330+331 - 305+351+338 - 309+310 [1] |
Il fenolo è un composto aromatico derivato dal benzene recante un gruppo ossidrile (-OH) direttamente legato all'anello benzenico. Tale composto appartiene alla classe dei fenoli, che raggruppa i composti che presentano uno o più ossidrili legati ad un anello aromatico.
La sua formula chimica è C6H5OH. Non lo si deve confondere con l'alcol benzilico (C6H5CH2OH).
Caratteristiche
[modifica | modifica wikitesto]
Puro, si presenta sotto forma di cristalli bianchi, che per via dell'ossidazione dovuta all'ossigeno dell'aria tendono col tempo ad assumere una colorazione gialla o rosa. Si scioglie bene in acqua (84 g/l) ed ancora meglio in etanolo e in cloroformio.
Una sua soluzione di 50 g/l in acqua ha un pH circa 5. È un acido molto debole, la sua costante di dissociazione acida a 20 °C è 1,29×10−10.
Benché posseggano un gruppo ossidrile (-OH), i fenoli non si comportano come gli alcoli. I fenoli infatti sono più acidi degli alcoli, perché la carica negativa dell'anione (fenossido) che si forma per dissociazione dell'idrogeno del gruppo ossidrile viene stabilizzata per risonanza, che disperde la carica elettrica su tutto l'anello aromatico. Il gruppo -OH viene solitamente deprotonato mediante l'utilizzo di basi forti quali gli idrossidi dei metalli del primo e del secondo gruppo (principalmente NaOH e KOH).
Reattività
[modifica | modifica wikitesto]Dal punto di vista della reattività chimica, il fenolo subisce molto facilmente reazioni di sostituzione elettrofila aromatica nelle posizioni para e orto (il gruppo -OH come sostituente sul benzene si definisce infatti un gruppo attivante in quanto rende l'anello più reattivo di quello del benzene e orto-para orientante).
Saggi
[modifica | modifica wikitesto]Il fenolo in soluzione acquosa è identificato per aggiunta di poche gocce di cloruro ferrico; si ottiene colorazione blu.
Produzione
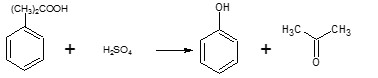
[modifica | modifica wikitesto]Industrialmente il fenolo viene principalmente sintetizzato sfruttando il processo al cumene. Il fenolo è preparato per scissione, detta disproporzione, in ambiente acido per acido solforico (100 ppm) dell'idroperossido di cumene (CHP),[2] prodotto molto instabile (termolabile) che si ottiene per ossidazione con aria compressa in ambiente basico dell'isopropilbenzene (cumene), processo da cui si ottiene anche l'acetone e l'acetofenone, sostanza usata in cosmesi. Un'altra via per la produzione del fenolo è la fusione alcalina.
Il cumene può essere ottenuto semplicemente e soprattutto economicamente per alchilazione del benzene.
Il cumene è un idrocarburo instabile che reagisce rapidamente con l'ossigeno atmosferico ossidandosi ad idroperossido di cumene. Questo tipo di ossidazione è resa facile dal fatto che l'intermedio radicalico principale è un radicale cumile non solo terziario ma anche benzilico, quindi estremamente stabile.
L'idroperossido può quindi venir trattato con acido solforico per dare fenolo e acetone.
Utilizzi
[modifica | modifica wikitesto]Inizialmente noto come "acido fenico", fu sintetizzato nel 1860 ed inizialmente usato come deodorante e disinfettante per fogne.
Industria
[modifica | modifica wikitesto]Circa i due terzi della produzione del fenolo viene impiegata per produrre precursori della plastica.[3] L'idrogenazione parziale del fenolo produce il cicloesanone, un precursore del nylon.
Il fenolo è una materia prima molto comune nella produzione di coloranti, erbicidi, farmaci - uno dei più noti è l'aspirina - e di resine sintetiche. Una delle prime è stata la bachelite, ottenuta per polimerizzazione del fenolo con la formaldeide.
Il fenolo viene impiegato come reagente nell'industria chimica principalmente per la produzione di bisfenolo A, resine fenoliche e caprolattame.[4]
Il fenolo è un componente degli sverniciatori industriali utilizzati nell'industria aeronautica per la rimozione di rivestimenti epossidici, poliuretanici e altri rivestimenti chimici resistenti.
Medicina
[modifica | modifica wikitesto]Il fenolo è stato ampiamente usato come antisettico; il suo uso è stato introdotto nel 1865 dal medico scozzese Lister, professore di chirurgia a Glasgow, come antisettico su una frattura esposta,[5] ma già sperimentato dal medico Enrico Bottini nel 1862 nel reparto di chirurgia dell'Ospedale Maggiore di Novara[6]. Nacque così la pratica dell'antisepsi in chirurgia, seguita successivamente dalla pratica dell'asepsi. Il fenolo agisce sulla cellula batterica, facendo precipitare la componente proteica della parete, causandone la distruzione. In pratica il fenolo danneggia fisicamente la parete cellulare, alterandone la permeabilità in modo letale.
Il fenolo venne sistematicamente ed abbondantemente usato nella disinfezione delle sale operatorie, degli strumenti chirurgici, delle mani e dei camici dei sanitari, al punto che le corsie degli ospedali presero il caratteristico e pungente odore di fenolo. Dai primi del '900 agli anni '70 è stato utilizzato nella produzione di sapone carbolico.
Solo negli ultimi anni il fenolo è stato utilizzato nell'intervento chirurgico ambulatoriale detto laminectomia laterale per fenolizzazione, che distrugge la matrice laterale delle unghie dell'alluce per evitare il ripresentarsi dell'unghia incarnita. Il fenolo è anche usato come conservante in alcuni vaccini.[7]
Lo spray fenolo, contenente l'1,4% di fenolo come principio attivo, viene utilizzato in medicina per alleviare il mal di gola.[8] Il fenolo è anche il principio attivo di alcuni analgesici orali usati per trattare la faringite a livello sintomatico.[9]
Cosmesi
[modifica | modifica wikitesto]La capacità delle soluzioni acquose ad alta concentrazione di fenolo di causare bruciature alla pelle è sfruttata in cosmetica nella produzione di preparati capaci di rimuovere gli strati superficiali della pelle. I derivati del fenolo sono utilizzati nella preparazione di cosmetici, inclusi filtri solari,[10] coloranti per capelli, preparati per schiarire la pelle, ed esfolianti.[11]
Tuttavia, a causa di problemi di sicurezza, l'uso del fenolo è vietato nei prodotti cosmetici nell'Unione europea[12] e in Canada.[13]
Tossicità
[modifica | modifica wikitesto]Il fenolo e i suoi vapori sono corrosivi per gli occhi, la pelle e il tratto respiratorio.[14] L'effetto corrosivo sulla pelle e sulle mucose è dovuto alla sua capacità di reagire con le proteine.[3] Il contatto ripetuto o prolungato della pelle con il fenolo può causare dermatiti o ustioni di secondo e terzo grado.[15] L'inalazione di vapori di fenolo può causare edema polmonare.[14] Inoltre può provocare effetti nocivi sul sistema nervoso centrale e sul cuore, causando aritmia, convulsioni e coma.[16] L'esposizione ripetuta al fenolo può avere effetti nocivi anche sul fegato e sui reni.[17] Non ci sono prove che il fenolo provochi il cancro negli esseri umani.[18] La tossicità del fenolo può essere dovuta anche alla formazione di radicali fenossilici.[19]
Poiché il fenolo viene assorbito dalla pelle in tempi relativamente brevi, oltre alle ustioni può verificarsi un avvelenamento sistemico.[3] L'avvelenamento porta rapidamente alla paralisi del sistema nervoso centrale e a un massiccio calo della temperatura corporea. Il LD50 per la tossicità orale è inferiore a 500 mg/kg per cani, conigli e topi; mentre la dose umana letale minima è 140 mg/kg.[3] La dose fatale per l'ingestione è compresa tra 1 e 32 g.[18]
Le ustioni chimiche sulla pelle possono essere decontaminate mediante lavaggio con polietilenglicole,[20] alcol isopropilico,[21] o anche abbondante acqua.[22] È richiesta la rimozione degli indumenti contaminati, e un ricovero ospedaliero immediato per ustioni di grandi dimensioni.
Il fenolo causa un aumento del rischio di aborto e un basso peso alla nascita, indice di un ritardo dello sviluppo in utero.[23]
Composti
[modifica | modifica wikitesto]La parola fenolo è usata per riferirsi a qualsiasi composto che contiene un anello aromatico a sei membri, legato direttamente a un gruppo ossidrilico (-OH). Quindi, i fenoli sono una classe di composti organici di cui il fenolo è il membro più semplice.
Il fenolo può reagire come acido ed essere convertito nei rispettivi sali, i "fenati".
Il fenolo può reagire come un alcol e formare, con gli acidi carbossilici, i corrispondenti esteri.
Storia
[modifica | modifica wikitesto]Il fenolo fu scoperto nel 1834 da Friedlieb Ferdinand Runge, che lo estrasse (in forma impura) dal catrame di carbone. Runge chiamò il fenolo "Karbolsäure" (acido carbolico). Il catrame di carbone è rimasto la fonte primaria fino allo sviluppo dell'industria petrolchimica.
Nel 1841, il chimico francese Auguste Laurent ottenne il fenolo in forma pura.[24] Nel 1836 Auguste Laurent coniò il nome "phène" per il benzene; questa è la radice della parola "fenolo" e "fenile". Nel 1843, il chimico francese Charles Gerhardt coniò il nome "fenolo".[25]
Le proprietà antisettiche del fenolo furono usate da Sir Joseph Lister (1827-1912) nella sua tecnica pionieristica di chirurgia antisettica.[5] Lister ipotizzo che per evitare le infezioni le ferite dovessero essere pulite a fondo. Inizialmente utilizzò garze imbevute di fenolo, che risultavano però irritanti per le ferite.[26] Nacque così la pratica dell'antisepsi in chirurgia, seguita successivamente dalla pratica dell'asepsi.
Il fenolo venne utilizzato anche come composto per eseguire condanne a morte.[27] In particolare, il fenolo è stato utilizzato nello sterminio nazista durante la seconda guerra mondiale.[28] Iniezioni di fenolo sono state somministrate a migliaia di persone nei campi di concentramento, specialmente a Auschwitz. L'esecuzione delle iniezioni veniva effettuata da medici e dai loro assistenti; inizialmente il fenolo era introdotto per endovena, solitamente nel braccio, ma successivamente le iniezioni vennero eseguite direttamente nel cuore della vittima in modo da provocare una morte più rapida e quasi istantanea, entro 15 secondi. Questo sistema venne introdotto nelle fasi iniziali, a partire dal 1941 in Auschwitz, dove dalle 30 alle 60 persone vennero uccise ogni giorno con questa modalità. Uno dei più famosi prigionieri di Auschwitz ad essere ucciso con una iniezione di fenolo è stato Massimiliano Maria Kolbe, un frate francescano che volontariamente si sottopose a tre settimane di fame e disidratazione al posto di un altro prigioniero. Fu quindi ucciso dai nazisti in modo da fare più posto nella cella di isolamento,[27] e per questo dichiarato poi santo da papa Giovanni Paolo II nel 1982. Oltre a padre Kolbe si ricorda anche l'uccisione nel campo di concentramento di Dachau, tramite iniezione di fenolo, di padre Tito Brandsma, presbitero olandese, fervente oppositore del regime nazionalsocialista. Padre Brandsma è stato dichiarato beato da papa Giovanni Paolo II nel 1985 e canonizzato nel 2022 da papa Francesco.
L'utilizzo dell'acido fenico sulle mani è una delle possibili spiegazioni scientifiche al fenomeno delle stigmate, come supposto da Sergio Luzzatto nella sua biografia di Padre Pio[29].
Note
[modifica | modifica wikitesto]- ^ scheda del fenolo su IFA-GESTIS
- ^ Zoller, pp. 63-64.
- ^ a b c d (EN) Ullmann's Encyclopedia of Industrial Chemistry, 1ª ed., Wiley, 15 giugno 2000, DOI:10.1002/14356007, ISBN 978-3-527-30385-4. URL consultato il 10 settembre 2020.
- ^ Zoller, p. 65.
- ^ a b Internet History Sourcebooks, su sourcebooks.fordham.edu. URL consultato il 10 settembre 2020.
- ^ L'Aula magna dell'AOU intitolata ad Enrico Bottini, su Maggiore Informazione, 16 aprile 2021. URL consultato il 20 novembre 2021.
- ^ (EN) Vaccines: Vac-Gen/Additives in Vaccines Fact Sheet, su cdc.gov, 2 settembre 2020. URL consultato il 10 settembre 2020.
- ^ (EN) Phenol Oral Spray and Rinse Information, su Drugs.com. URL consultato il 10 settembre 2020.
- ^ How Does Our Lip Balm Work? Secrets Revealed! | Carmex, su web.archive.org, 18 febbraio 2015. URL consultato il 10 settembre 2020 (archiviato dall'url originale il 18 febbraio 2015).
- ^ (EN) Alena Svobodová, Jitka Psotová e Daniela Walterová, Natural phenolics in the prevention of UV-induced skin damage. A review, in Biomedical Papers, vol. 147, n. 2, 1º dicembre 2003, pp. 137–145, DOI:10.5507/bp.2003.019. URL consultato il 10 settembre 2020.
- ^ Bunleu Sungthong e Methin Phadungkit, Anti-Tyrosinase and DPPH Radical Scavenging Activities of Selected Thai Herbal Extracts Traditionally Used as Skin Toner, in Pharmacognosy Journal, vol. 7, n. 2, 24 gennaio 2015, pp. 97–101, DOI:10.5530/pj.2015.2.3. URL consultato il 10 settembre 2020.
- ^ CosIng - Cosmetics - GROWTH - European Commission, su ec.europa.eu. URL consultato il 10 settembre 2020.
- ^ Health Canada, Cosmetic Ingredient Hotlist, su aem, 18 giugno 2004. URL consultato il 10 settembre 2020.
- ^ a b O'Neil, Maryadele J., e Royal Society of Chemistry (Great Britain), The Merck index : an encyclopedia of chemicals, drugs, and biologicals., Fifteenth edition, ISBN 978-1-84973-670-1, OCLC 824530529. URL consultato il 10 settembre 2020.
- ^ Tsai-Ming Lin, Su-Shin Lee e Chung-Sheng Lai, Phenol burn, in Burns: Journal of the International Society for Burn Injuries, vol. 32, n. 4, 2006-06, pp. 517–521, DOI:10.1016/j.burns.2005.12.016. URL consultato il 10 settembre 2020.
- ^ M. A. Warner e J. V. Harper, Cardiac dysrhythmias associated with chemical peeling with phenol, in Anesthesiology, vol. 62, n. 3, 1985-03, pp. 366–367, DOI:10.1097/00000542-198503000-00030. URL consultato il 10 settembre 2020.
- ^ ICSC 0070 - PHENOL, su inchem.org. URL consultato il 10 settembre 2020.
- ^ a b ATSDR - ToxFAQs™: Phenol, su atsdr.cdc.gov. URL consultato il 10 settembre 2020.
- ^ C. Hansch, S. C. McKarns e C. J. Smith, Comparative QSAR evidence for a free-radical mechanism of phenol-induced toxicity, in Chemico-Biological Interactions, vol. 127, n. 1, 15 giugno 2000, pp. 61–72, DOI:10.1016/s0009-2797(00)00171-x. URL consultato il 10 settembre 2020.
- ^ V. K. Brown, V. L. Box e B. J. Simpson, Decontamination procedures for skin exposed to phenolic substances, in Archives of Environmental Health, vol. 30, n. 1, 1975-01, pp. 1–6, DOI:10.1080/00039896.1975.10666623. URL consultato il 10 settembre 2020.
- ^ D. M. Hunter, B. L. Timerding e R. B. Leonard, Effects of isopropyl alcohol, ethanol, and polyethylene glycol/industrial methylated spirits in the treatment of acute phenol burns, in Annals of Emergency Medicine, vol. 21, n. 11, 1992-11, pp. 1303–1307, DOI:10.1016/s0196-0644(05)81891-8. URL consultato il 10 settembre 2020.
- ^ T. G. Pullin, M. N. Pinkerton e R. V. Johnston, Decontamination of the skin of swine following phenol exposure: a comparison of the relative efficacy of water versus polyethylene glycol/industrial methylated spirits, in Toxicology and Applied Pharmacology, vol. 43, n. 1, 1978-01, pp. 199–206, DOI:10.1016/s0041-008x(78)80044-1. URL consultato il 10 settembre 2020.
- ^ (EN) PubChem, Phenol, su pubchem.ncbi.nlm.nih.gov. URL consultato il 10 settembre 2020.
- ^ Annales de chimie et de physique, su Gallica, 1841, pp. 195-234. URL consultato il 22 gennaio 2023.
- ^ (EN) Annales de chimie et de physique. ser.3 v.7 1843., su HathiTrust. URL consultato il 10 settembre 2020.
- ^ Hollingham, Richard,, Blood and guts : a history of surgery, First U.S. edition, ISBN 978-0-312-57546-5, OCLC 317928918. URL consultato il 10 settembre 2020.
- ^ a b Killing through phenol injection, su web.archive.org, 12 novembre 2006. URL consultato il 10 settembre 2020 (archiviato dall'url originale il 12 novembre 2006).
- ^ NOVA Online | Holocaust on Trial | The Experiments, su pbs.org. URL consultato il 10 settembre 2020.
- ^ Padre Pio, il giallo delle stigmate, su corriere.it, Corriere della Sera, 24 ottobre 2007. URL consultato il 15 novembre 2015.
Bibliografia
[modifica | modifica wikitesto]- (EN) Klaus Weissermel, Hans-Jürgen Arpe, Charlet R. Lindley, Industrial organic chemistry, 4ª ed., Wiley-VCH, 2003, pp. 349-363, ISBN 3-527-30578-5.
- Uri Zoller, Paul Sosis, Handbook of Detergents, Part F: Production, CRC Press, 2008, ISBN 0-8247-0349-9.
Voci correlate
[modifica | modifica wikitesto]- 1,3,5-triidrossibenzene
- 2,6-dimetilfenolo
- 3-nitrofenolo
- 4,4'-bifenolo
- Alchilfenoli
- Guaiacolo
- Idrochinone
- Isocianato di fenile
- Polifenolo
- Processo al cumene
- Resorcinolo
- Resine fenoliche
Altri progetti
[modifica | modifica wikitesto] Wikizionario contiene il lemma di dizionario «fenolo»
Wikizionario contiene il lemma di dizionario «fenolo» Wikimedia Commons contiene immagini o altri file sul fenolo
Wikimedia Commons contiene immagini o altri file sul fenolo
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) Leroy G. Wade, phenol, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- (EN) carbolic acid, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 33742 · LCCN (EN) sh85020087 · GND (DE) 4346494-4 · BNF (FR) cb123062886 (data) · J9U (EN, HE) 987007283488905171 · NDL (EN, JA) 00563108 |
|---|