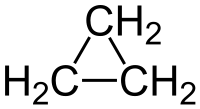
Ciclopropano
| Ciclopropano | |
|---|---|
 | |
 | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C3H6 |
| Massa molecolare (u) | 42,08 |
| Aspetto | gas incolore |
| Numero CAS | |
| Numero EINECS | 200-847-8 |
| PubChem | 6351 |
| DrugBank | DBDB13984 |
| SMILES | C1CC1 |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 0,68 (liq. a -33 °C) |
| Indice di rifrazione | 1,3799 (-42 °C) |
| Solubilità in acqua | 502 mg/L |
| Coefficiente di ripartizione 1-ottanolo/acqua | 1,72 |
| Temperatura di fusione | −127 °C (146 K) |
| Temperatura di ebollizione | −32,8 °C (240,4 K) |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 
| |
| pericolo | |
| Frasi H | 220 - 280 |
| Consigli P | 210 - 410+403 [1][2] |
Il ciclopropano è un idrocarburo ciclico formato da tre atomi di carbonio e da sei atomi di idrogeno (C3H6) o (CH2)3, da cui il vecchio nome di trimetilene datogli dallo scopritore A. Freund nel 1882.[3] È una molecola di simmetria elevata (D3h)[4] ed il più semplice dei cicloalcani. L'anello è il più piccolo possibile: questo e la tensione che ne deriva (vide infra) fa del ciclopropano una molecola di notevole interesse teorico[5][6] e determina inoltre una particolare reattività, con la possibilità di apertura dell'anello stesso e quindi della rottura di un legame C–C.[7]
A temperatura ambiente è un gas incolore facilmente liquefacibile, dall'odore idrocarburico dolce, molto infiammabile.[8] Alcuni suoi derivati rivestono importanza in campo biologico e biochimico.[9] È stato usato come anestetico.[10]
Struttura e proprietà
[modifica | modifica wikitesto]Il ciclopropano, pur essendo cineticamente stabile, è un composto endotermico: ΔHƒ° = +39,30 kJ/mol;[11] infatti, riscaldato ad alta temperatura (450-500 °C), si isomerizza a propene[12] (meno endotermico, ΔHƒ° = +20,41 kJ/mol[13]) e i meccanismi di questa reazione sono stati esaminati in dettaglio;[14][15] se la stessa è operata con nichel metallico come catalizzatore, la reazione procede già a partire da 120 °C, mentre per l'analoga reazione del ciclobutano occorrono 200 °C.[16]
Con un'indagine di diffrazione elettronica[17] in fase gassosa è stato possibile determinare per il ciclopropano le lunghezze di legame C-C, (150,1 pm) e queste risultano minori della lunghezza C-C standard negli alcani, che è di 154 pm; la lunghezza dei legami C-H è di 108,3 pm, lievemente minore del normale (109 pm[18]); gli angoli ∠HCH, di 114,5°,[19][20] risultano maggiori del valore atteso per l'ibridazione sp3 (109,5°) e sono maggiori che nel CH2 nel propano (106,1°),[21] che è il corrispondente idrocarburo a catena aperta.
Tensione angolare e torsionale
[modifica | modifica wikitesto]I tre atomi di carbonio del ciclo giacciono nei vertici di un triangolo equilatero, ma gli angoli di 60° che necessariamente ne risultano si allontanano notevolmente dall'angolo di legame ideale (109,5°) del carbonio ibridato sp3; ciò genera una forte tensione angolare, la quale comporta il piegamento dei legami C-C verso l'esterno (banana bonds), indebolendoli.[22] Tutti gli atomi di idrogeno sono poi necessariamente tenuti in posizione eclissata (angolo diedro HCCH = 0°) e ciò dà luogo a tensione torsionale (o di eclissamento), la quale invece può essere parzialmente evitata nel ciclobutano non esattamente planare.
La somma di queste due tensioni (angolare e torsionale) costituisce la tensione d'anello, cui corrisponde un surplus di energia potenziale nella molecola e quindi una sua minore stabilità.[23] Tale destabilizzazione ammonta a 27,5 kcal/mol (~9,2 kcal/mol per atomo C), appena maggiore di quella del ciclobutano (26,5 kcal/mol, ma solo 6,6 kcal/mol per atomo C).[24]
Tutto questo si riflette in un comportamento chimico che differisce dai cicloalcani con anelli ad almeno cinque termini o superiori. Questo si evidenzia, in particolare, in una certa facilità a subire reazioni di apertura dell'anello tramite reazioni di addizione: addizione di H2 (idrogenazione catalitica) a dare propano, addizione di acidi alogenidrici HX ed anche di alogeni X2 per dare derivati a catena aperta: alogenuri di 1-propile e 1,3-dialogenopropano, rispettivamente; ancora, addizione di acqua in ambiente acido, per dare n-propanolo.[25] In tali reazioni il ciclopropano viene in parte ad assomigliare al comportamento degli alcheni.[25][26] Differisce però da questi ultimi nei riguardi dell'ossidabilità a freddo: con permanganato diluito o con ozono non reagisce.[25]
Ciclopropile
[modifica | modifica wikitesto]Il ciclopropile (ciclo-C3H5–), come sostituente, è un gruppo funzionale che assomiglia al vinile nella sua capacità di stabilizzare un radicale o un carbocatione adiacenti: in questo senso il ciclopropilmetile è spesso paragonato all'allile o al benzile.[27] Attraverso indagini di RMN e altri studi, a proposito del carbocatione ciclopropilmetile [(ciclo-C3H5)–CH2+] ,[28] si trova che l'orbitale p vuoto presente sul C cationico ibridato sp2 giace parallelo al piano dell'anello triatomico (omoconiugazione,[29] conformazione bisecata[30]) e che questa la disposizione è analoga a quella che si ha nella coniugazione di un anello ciclopropanico con un doppio legame adiacente.[31]
Sintesi
[modifica | modifica wikitesto]- Sintesi di Wurtz:
Br-CH2-CH2-CH2-Br + 2 Na → CH2--CH2 + 2 NaBr
\ /
CH2
Questa reazione può avvenire anche con altri alogenuri alchilici bi-sostituiti (1,3-dicloro propano, ad esempio) e può essere catalizzata anche da altri metalli (ad esempio lo zinco).
- Addizione di carbene agli alcheni:
CH2=CH2 + CH2N2 → CH2--CH2
\ /
CH2
In realtà CH2N2 è una molecola di diazometano, composto che in presenza di luce genera il carbene (.CH2.), che è un radicale con due elettroni spaiati. Quest'ultimo è capace di inserirsi nel doppio legame formando il ciclo.
Reazioni
[modifica | modifica wikitesto] CH2--CH2 + 9/2 O2 → 3 CO2 + 3 H2O + calore
\ /
CH2
- Idrogenazione a dare il propano:
CH2--CH2 + H2 → CH3-CH2-CH3
\ /
CH2
- Trattamento con acidi alogenidrici (HCl,HBr,HI) a dare l'alogenuro alchilico corrispondente:
CH2--CH2 + HX → CH3-CH2-CH2-X
\ /
CH2
Note
[modifica | modifica wikitesto]- ^ scheda del ciclopropano su IFA-GESTIS (archiviato dall'url originale il 16 ottobre 2019).
- ^ Sigma Aldrich; rev. del 13.01.2012
- ^ (DE) August Freund, Über Trimethylen, in Monatshefte für Chemie, vol. 3, n. 1, 1882-12, pp. 625–635, DOI:10.1007/BF01516828. URL consultato l'8 dicembre 2020.
- ^ Character table for point group D3h, su symmetry.jacobs-university.de. URL consultato il 14 gennaio 2022.
- ^ Arthur Greenberg e Joel F. Liebman, Strained organic molecules, collana Organic chemistry, Academic Press, 1978, ISBN 978-0-12-299550-7.
- ^ (EN) Armin de Meijere, Introduction: Cyclopropanes and Related Rings, in Chemical Reviews, vol. 103, n. 4, 1º aprile 2003, pp. 931–932, DOI:10.1021/cr0100289. URL consultato il 7 giugno 2023.
- ^ R. Fusco, G. Bianchetti e V. Rosnati, CHIMICA ORGANICA, volume primo, L. G. Guadagni, 1974, p. 154.
- ^ (EN) PubChem, Cyclopropane, su pubchem.ncbi.nlm.nih.gov. URL consultato il 14 gennaio 2022.
- ^ Rüdiger Faust, Fascinating Natural and Artificial Cyclopropane Architectures, in Angewandte Chemie International Edition, vol. 40, n. 12, 18 giugno 2001, pp. 2251–2253, DOI:10.1002/1521-3773(20010618)40:12<2251::AID-ANIE2251>3.0.CO;2-R. URL consultato il 5 giugno 2023.
- ^ (EN) Edmond I. Eger, Bernard Brandstater e Lawrence J. Saidman, Equipotent Alveolar Concentrations of Methoxyflurane, Halothane, Diethyl Ether, Fluroxene, Cyclopropane, Xenon and Nitrous Oxide in the Dog, in Anesthesiology, vol. 26, n. 6, 1º novembre 1965, pp. 771–777, DOI:10.1097/00000542-196511000-00012. URL consultato l'8 dicembre 2020.
- ^ (EN) Cyclopropane, su webbook.nist.gov. URL consultato il 2 luglio 2022.
- ^ Michael B. Smith e Jerry March, MARCH’S ADVANCED ORGANIC CHEMISTRY, 6ª ed., 2007, p. 217, ISBN 978-0-471-72091-1.
- ^ (EN) Propene, su webbook.nist.gov. URL consultato il 7 giugno 2023.
- ^ (EN) L. S. Mayants, Theory of the thermal isomerization of cyclopropane, in Bulletin of the Academy of Sciences of the USSR Division of Chemical Science, vol. 18, n. 5, 1969-05, pp. 937–944, DOI:10.1007/BF00922845. URL consultato il 2 luglio 2022.
- ^ (EN) Karl Jug, Mechanism of cyclopropane-propene isomerization, in Theoretica Chimica Acta, vol. 42, n. 4, 1976, pp. 303–310, DOI:10.1007/BF00548472. URL consultato il 2 luglio 2022.
- ^ R. Fusco, G. Bianchetti e V. Rosnati, CHIMICA ORGANICA, vol. 2, L. G. Guadagni, 1975, p. 4.
- ^ diffrazione di elettroni in "Enciclopedia della Scienza e della Tecnica", su treccani.it. URL consultato il 18 aprile 2022.
- ^ J. E. Huheey, E. A. Keiter e R. L. Keiter, Chimica Inorganica, Principi, Strutture, Reattività, Piccin, 1999, pp. A-25 - A-33, ISBN 88-299-1470-3.
- ^ (EN) Satoshi Yamamoto, Munetaka Nakata e Tsutomu Fukuyama, Geometrical structure of cyclopropane as studied by gas electron diffraction and spectroscopic data, in The Journal of Physical Chemistry, vol. 89, n. 15, 1985-07, pp. 3298–3302, DOI:10.1021/j100261a027. URL consultato il 14 gennaio 2022.
- ^ Frank H. Allen, Olga Kennard, David G. Watson, Lee Brammer, A. Guy Orpen e Robin Taylor, Tables of bond lengths determined by X-ray and neutron diffraction. Part 1. Bond lengths in organic compounds, in J. Chem. Soc., Perkin Trans. 2, vol. 1987, n. 12, 1987, pp. S1–S19, DOI:10.1039/P298700000S1.
- ^ Clayden, J., Greeves, N., Warren, S. e Wothers, P., Organic Chemistry, Oxford University Press, 2001, p. 450, ISBN 0-19-850346-6.
- ^ J.B. Hendrickson, D.J. Cram e G.S. Hammond, CHIMICA ORGANICA, traduzione di A. Fava, 2ª ed., Piccin, 1973, pp. 187-189.
- ^ (EN) Kenneth B. Wiberg, The Concept of Strain in Organic Chemistry, in Angewandte Chemie International Edition in English, vol. 25, n. 4, 1986-04, pp. 312–322, DOI:10.1002/anie.198603121. URL consultato il 14 gennaio 2022.
- ^ (EN) F. A. Carey e R. J. Sundberg, Advanced Organic Chemistry Part A: Structure and Mechanisms, Fifth Edition, Springer Science+Business Media, LLC, 2007, p. 88, ISBN 978-0-387-68346-1.
- ^ a b c R. Fusco, G. Bianchetti e V. Rosnati, CHIMICA ORGANICA, vol. 2, L. G. Guadagni, 1975, p. 3.
- ^ I. L. Finar, ORGANIC CHEMISTRY The fundamental principles, Fourth Edition, Longmans, 1963, p. 474.
- ^ (EN) Derek C. Nonhebel, The chemistry of cyclopropylmethyl and related radicals, in Chemical Society Reviews, vol. 22, n. 5, 1993, pp. 347, DOI:10.1039/cs9932200347. URL consultato il 14 gennaio 2022.
- ^ Detto anche catione ciclopropilcarbinile in letteratura chimica.
- ^ (EN) Eric V. Anslyn e Dennis A. Dougherty, Modern Physical Organic Chemistry, University Science Books, 2006, p. 667, ISBN 978-1-891389-31-3.
- ^ (EN) A. J. Cruz-Cabeza e F. H. Allen, Conformation and geometry of cyclopropane rings having π-acceptor substituents: a theoretical and database study, in Acta Crystallographica Section B: Structural Science, vol. 67, n. 1, 1º febbraio 2011, pp. 94–102, DOI:10.1107/S0108768110049517. URL consultato il 4 luglio 2022.
- ^ Michael B. Smith e Jerry March, MARCH’S ADVANCED ORGANIC CHEMISTRY, 6ª ed., 2007, pp. 241-242, ISBN 978-0-471-72091-1.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su ciclopropano
Wikimedia Commons contiene immagini o altri file su ciclopropano
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) cyclopropane, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 22886 · LCCN (EN) sh85035101 · GND (DE) 4148622-5 · BNF (FR) cb121769798 (data) · J9U (EN, HE) 987007538312705171 |
|---|








