| 2-propanolo | |
|---|---|
 | |
 | |
| Nomi alternativi | |
| alcool isopropilico,
2-propanolo, isopropanolo[1] | |
| Caratteristiche generali | |
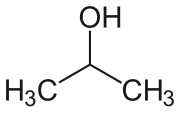
| Formula bruta o molecolare | (CH3)2CHOH - C3H8O |
| Massa molecolare (u) | 60,10 g/mol |
| Aspetto | liquido incolore |
| Numero CAS | |
| Numero EINECS | 200-661-7 |
| PubChem | 3776 |
| DrugBank | DBDB02325 |
| SMILES | CC(C)O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 0,786 (20 °C) |
| Indice di rifrazione | 1,375 (20 °C) |
| Solubilità in acqua | (20 °C) solubile |
| Temperatura di fusione | −89 °C (184 K) |
| Temperatura di ebollizione | 82 °C (355 K) (1013 hPa) |
| Indicazioni di sicurezza | |
| Punto di fiamma | 12 °C (285 K) (c.c.) |
| Limiti di esplosione | 2 - 12,7 Vol% |
| Temperatura di autoignizione | 425 °C (698 K) |
| Simboli di rischio chimico | |
 
| |
| pericolo | |
| Frasi H | 225 - 319 - 336 |
| Consigli P | 210 - 233 - 305+351+338 [2] |
L'alcool isopropilico, (IUPAC propan-2-olo), o 2-propanolo, è un alcool di formula CH3CH(OH)CH3, incolore e moderatamente volatile, con un forte odore caratteristico, non sgradevole se puro.
Viene spesso denominato "isopropanolo", sebbene tale denominazione sia espressamente citata dalla IUPAC come errata: infatti, se avesse tale nome, l'alcool isopropilico dovrebbe derivare "dall'isopropano", idrocarburo inesistente perché il propano non ha chiaramente isomeri. Tuttavia, il nome è diffuso poiché questo alcool è isomero costituzionale del propanolo (n-propanolo).
Proprietà
[modifica | modifica wikitesto]L'alcool isopropilico è miscibile in acqua, etanolo, etere e cloroformio. È in grado di sciogliere etilcellulosa, polivinilbutirrale, molti olii, alcaloidi, gomme e resine naturali.[3] A differenza dell'etanolo o del metanolo, l'alcool isopropilico non è miscibile con le soluzioni saline e può essere separato da soluzioni acquose aggiungendo un sale come il cloruro di sodio. Il processo viene chiamato salting out e permette di concentrare l'alcool isopropilico in una fase distinta.[4]
La miscela di acqua e alcool isopropilico abbassano il punto di fusione [4], che in composto al 87,7% in peso (91% vol.), forma un azeotropo con punto di ebollizione di 80,37 °C. La viscosità di questo alcool aumenta al diminuire della temperatura, fino a solidificare a -89 °C.
La assorbanza massima si trova nello spettro ultravioletto-visibile, a 205 nm.[5][6]
L'alcool isopropilico ha un sapore leggermente amaro e non è commestibile.[4][7]
Sintesi
[modifica | modifica wikitesto]L'alcool isopropilico viene prodotto dall'idratazione del propilene, attraverso due vie principali:
1. Metodo indiretto, doppio stadio in fase liquida attraverso l'estere solforico.
L'addizione dell'acido solforico avviene a 20 °C e 10-12 bar (H2SO4 94%) oppure a 60-65 °C e 25 bar con concentrazione acido al 70%. Successivamente diluendo con acqua si idrolizza l'estere solforico. Questo processo viene utilizzato da BP, Shell e Texaco.
2. Metodo diretto, singolo stadio, idratazione in fase gas del propilene.
Le tipiche condizioni operative sono 270 °C e 250 bar su catalizzatori che possono essere WO3/SiO2 con promotori di ZnO (processo ICI) oppure 175-190 °C 25-40 bar catalizzato da H3PO4 su supporti di silice. Su questo schema esistono numerose variazioni di condizioni operative tra i diversi produttori.
Usi
[modifica | modifica wikitesto]L'alcool isopropilico è usato comunemente come detergente, come blando disinfettante cutaneo (rubbing alcohol) al pari dell'alcol etilico denaturato, come solvente e come additivo nelle industrie e nella stampa offset nonché come importante intermedio per sintesi farmaceutiche e cosmetiche. Viene anche usato come additivo per carburanti e come liquido per i radiatori delle automobili.
L'alcool isopropilico trova anche impiego come additivo per particolari tipi di benzina per veicoli, perché permette che l'acqua eventualmente presente non si separi in una fase distinta, cosa che farebbe aspirare acqua al motore causandone lo spegnimento.
È anche un ottimo sgrassante che viene spesso usato per la pulizia di dispositivi ottici (lenti, obiettivi fotografici, microscopi) ed elettronici (lenti laser per CD/DVD, nastri magnetici, circuiti stampati, sensori), in quanto rispetto all'alcool etilico (etanolo) aggredisce meno i delicati rivestimenti superficiali di questi dispositivi. È inoltre usato per pulire i monitor dei computer e come blando solvente per togliere la "pasta termica" dalla CPU (normalmente usato il grasso al silicone). Un altro utilizzo in campo elettronico (seppur ottico) è nella connessione delle fibre ottiche, in quanto evaporando non lascia residui e non danneggia i piccoli componenti (nell'ordine del decimo di millimetro).
Viene ampiamente utilizzato per la detersione dei piatti di stampa 3D.
Si usa anche per combattere le infestazioni di cocciniglie sulle piante. E viene utilizzato nei comuni detergenti lavapavimenti.
Ne viene fatto uso in istochimica per evidenziare i lipidi, ad esempio, nel tessuto adiposo. Data la sua parziale idrofobicità viene utilizzato per mettere in soluzione acquosa uno dei coloranti idrofobici (devono necessariamente essere idrofobici per legarsi ai lipidi, a loro volta idrofobici) della famiglia dei Sudan. Non appena il tessuto viene immerso nella soluzione il Sudan si separa dall'alcool isopropilico per andarsi a legare con i lipidi. A questo punto si è ottenuta la colorazione desiderata.
Conservazione e tossicità
[modifica | modifica wikitesto]L'alcool isopropilico è altamente infiammabile, quindi va conservato e maneggiato lontano da scintille, fiamme o fonti di calore.
Il 2-propanolo esibisce scarsa tossicità acuta per via orale, mentre per via inalatoria se gli animali sono esposti ad alte concentrazioni di vapori, manifestano irritazioni delle membrane mucose, atassia, prostrazione, depressione del sistema nervoso centrale e morte.[8]
Note
[modifica | modifica wikitesto]- ^ Benché diffuso, il termine isopropanolo è scorretto: combina il prefisso iso- della nomenclatura tradizionale con il suffisso -olo della IUPAC.
- ^ scheda del 2-propanolo su IFA-GESTIS (archiviato dall'url originale il 16 ottobre 2019).
- ^ Arthur K. Doolittle, The Technology of Solvents and Plasticizers, New York, John Wiley & Sons, Inc., 1954, p. 628.
- ^ a b c The Merck Index, 10ª ed., Rahway, NJ, Merck & Co., 1983, p. 749.
- ^ Isopropyl Alcohol, UltimAR, Suitable for Liquid Chromatography, Extract/Conc, UV-Spectrophotometry, su us.vwr.com, VWR International. URL consultato il 25 agosto 2014.
- ^ UV Cutoff (PDF), su utsc.utoronto.ca, Università di Toronto. URL consultato il 25 agosto 2014 (archiviato dall'url originale l'8 ottobre 2013).
- ^ John E. Logsden e Richard A Loke, Propyl Alcohols, in Jacqueline I. Kroschwitz (a cura di), Kirk-Othmer Concise Encylclopedia of Chemical Technology,, 4ª ed., New York, John Wiley & Sons, Inc., 1999, pp. 1654–1656, ISBN 978-0-471-41961-7.
- ^ Parere Istituto Superiore di Sanità 2-PROPANOLO (DOC), su ctntes.arpa.piemonte.it. URL consultato il 6 novembre 2020 (archiviato dall'url originale il 30 settembre 2021).
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file sul 2-propanolo
Wikimedia Commons contiene immagini o altri file sul 2-propanolo
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) Leroy G. Wade, isopropyl alcohol, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- Scheda di sicurezza dell'alccol isopropilico in italiano (PDF). URL consultato il 16 marzo 2017 (archiviato dall'url originale il 13 luglio 2017)., faichim.com
- Scheda di sicurezza dell'alcool isopropilico, su sigmaaldrich.com.
| Controllo di autorità | J9U (EN, HE) 987007556742605171 |
|---|









