Indice
Reazione aldolica di Mukaiyama
La reazione aldolica di Mukaiyama[1] rappresenta una variante della reazione di condensazione aldolica, e costituisce uno dei più importanti procedimenti per la formazione di legami carbonio–carbonio. In questa reazione, un composto carbonilico subisce attacco nucleofilo da parte di un trimetilsilil enol etere per formare un β-trimetilsililossichetone, oppure da parte del trimetilsilil acetale di un chetene per formare un β-trimetilsililossiestere; i prodotti così ottenuti possono poi essere sottoposti a idrolisi acida per essere convertiti rispettivamente in β-idrossichetoni e in β-idrossiesteri.
Meccanismo generale
[modifica | modifica wikitesto]L'addizione aldolica di Mukaiyama è un'addizione di un silil enol etere a composti carbonilici, mediata da un acido di Lewis.[senza fonte]

Si ottiene una miscela racemica di enantiomeri. A seconda che si usi un silil enol etere E o Z si ottiene una miscela di quattro prodotti. La prevalenza di un diastereoisomero o un altro dipende dalle condizioni di reazione, dai substrati e dall'acido di Lewis impiegato.

La reazione di Mukaiyama tipica è quella tra il silil enol etere del cicloesanone con la benzaldeide. A temperatura ambiente si ottiene una miscela diastereoisomerica di β-idrossichetoni treo o eritro, così come una certa percentuale di prodotto di condensazione (un enone esociclico). Nella sua variante originale come acido di Lewis si usava il cloruro di titanio, aggiunto in quantità stechiometriche.
Esempio
[modifica | modifica wikitesto]Di seguito è riportato un esempio in cui R è un idrogeno H.
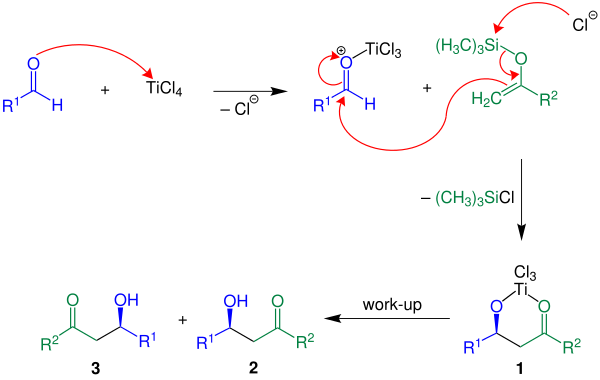
Qui l'acido di Lewis impiegato è TiCl4. L'acido attiva l'aldeide, si ha poi la formazione di un legame C-C tra l'enol etere e l'aldeide. Per perdita di clorosilano si ottiene il composto 1. Il prodotto desiderato, una miscela racemica di 2 e 3, si ottiene con un finale work-up acquoso.[senza fonte]
Vantaggi
[modifica | modifica wikitesto]Lo sviluppo di nuove e più vantaggiose metodologie per la sintesi di composti β-idrossicarbonilici riscuote grande interesse a causa della vasta diffusione del gruppo funzionale aldolico nelle molecole naturali. Rispetto alla condensazione aldolica incrociata diretta, la reazione di Mukaiyama presenta numerosi vantaggi: avviene in condizioni più semplici, non è reversibile e consente di ottenere gli aldoli con rese elevate; inoltre, quando il prodotto può subire disidratazione, questa avviene con un'entità limitata.
Catalisi
[modifica | modifica wikitesto]La reazione richiede la presenza di un catalizzatore. Solitamente si ricorre a basi o acidi di Lewis: le basi di Lewis interagiscono con il trimetilsilil nucleofilo, mentre gli acidi attivano il reagente elettrofilo. Le basi utilizzate comprendono i fluoruri inorganici, principalmente CsF, e organici, come il fluoruro di tetra-n-butilammonio; gli N-ossidi, i P-ossidi e gli S-ossidi; i carbossilati, gli alcossidi e i fenossidi metallici; le ammine, le fosfine e i carbeni N-eterociclici. Tra i catalizzatori acidi di Lewis sono invece riportati sali e complessi di metalli di transizione, come il tetracloruro di titanio utilizzato dallo stesso Mukaiyama nel corso dei primi studi compiuti sulla reazione, e alcuni composti a base di silicio, come (CH3)3SiN(SO2CF3)2.
La condensazione aldolica di Mukaiyama può essere promossa anche dagli acidi di Brønsted, con un meccanismo catalitico simile a quello degli acidi di Lewis: H+ attiva il reagente elettrofilo legandosi al suo ossigeno carbonilico. Le ricerche sulla catalisi operata da acidi di Brønsted sono state finora molto meno numerose di quelle relative all'utilizzo di acidi e basi di Lewis.
A proposito della reazione di Mukaiyama promossa da acidi di Brønsted, è stato ipotizzato che l'idrogeno acido del catalizzatore possa scambiarsi con il gruppo trialchilsilile del reagente nucleofilo (silil enol etere o silil acetale). Sono state pubblicate varie ricerche[2] relative al meccanismo della reazione, effettuate per stabilire se il catalizzatore effettivo sia rappresentato dall'acido protico o dal suo derivato sililato, che agisce come acido di Lewis. La questione, per ora, è rimasta irrisolta: gli esiti di alcuni studi sembrano favorire l'ipotesi della catalisi di Brønsted, mentre altri risultati avvalorano quella della catalisi di Lewis.
Note
[modifica | modifica wikitesto]- ^
a) T. Mukaiyama, K. Banno, K. Narasaka, J. Am. Chem. Soc. 1974, 96, 7503;
b) T. Mukaiyama, T. Izawa, K. Saigo, Chem. Lett. 1974, 323;
c) T. Mukaiyama, K. Narasaka, K. Banno, Chem. Lett. 1973, 1011. - ^
a) Chem. Commun. 2010, 46, 904;
b) Angew. Chem. Int. Ed. 2006, 45, 6130;
c) Org. Lett. 2005, 7, 5657;
d) Org. Biomol. Chem. 2005, 3, 3284;
e) Org. Biomol. Chem. 2011, 9, 2192.









