Indice
Gilbert Lewis
Gilbert Newton Lewis (Weymouth, 23 ottobre 1875 – Berkeley, 23 marzo 1946) è stato un chimico statunitense.
Biografia
[modifica | modifica wikitesto]Fu educato a casa dai suoi genitori in stile inglese del sistema di tutoraggio. All'età di 24 anni si laureò in Chimica presso l'Università di Harvard. Terminati gli studi si trasferì in Germania, dove rimase per due anni, dopo di che fu assunto dal governo filippino. Egli trascorse 7 anni nelle Filippine come il sovrintendente dell'Ufficio di presidenza di pesi e misure, dove trovò dei giovani di talento interessati a fare ricerca. Questo gruppo fu riunito da Richard M. Noyes che aveva ricevuto il dottorato a Ostwald presso l'Università di Lipsia. Questo centro di ricerca fornì un ambiente stimolante in cui Lewis passò sette anni durante i quali si impegnò molto e fece delle ricerche sulla determinazione sistematica dei potenziali dell'elettrodo degli atomi. (Atomo= struttura dove è organizzata la materia. Materia=ciò che occupa spazio).
Al suo ritorno negli Stati Uniti iniziò a lavorare al Massachusetts Institute of Technology. Egli lasciò il Massachusetts Institute of Technology quando fu nominato presidente del Dipartimento di Chimica e Decano del Collegio di Chimica all'Università della California nel 1912, posizione che mantenne per 34 anni, fino alla sua morte. Lewis credeva che un dipartimento di chimica dovesse contemporaneamente insegnare e far progredire la scienza, ricordando sempre che si deve rivolgere molta più attenzione ai principi fondamentali, piuttosto che le alle applicazioni tecniche; infatti le sue lezioni erano basate soprattutto sui fondamenti della chimica piuttosto che sugli esperimenti. Durante le sue lezioni e i suoi esperimenti Lewis sceglieva di lavorare con gli studenti più eccezionali piuttosto che con gli studenti medi.
Circa nel 1902 Lewis iniziò a utilizzare i disegni di atomi cubici nei suoi appunti delle lezioni, in cui gli angoli del cubo rappresentano le possibili posizioni degli elettroni. Nel 1916, Lewis pubblicò una teoria su alcuni legami chimici chiamati legami covalenti (puri, polari e ionici), che sono generati da metalli che non hanno quattro o più elettroni di valenza, e non raggiungono gli otto. Le ricerche di Lewis saranno pubblicate e divulgate da Irving Langmuir circa nel 1923. Questa teoria è basata sulla disposizione degli elettroni attorno al nucleo. Lewis applicò questa teoria prima all'idrogeno, che può avere al massimo due elettroni che circondano il nucleo, il legame tra due atomi è il risultato della condivisione di una coppia di elettroni che vengono apportati dai due atomi. Secondo Lewis, le teorie del legame covalente per l'atomo di idrogeno potevano essere valide e generalizzabili al resto degli atomi. Gli atomi con più elettroni possono condividere gli elettroni di valenza per formare legami covalenti completando il loro ottetto di elettroni. Il legame covalente può essere semplice se è condivisa solo una coppia di elettroni, doppio se sono condivise due coppie di elettroni, e triplo, se sono condivise tre coppie. Ad esempio la molecola dell'idrogeno crea un legame semplice, quella del carbonio doppio e quella dell'azoto triplo. Anche tra i diversi atomi si possono formare questi legami, pur nel rispetto della regola dell'ottetto.
Gilbert Lewis, con Merle Randall, pubblicò nel 1923 il famoso libro di termodinamica che ancora oggi rappresenta un esempio insuperato di chiarezza e rigore scientifico. Introdusse il termine fugacità per descrivere il comportamento di gas reali e la regola di Lewis e Randall viene utilizzata per descrivere il comportamento delle miscele ideali di aeriformi (gas) reali. Nello stesso anno elaborò la sua famosa teoria sugli acidi e le basi. Nel 1926 Lewis coniò il termine fotone per indicare il quanto di luce di Einstein.
Nel 1933 sfruttò l'elettrolisi dell'acqua normale per produrre per la prima volta l'acqua pesante, che ha un ruolo importante nella tecnologia delle centrali nucleari a fissione. Già nel 1902 aveva scoperto che la chimica degli elementi dei principali gruppi poteva essere spiegata da un modello in cui gli elettroni negli atomi erano sistemati ai vertici di cubi concentrici. Dunque, nove anni prima del modello atomico di Rutherford nasceva la regola dell'ottetto.
Nonostante le numerose indagini nel campo della scienza, Lewis diventò famoso per la sua teoria dei legami chimici e per la sua definizione di acido e di base. Non vi è nessuno scienziato nella storia americana che ha contribuito maggiormente a tutti i settori della chimica di Gilbert Newton Lewis. Il suo pensiero era molto più avanti del suo tempo e le sue teorie hanno avuto un'influenza profonda sulla chimica moderna. Al contrario di altri suoi contemporanei, la grandezza di Gilbert Newton Lewis non venne mai celebrata abbastanza e non ottenne mai il Premio Nobel.
Lewis continuò le sue ricerche fino alla sua morte improvvisa per un attacco di cuore il 23 marzo 1946, nel suo laboratorio, circondato dai suoi Becher e provette.
Regola dell'ottetto
[modifica | modifica wikitesto]
La regola dell'ottetto applicata ad un atomo di ossigeno. La regola dell'ottetto è una regola empirica introdotta da Gilbert Newton Lewis per spiegare in modo approssimato la formazione di legami chimici tra gli atomi, usabile a rigore solo per gli atomi dei gruppi principali (quelli con numerazione romana) della tavola periodica. Ciò spiega la condizione particolare di stabilità di un atomo, ossia quando questo possiede il livello elettronico esterno completo.
Questa regola ci consente di sapere il numero di elettroni che possiede un atomo all'interno di un orbitale. Essa stabilisce che il primo orbitale non deve contenere più di 2 elettroni, mentre gli orbitali successivi non devono contenere più di 8 elettroni. Gli elettroni presenti nell'ultimo orbitale sono detti "elettroni di valenza".
Ad esempio la regola dell'ottetto stabilisce che l'ossigeno deve avere 6 elettroni di valenza, poiché ha 8 elettroni che devono essere disposti su 2 orbitali: il primo ha 2 elettroni e il secondo ne ha 6. Sono presenti degli atomi che hanno una configurazione elettronica instabile, essi sono detti elementi di transizione, ovvero il numero dei loro elettroni di valenza può variare, un esempio è il ferro: esso può avere 2 o 3 elettroni di valenza. Per sapere il numero degli elettroni di valenza di un atomo non è necessario applicare tutte le volte la regola dell'ottetto: si può cercare l'atomo sulla tavola periodica degli elementi e vedere a quale gruppo appartiene (è indicato dal numero romano).
Struttura di Lewis
[modifica | modifica wikitesto]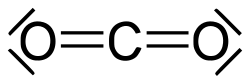
La struttura di Lewis fu ideata e intitolata in onore del chimico Gilbert Lewis. Essa si propone di rappresentare con un disegno bidimensionale la struttura di una molecola basandosi principalmente sulla regola dell'ottetto.
È possibile disegnare una molecola con la struttura di Lewis seguendo tre punti:
- gli atomi vengono disposti approssimativamente nello spazio, indicati semplicemente dalla/e lettera/e del proprio elemento. È importante seguire una certa geometria, disponendo possibilmente l'elemento con un solo atomo al centro e quelli ad esso legato con simmetria centrale rispetto a quell'atomo;
- i legami sono rappresentati da una linea (inizialmente sempre singola, poi doppia o tripla a seconda del tipo di legame) che collega un atomo all'altro; ogni legame rappresenta inoltre due elettroni;
- gli elettroni di valenza vanno disegnati come puntini e sono il fulcro della teoria della struttura di Lewis: bisogna contare il numero totale di elettroni disponibili nei livelli di valenza (es. in H2O, gli elettroni sono 1+1+6 = 8, in NO2-, gli elettroni sono 5+6+6+1 = 18), poi scalare quelli utilizzati per costruire i legami e cominciare a distribuire gli elettroni attorno a ciascun atomo in modo da soddisfare per ognuno la regola dell'ottetto (ossia ogni atomo, tra legami ed elettroni non condivisi, deve arrivare a contarne otto). A questo fine, ogni legame che l'atomo realizza soddisfa già due degli otto elettroni necessari. Per disporre gli elettroni non condivisi è necessario partire con il soddisfare prima gli elementi più elettronegativi. In caso di defezioni, si supplisce al mancato raggiungimento dell'ottetto realizzando legami doppi o tripli, o spostando l'atomo in posizioni più agevoli.
Vita privata
[modifica | modifica wikitesto]Il 21 giugno del 1912 sposò Mary Hinckley Sheldon, figlia di un professore di Lingue romanze di Harvard. Ebbero due figli maschi, che diventarono entrambi professori di chimica, e una figlia femmina.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Gilbert Lewis
Wikimedia Commons contiene immagini o altri file su Gilbert Lewis
Collegamenti esterni
[modifica | modifica wikitesto]- Lewis, Gilbert Newton, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- Lewis, Gilbert Newton, su sapere.it, De Agostini.
- (EN) William B. Jensen, Gilbert N. Lewis, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- (EN) Gilbert Lewis, su Mathematics Genealogy Project, North Dakota State University.
- (EN) Opere di Gilbert Lewis, su Open Library, Internet Archive.
| Controllo di autorità | VIAF (EN) 30534916 · ISNI (EN) 0000 0001 1050 2475 · LCCN (EN) n86864516 · GND (DE) 118976575 · J9U (EN, HE) 987007274045105171 · NDL (EN, JA) 00447581 · CONOR.SI (SL) 58288483 |
|---|









