Indice
Mentolo
| Mentolo | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| (1R,2S,5R)-2-isopropil-5-metilcicloesanolo | |
| Nomi alternativi | |
| (-)-mentolo | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C10H20O |
| Massa molecolare (u) | 156,27 g/mol |
| Aspetto | solido cristallino incolore |
| Numero CAS | (-)-mentolo |
| Numero EINECS | 218-690-9 |
| PubChem | 16666 |
| DrugBank | DBDB00825 |
| SMILES | CC1CCC(C(C1)O)C(C)C |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 0,89 |
| Potere rotatorio specifico | [𝛼]20D= –50 (etanolo, 10%) |
| Solubilità in acqua | 0,397 g/L |
| Temperatura di fusione | 41 -45 °C (314-318 K) |
| Temperatura di ebollizione | 212 °C (485 K) |
| Indicazioni di sicurezza | |
| Punto di fiamma | 96 °C (~369 K) |
| Simboli di rischio chimico | |

| |
| attenzione | |
| Frasi H | 315 |
| Consigli P | [1] |
Il mentolo (o (-)-mentolo) è un alcol chirale. A temperatura ambiente si presenta come un solido bianco dall'odore caratteristico. È un composto irritante.
Estratto dall'olio essenziale della menta piperita, ha potere rinfrescante ed è usato per confezionare profumi, farmaci ed altri preparati.[2]
Storia
[modifica | modifica wikitesto]Il mentolo fu scoperto più di duemila anni fa in Giappone, sebbene la menta piperita, da cui è ottenuto, venisse già usata nell'antichità come erba medicinale da Egizi, Greci e Romani.
In Occidente, il mentolo è stato isolato nel 1771 da Hieronymus David Gaubius.
Struttura
[modifica | modifica wikitesto]Appartiene alla classe dei terpenoidi (è un monoterpenoide) e, a differenza di altri composti della stessa classe (es. limonene e carvone), è presente in natura solo un diastereoisomero degli otto possibili.
Il 2-isopropil-5-metil-cicloesanolo è una molecola dotata di 3 centri chirali, che portano a 8 diversi stereoisomeri: di questi otto, quattro sono forme diastereoisomere, conosciute con il nome di mentolo, neomentolo, isomentolo e neoisomentolo. Non esistendo un centro di inversione o un piano di simmetria, nessuna delle forme è una forma meso, cosicché ognuno dei quattro diastereoisomeri ha un corrispondente enantiomero. Tuttavia l'unica forma che possiede un effetto rinfrescante è l'isomero (1R-2S-5R), mentre gli altri isomeri non mostrano tale effetto.[3]
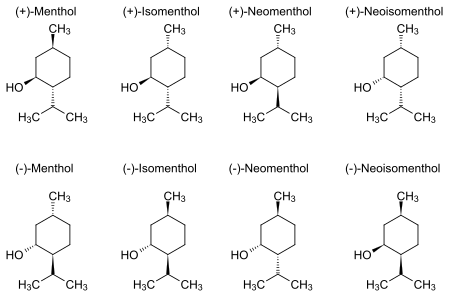
Il (-)-mentolo è il più stabile delle quattro forme: infatti presenta una configurazione "a sedia", con i sostituenti in posizione equatoriale che protendono verso l'esterno, e con il gruppo isopropile in posizione trans rispetto al gruppo alcol e metile. Questa disposizione relativa dei gruppi minimizza il loro reciproco ingombro sterico; negli altri stereoisomeri l'ingombro sterico reciproco tra i gruppi è maggiore.
Caratteristiche
[modifica | modifica wikitesto]
Il mentolo si presenta sotto forma di cristalli aghiformi incolori dal caratteristico odore di menta. È scarsamente solubile in acqua (circa 0,05%), mentre è molto solubile in cloroformio, alcoli o eteri.[4]
Come tutti i diastereoisomeri, gli isomeri del mentolo hanno la stessa formula bruta e legami chimici, ma differiscono per l'orientazione spaziale dei sostituenti degli atomi di carbonio stereogenici C1, C2 e C5; di conseguenza, hanno proprietà chimiche molto simili, ma differiscono nella capacità di legare altre molecole chirali, come quelle presenti nei recettori del sistema nervoso: questo fa sì che ogni isomero abbia odore e gusto diverso dagli altri.
- (1R,2S,5R)-(-)-mentolo: molto rinfrescante, dolce, intenso sapore di menta.
- (1S,2R,5S)-(+)-mentolo: leggera sensazione di freddo, debole gusto alla menta con note erbacee.
- (1R,2R,5S)-(-)-neomentolo: odore stantio, gusto di menta, fresco.
- (1S,2S,5R)-(+)-neomentolo: leggermente fresco e rinfrescante gusto di menta.
- (1R,2S,5S)-(-)-isomentolo: debolmente rinfrescante, odore di canfora.
- (1S,2R,5R)-(+)-isomentolo: odore di canfora, fresco.
- (1S,2S,5S)-(-)-neoisomentolo: lieve potere rinfrescante, odore stantio e canforaceo.
- (1R,2R,5R)-(+)-neoisomentolo: molto poco rinfrescante, note erbacee.
Il mentolo reagisce come un normale alcol secondario. Può venir ossidato da agenti come l'acido cromico, diventando un chetone (il mentone) e in altre condizioni l'ossidazione può portare alla rottura dell'anello.
Il mentolo può facilmente essere disidratato per formare principalmente il 3-mentene.
Produzione
[modifica | modifica wikitesto]Il mentolo è uno dei monoterpenoidi della menta, in cui viene prodotto per biosintesi. Il componente (+)-pulegone è l'intermedio chiave di questa sintesi, in quanto può essere ossidato a mentofurano oppure essere ridotto a (+)-mentone o (+)-isomentone, che a sua volta per riduzione viene convertito in mentolo e acetato di mentile.
Data la grande richiesta di mentolo[5][6], oltre all'estrazione dalla menta piperita sono state messe a punto varie vie sintetiche per produrlo[3].
Una via sintetica parte dal citronellale, il quale in seguito ad una ciclizzazione interna genera l'isopulegolo, il quale viene poi idrogenato a mentolo; tuttavia la ciclizzazione del citronellale porta anche alla formazione degli altri stereoisomeri, in quanto la reazione non è diastereoselettiva.
L'idrogenazione dal mircene
[modifica | modifica wikitesto]Un team guidato da Ryōji Noyori, il quale verrà poi insignito del premio Nobel proprio per queste ricerche, sviluppò un processo che, partendo dal mircene, permette di ottenere isopulegolo che viene idrogenato a mentolo. Si producono con questo processo via circa 3500 tonnellate annue.

Il mircene viene inizialmente attaccato dalla dietilammina in presenza di litio per formare un'ammina allilica. Successivamente un catalizzatore asimmetrico a base di rodio isomerizza il doppio legame allilico portando alla formazione di un'enammina, la quale subisce idrolisi per dare il (R)-citronellale. Il citronellale, in presenza di un acido di Lewis (zinco bromuro) ciclizza a (-)-isopulegolo che viene infine idrogenato a (1R,2S,5R)-(-)-mentolo.[6][3]
Il passaggio chiave è l'isomerizzazione catalitica del doppio legame che avviene in presenza di rodio legato a un legante asimmetrico (il S-BINAP), che permette di portare selettivamente verso l'enantiomero R.
Il processo Haarmann-Reimer
[modifica | modifica wikitesto]Un processo alternativo, noto come processo Haarmann-Reimer sintetizza il timolo da m-cresolo e propilene.[3][6][7]

Il timolo viene poi idrogenato per dare la miscela dei vari stereoisomeri del mentolo. Questa miscela viene sottoposta a distillazione frazionata per estrarre il mentolo racemo, il quale viene fatto reagire con benzoato di metile per dare il benzoato di mentile. Il (-)-mentolo viene quindi ottenuto per cristalizzazione frazionata, idrolisi dell'estere e ricristalizzazione con una purezza finale del 90%.
Altre tecniche
[modifica | modifica wikitesto]Altre strategie di sintesi prevedono l'uso di (-)-piperitone, 3-carene, (+)-pulegone, limonene.[6]
Applicazioni
[modifica | modifica wikitesto]Il mentolo viene usato in diversi prodotti.
In medicina viene utilizzato per alleviare mal di gola, come analgesico per ridurre lievi dolori come crampi, mal di testa e strappi muscolari, essendo il mentolo un debole agonista dei recettori k-oppioidi. Inoltre è usato come decongestionante ed è presente in certi prodotti usati per curare scottature ed eritemi solari. Lo si può trovare nei prodotti cosmetici.
In apicoltura si è dimostrato efficace nella lotta contro la Varroa destructor.
Viene usato come additivo nelle sigarette per ridurre l'irritazione alla gola provocata dal fumo, ed in prodotti per l'igiene orale, come dentifrici e collutori, e come additivo alimentare (gomme da masticare e caramelle).
Secondo uno studio condotto da alcuni ricercatori dell'Università di Padova, stimola le cellule del tessuto adiposo bianco inducendole a consumare i grassi producendo calore.[8] Si pensa che il tessuto adiposo sia dotato di recettori di temperatura indipendenti dal sistema nervoso e che quindi venga indotto un aumento di temperatura con conseguente accelerazione del metabolismo che permetterebbe il dimagrimento; questo meccanismo è ancora oggetto di studio nella comunità scientifica.
Infine può essere utilizzato per stimolare la lacrimazione, tecnica sfruttata dagli attori per piangere nelle scene in cui ciò è richiesto.[9]
Note
[modifica | modifica wikitesto]- ^ scheda del (1R,2S,5R)-(-)-mentolo su Sigma Aldrich
- ^ (EN) menthol | Definition, Structure, & Uses, su Encyclopedia Britannica. URL consultato il 12 aprile 2020.
- ^ a b c d (EN) Johannes Panten e Horst Surburg, Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH Verlag GmbH & Co. KGaA, 26 novembre 2015, pp. 1–55, DOI:10.1002/14356007.t11_t01, ISBN 978-3-527-30673-2. URL consultato il 12 aprile 2020.
- ^ (EN) PubChem, l-Menthol, su pubchem.ncbi.nlm.nih.gov. URL consultato il 12 aprile 2020.
- ^ New Process for Menthol Production :: News :: ChemistryViews, su chemistryviews.org. URL consultato il 12 aprile 2020.
- ^ a b c d (EN) 6: Strategies in (-)-Menthol Synthesis, su Chemistry LibreTexts, 20 novembre 2014. URL consultato il 12 aprile 2020.
- ^ (EN) Bernd Schäfer, Menthol: Minze versus Tagasako-Prozess, in Chemie in unserer Zeit, vol. 47, n. 3, 2013-06, pp. 174–182, DOI:10.1002/ciuz.201300599. URL consultato il 12 aprile 2020.
- ^ https://www.unipd.it/sites/unipd.it/files/20140124b.pdf
- ^ (EN) Ashlee Robbins, Masayuki Kurose e Barbara J. Winterson, Menthol Activation of Corneal Cool Cells Induces TRPM8-Mediated Lacrimation but Not Nociceptive Responses in Rodents, in Investigative Ophthalmology & Visual Science, vol. 53, n. 11, 1º ottobre 2012, pp. 7034–7042, DOI:10.1167/iovs.12-10025. URL consultato il 10 dicembre 2020.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su mentolo
Wikimedia Commons contiene immagini o altri file su mentolo
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) Leroy G. Wade, menthol, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | LCCN (EN) sh85083726 · GND (DE) 4378972-9 · BNF (FR) cb137450553 (data) · J9U (EN, HE) 987007565556905171 |
|---|










