Reattivo di Tebbe
| Reattivo di Tebbe | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| Bis(ciclopentadienil)-μ-cloro(dimetilalluminio)-μ-metilenetitanio | |
| Nomi alternativi | |
| Reattivo di Tebbe | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C13H18AlClTi |
| Massa molecolare (u) | 284,60 |
| Aspetto | solido rosso |
| Numero CAS | |
| Numero EINECS | 203-625-9 |
| PubChem | 53384502 e 76030810 |
| SMILES | [CH3-].C[Al+]C.[CH-]1C=CC=C1.[CH-]1C=CC=C1.[Cl-].[Ti+3] e C[Al](C)[CH2-].[CH-]1C=CC=C1.[CH-]1C=CC=C1.[Cl-].[Ti+4] |
| Indicazioni di sicurezza | |
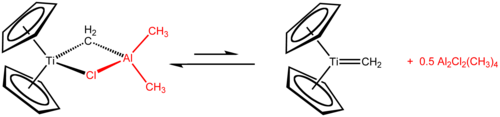
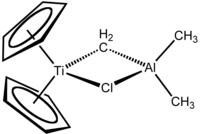
Il reattivo di Tebbe è il composto metallorganico di formula (C5H5)2TiCH2ClAl(CH3)2. Il composto fu sintetizzato per la prima volta da Frederick Tebbe nel 1978. Viene usato nelle metilenazioni dei composti carbonilici, cioè per convertire composti contenenti il gruppo R2C=O nei corrispondenti derivati R2C=CH2.[1] È un solido rosso piroforico all'aria, e quindi viene usualmente manipolato in atmosfera inerte.
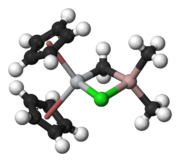
Il reattivo di Tebbe contiene due centri metallici con coordinazione tetraedrica collegati da due leganti a ponte. Al titanio sono coordinati due anelli ciclopentadienile ([C5H5]−, o Cp) e l'alluminio ha due leganti metile. Titanio e alluminio sono collegati da un ponte metilene (-CH2-) e da un atomo di cloro, con un arrangiamento Ti–CH2–Al–Cl pressoché planare.[2] Il reattivo di Tebbe è stato il primo composto contenente un gruppo metilene che collega un metallo di transizione (Ti) e un elemento dei gruppi principali (Al).[3]
Sintesi
[modifica | modifica wikitesto]Il reattivo di Tebbe viene preparato in soluzione di toluene a partire da dicloruro di titanocene e trimetilalluminio:[3][4]
- Cp2TiCl2 + 2 Al(CH3)3 → CH4 + Cp2TiCH2AlCl(CH3)2 + Al(CH3)2Cl
Dopo circa tre giorni il prodotto si ottiene per ricristallizzazione, in modo da rimuovere Al(CH3)2Cl.[3] Benché le reazioni che utilizzano il reattivo di Tebbe così isolato portino a prodotti più puri, il reattivo viene spesso utilizzato in situ dopo la sintesi, senza isolarlo.[5][6] In questo caso la soluzione è semplicemente raffreddata in bagno di ghiaccio o ghiaccio secco prima di procedere all'uso del reattivo.
Una sintesi alternativa ma meno conveniente utilizza il dimetiltitanocene (reattivo di Petasis):[7]
- Cp2Ti(CH3)2 + Al(CH3)2Cl → Cp2TiCH2AlCl(CH3)2 + CH4
Lo svantaggio di questo metodo, oltre a richiedere Cp2Ti(CH3)2, sta nella difficoltà di separare il prodotto dal reagente iniziale non reagito.
Meccanismo di reazione
[modifica | modifica wikitesto]Il reattivo di Tebbe come tale non reagisce con i composti carbonilici, ma deve prima essere trattato con una base di Lewis, tipo la piridina, in modo da generare il carbene di Schrock attivo:
Analogamente al reattivo di Wittig, la reattività del reattivo di Tebbe è imputabile alla forte propensione del titanio(IV) a legarsi con l'ossigeno. Si è postulato che il carbene di Schrock (1) reagisca con i composti carbonilici (2) formando un intermedio di tipo ciclobutanico (3). Tale intermedio non è mai stato isolato, presumibilmente perché si dissocia immediatamente rilasciando l'alchene desiderato (5).
Ambito di applicazione
[modifica | modifica wikitesto]Il reattivo di Tebbe è usato in sintesi organica per la metilenazione del gruppo carbonile.[8][9][10] Questa conversione si può effettuare anche con una reazione di Wittig, ma il reattivo di Tebbe è più efficiente specie per carbonili stericamente ingombrati. Il reattivo di Tebbe è anche meno basico del reattivo di Wittig e non dà prodotti di β-eliminazione.
La reazione di metilenazione avviene anche con aldeidi, esteri, lattoni e ammidi. Il reattivo di Tebbe converte esteri e lattoni in eteri enolici e le ammidi in enammine. In composti contenenti gruppi sia chetone che estere, il gruppo chetone reagisce selettivamente in presenza di un equivalente del reattivo di Tebbe.
Il reattivo di Tebbe metilena il carbonile senza racemizzare un carbonio chirale in α. Per questo motivo il reattivo di Tebbe è applicato in reazioni di zuccheri quando è critico preservare la stereochimica.[11]
Il reattivo di Tebbe reagisce con cloruri acilici sostituendo il Cl− e formando enolati di titanio.
Note
[modifica | modifica wikitesto]Bibliografia
[modifica | modifica wikitesto]- (EN) I. Beadham e J. Micklefield, Reagents for Carbonyl Methylenation in Organic Synthesis, in Curr. Org. Syn., vol. 2, n. 2, 2005, pp. 231-259, DOI:10.2174/1570179053545396.
- (EN) L. F. Cannizzo e R. H. Grubbs, In situ preparation of (μ-chloro)(μ-methylene)bis(cyclopentadienyl)(dimethylaluminum)titanium (Tebbe's reagent), in J. Org. Chem., vol. 50, n. 13, 1985, pp. 2386-2387, DOI:10.1021/jo00213a040.
- (EN) R. C. Hartley, J. Li, C. A. Main e G. J. McKiernan, Titanium carbenoid reagents for converting carbonyl groups into alkenes, in Tetrahedron, vol. 63, n. 23, 2007, pp. 4825-4864, DOI:10.1016/j.tet.2007.03.015.
- (EN) W. A. Herrmann, The Methylene Bridge, in Advances in Organometallic Chemistry, vol. 20, 1982, pp. 159-263, DOI:10.1016/S0065-3055(08)60522-5.
- (EN) A. Marra, J. Esnault, A. Veyrieres e P. Sinay, Isopropenyl glycosides and congeners as novel classes of glycosyl donors: theme and variations, in J. Am. Chem. Soc., vol. 114, n. 16, 1992, pp. 6354-6360, DOI:10.1021/ja00042a010.
- (EN) J. F. Payack, D. L. Hughes, D. Cai, I. F. Cottrell e T. R. Verhoeven, Dimethyltitanocene, in Org. Synth., vol. 79, 2002, p. 19, DOI:10.15227/orgsyn.079.0019.
- (EN) S. H. Pine, G. Kim e V. Lee, Enol ethers by methylenation of esters: 1-Phenoxy-1-phenylethene and 3,4-dihydro-2-methylene-2H-1-benzopyran, in Org. Synth., vol. 69, 1990, p. 72, DOI:10.15227/orgsyn.069.0072.
- (EN) S. H. Pine, Carbonyl Methylenation and Alkylidenation Using Titanium-Based Reagents, in Org. React., vol. 43, n. 1, 2004, pp. 1-91, DOI:10.1002/0471264180.or043.01.
- (EN) D. A. Straus, M. M. Morshed, M. E. Dudley e M. M. Hossain, μ-Chlorobis(cyclopentadienyl)(dimethylaluminum)-μ-methylenetitanium, in Encyclopedia of Reagents for Organic Synthesis, John Wiley & Sons, 2001, DOI:10.1002/047084289X.rc073.pub2, ISBN 9780470842898.
- (EN) F. N. Tebbe, G. W. Parshall e G. S. Reddy, Olefin homologation with titanium methylene compounds, in J. Am. Chem. Soc., vol. 100, n. 11, 1978, pp. 3611-3613, DOI:10.1021/ja00479a061.
- (EN) R. Thompson, E. Nakamaru-Ogiso, C.-H. Chen, M. Pink e D. J. Mindiola, Structural Elucidation of the Illustrious Tebbe Reagent, in Organometallics, vol. 33, n. 1, 2014, pp. 429-432, DOI:10.1021/om401108b.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Reattivo di Tebbe
Wikimedia Commons contiene immagini o altri file su Reattivo di Tebbe