Pila di Volta

La pila di Alessandro Volta fu il primo generatore statico di energia elettrica mai realizzato.
Inventata da Alessandro Volta nel 1799, nella sua residenza a Lazzate, essa costituisce il prototipo della batteria elettrica moderna e il primo esemplare è conservato nel Museo per la Storia dell'Università di Pavia.
Storia
[modifica | modifica wikitesto]L'invenzione della pila è il risultato di esperimenti condotti da Volta verso la fine del XVIII secolo che riprendevano studi precedenti di Luigi Galvani sull'elettricità.
Sulla prima pila, costruita nel dicembre del 1799, non si hanno informazioni precise: negli scritti di Volta non viene esposta la realizzazione di un modello concreto; piuttosto si trovano istruzioni per la costruzione di un dispositivo generico cioè in diversi modi utilizzando più di una moneta. Volta avrebbe osservato il passaggio del fluido elettrico inducendo la contrazione dei muscoli in una rana morta alla quale erano stati applicati due elettrodi collegati agli estremi della pila, un fenomeno al quale diede il nome di galvanismo.

L'invenzione venne annunciata in una lettera rivolta a Joseph Banks, presidente della Royal Society di Londra, datata 20 marzo 1800, in cui lo stesso Volta ne dà anche la prima descrizione.
Denominata inizialmente organo elettrico artificiale oppure apparato elettromotore, venne battezzata poi pila per via della sua struttura caratteristica. Questo nome è rimasto in italiano a designare genericamente tutte le batterie per apparecchi elettrici, indipendentemente dalla loro forma.
La pila valse a Volta fama e onori internazionali: il 7 novembre 1801 ne illustrò il funzionamento all'Institut de France a Parigi di fronte a Napoleone Bonaparte, che in tale occasione lo insignì di una medaglia d'oro e lo propose per un cospicuo premio in denaro.
Descrizione
[modifica | modifica wikitesto]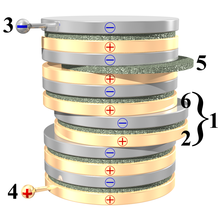
1. un elemento della pila;
2. strato di rame; 3. contatto negativo; 4. contatto positivo; 5. feltro o cartone imbevuto in soluzione acquosa (acqua e acido solforico);
6. strato di zinco.
La pila di Alessandro Volta è costituita fondamentalmente da una colonna di più elementi simili sovrapposti, i cosiddetti elementi voltaici, consistenti in dischi di zinco alternati a dischi di rame e separati da uno strato intermedio di feltro o cartone imbevuto in acqua salata (buon conduttore). Al posto del rame è possibile usare anche l'argento; al posto dello zinco si può usare lo stagno.
Collegando gli estremi superiore e inferiore della pila per mezzo di un conduttore elettrico si crea un circuito nel quale passa corrente continua.
Per avere un flusso di cariche elettriche occorre mantenere una differenza di potenziale tra i due poli: a questo scopo si usano i generatori di corrente elettrica. Il primo generatore di elettricità della storia è appunto la pila.
Funzionamento
[modifica | modifica wikitesto]La pila di Alessandro Volta può essere considerata una colonna di celle galvaniche collegate in serie. Tra i due elettrodi metallici di ciascuna cella si instaura una differenza di potenziale che viene mantenuta costante da forze di natura chimica. Ogni elettrodo infatti tende a rilasciare ioni metallici positivi nella soluzione con la quale è a contatto, assumendo rispetto a essa un potenziale negativo. La differenza di potenziale fra un elettrodo e la soluzione dipende dal tipo di metallo di cui è composto l'elettrodo. Utilizzando ad esempio un disco di zinco e uno di rame come fece Volta, si misura presso lo zinco un potenziale negativo maggiore in valore assoluto rispetto a quello del rame. Collegando i due elettrodi per mezzo di un conduttore si genera un movimento di elettroni dal polo di carica negativa a quello di carica positiva (dallo zinco al rame nel caso precedente) e dunque una corrente elettrica di verso opposto.
Il movimento di elettroni nel circuito esterno della pila, tende a compensare e annullare la differenza di potenziale tra gli elettrodi e la soluzione; affinché la corrente si mantenga costante è necessario che il polo negativo venga costantemente rifornito di elettroni sottratti al polo positivo. Questo compito è affidato alla soluzione elettrolitica. Considerando per esempio una soluzione di acido solforico in acqua a contatto con elettrodi di zinco e rame, si osserva che gli ioni negativi derivanti dalla dissociazione dell'acido solforico si dirigono nell'interno della soluzione verso l'elettrodo di zinco. Gli ioni H3O+ dell'acido si dirigono invece verso l'elettrodo di rame al quale tolgono ciascuno un elettrone.
L'energia chimica che si sviluppa durante le reazioni fra i metalli e la soluzione è quella necessaria per consentire il flusso di corrente.
Ogni elemento collegato in serie contribuisce ad aumentare la tensione elettrica fra gli estremi della pila e dunque la sua forza elettromotrice.
In particolare, all'anodo di ogni elemento (in zinco) avviene la seguente semireazione di ossidazione:
alla quale compete un potenziale di elettrodo pari a −0,76 V.
Al catodo invece il rame rimane intatto (potrebbe eventualmente ridursi, ma si trova già nello stato ridotto). Questo perché lo zinco cede due elettroni e passa da Zn metallico a Zn2+, questi elettroni contrariamente a quanto si possa pensare non passano al rame, che serve solo per creare la differenza di potenziale, ma passano allo ione ossonio H3O+ formatosi dalla dissociazione ionica dell'acido solforico in acqua, che si trasforma in idrogeno molecolare gassoso H2. Alla semireazione di sviluppo di idrogeno è associata un potenziale di elettrodo pari a 0 V.
Quindi complessivamente ciascun elemento possiede un potenziale di cella di 0−(−0,76) = 0,76 V.
Siccome la pila è costituita da più celle galvaniche collegate in serie, la differenza di potenziale che si instaura ai morsetti è pari alla somma di tutti i potenziali di cella, cioè è pari al prodotto del numero di elementi collegati in serie per 0,76 V.
Importanza
[modifica | modifica wikitesto]Prima dell'invenzione della pila erano note apparecchiature come la bottiglia di Leida, che fornivano solo una scarica elettrica di durata brevissima e necessitavano di essere caricate prima di ogni uso. La pila era invece di per sé un generatore di tensione: con essa il mondo scientifico ebbe a disposizione per la prima volta uno strumento in grado di produrre corrente intensa in modo ininterrotto (perpetuo, secondo Volta), aprendo le porte alle rivoluzionarie scoperte sull'elettricità che segnarono l'Ottocento.
Nel 1800, pochi mesi dopo l'annuncio dell'invenzione, William Nicholson e Anthony Carlisle, che furono fra i primi ad apprenderne per mezzo dello stesso Banks e prima ancora che la Royal Society ne fosse messa al corrente, riprodussero la pila e se ne servirono per realizzare l'elettrolisi dell'acqua, ottenendo i gas idrogeno e ossigeno.
Humphry Davy compì accurate ricerche per mezzo della pila e giunse alla conclusione che i suoi effetti elettrici, contrariamente a quanto creduto da Volta, non erano provocati dal semplice contatto di metalli diversi, bensì da mutamenti chimici. Sperimentando con l'elettrolisi, egli riuscì fra il 1807 e il 1808 a isolare dai loro sali metalli alcalini e alcalino terrosi come sodio, potassio, bario, stronzio, calcio e magnesio.
Grazie alla pila furono anche resi possibili i primi tentativi di trasmettere segnali per mezzo del telegrafo elettrico.
Bibliografia
[modifica | modifica wikitesto]- Paolo Rossi (diretta da). Storia della scienza moderna e contemporanea. Torino, UTET, 1989. ISBN 88-02-04152-0
- Antonio Caforio, Aldo Ferilli. Physica 3. Firenze, Le Monnier, 1994. ISBN 88-00-49368-8
- Giuliano Pancaldi, Volta: Science and culture in the age of Enlightenment, Princeton, Princeton University of Press, 2013. ISBN 0-691-09685-6 [1]
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file sulla pila di Volta
Wikimedia Commons contiene immagini o altri file sulla pila di Volta
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) voltaic pile, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- La pila di Volta: un successo della scienza italiana durato duecento anni (PDF) [collegamento interrotto], su ulisse.sissa.it.
- Testo della lettera di Volta a Sir Banks, tradotto in italiano dall'originale in francese, con illustrazione, su ppp.unipv.it.
- (FR) Originale in francese del testo della lettera di Volta a Sir Banks, con illustrazione originale (PDF), su electrochem.cwru.edu. URL consultato l'11 ottobre 2012 (archiviato dall'url originale il 27 giugno 2013).
- Descrizione della Sapienza di Roma della Pila di Volta, su phys.uniroma1.it. URL consultato il 20 agosto 2010 (archiviato dall'url originale il 4 settembre 2010).
- La pila spiegata nel progetto openfisica, su openfisica.com. URL consultato il 20 agosto 2010 (archiviato dall'url originale il 14 agosto 2010).
- Come costruire una pila di Volta a tazza, su electroyou.it.
- Costruzione di una pila di Volta a colonna e altre pile (PDF), su atuttoportale.it. URL consultato l'11 ottobre 2012 (archiviato dall'url originale il 21 ottobre 2012).
- La pila di Volta e altri apparecchi elettrochimici, su funsci.com. URL consultato il 20 agosto 2010 (archiviato dall'url originale il 20 ottobre 2010).
| Controllo di autorità | GND (DE) 4708157-0 |
|---|









