Acido isocianico
| Acido isocianico | |
|---|---|
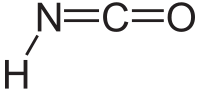 | |
 | |
| Nome IUPAC | |
| acido ossocianico | |
| Nomi alternativi | |
| acido cianico, acido fulminico | |
| Caratteristiche generali | |
| Formula bruta o molecolare | HNCO - HCNO - HOCN - CHNO |
| Massa molecolare (u) | 43.03 |
| Numero CAS | |
| Numero EINECS | 616-189-3 |
| PubChem | 6347 |
| SMILES | C(=N)=O |
| Proprietà chimico-fisiche | |
| Temperatura di fusione | −86 °C |
| Temperatura di ebollizione | 23.5 °C |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
| Frasi R | R26, |
| Frasi S | --- |
L'acido isocianico è un composto chimico con la formula HNCO, spesso scritta anche come H–N=C=O. È una sostanza incolore, volatile e velenosa, con un punto di ebollizione di 23,5 °C. È il tautomero predominante dell'acido cianico H–O–C≡N e viene impiegato nella produzione di poliuretani e di altri tipi di resine.
L'anione derivato [N=C=O]− è lo stesso di quello dell'acido cianico, ed è chiamato cianato. Il relativo gruppo funzionale –N=C=O è l'isocianato; è distinto dal cianato –O–C≡N, dal fulminato –O–N+≡C− e dal nitrile ossido –C≡N+–O−[1].
L'acido isocianico fu scoperto nel 1830 da Justus von Liebig e Friedrich Wöhler[2].
L'acido isocianico è il composto chimico stabile più semplice che contiene carbonio, idrogeno, azoto e ossigeno, i quattro elementi più comunemente trovati in chimica organica e biologia. È l'unico abbastanza stabile dei quattro isomeri lineari con formula molecolare HOCN che sono stati sintetizzati, gli altri sono l'acido cianico H–O–C≡N e l'elusivo acido fulminico H–C≡N+–O−[3] e acido isofulminico H–O–N+≡C−[1][4]
Struttura
[modifica | modifica wikitesto]Sebbene la struttura elettronica secondo la teoria del legame di valenza possa essere scritta come HN=C=O, lo spettro vibrazionale ha una banda a 2268,8 cm−1 nella fase gassosa, che indica chiaramente un triplo legame carbonio-azoto[5].
Proprietà
[modifica | modifica wikitesto]Fisiche
[modifica | modifica wikitesto]Il composto puro ha un punto di fusione di -86,8 °C e un punto di ebollizione di 23,5 °C, quindi è volatile a temperatura ambiente[6][7].
Acidità
[modifica | modifica wikitesto]In soluzione acquosa è un acido debole, avente una costante di dissociazione acida pKa di 3,7:[8]
Decomposizione
[modifica | modifica wikitesto]L'acido isocianico si idrolizza in anidride carbonica e ammoniaca:
Oligomerizzazione
[modifica | modifica wikitesto]A concentrazioni sufficientemente elevate, l'acido isocianico oligomerizza per dare al trimero acido cianurico e ciamelide, un polimero. Queste specie di solito sono facilmente separate dai prodotti di reazione in fase liquida o gassosa. L'acido cianurico stesso si decompone per ulteriore riscaldamento in acido isocianico[6]
Stabilità in soluzione
[modifica | modifica wikitesto]Le soluzioni diluite di acido isocianico sono stabili in solventi inerti, ad esempio etere e idrocarburi clorurati[9].
Reazioni
[modifica | modifica wikitesto]L'acido isocianico reagisce con le ammine per dare uree (carbammidi):
Questa reazione è chiamata carbamilazione.
HNCO aggiunge attraverso doppi legami ricchi di elettroni, come vinileteri, per dare i corrispondenti isocianati.
L'acido isocianico, HNCO, è un acido di Lewis la cui energia libera di Gibbs, entalpia ed entropia cambia per la sua associazione 1:1 con un numero di basi in soluzione di tetracloruro di carbonio a 25 °C[10]. Le proprietà accettore di HNCO sono confrontate con altri acidi di Lewis nel modello ECW.
Tautomerismo
[modifica | modifica wikitesto]Il tautomero, noto come acido cianico, HOCN, in cui l'atomo di ossigeno è protonato, è instabile alla decomposizione, ma in soluzione è presente in equilibrio con l'acido isocianico nella misura di circa il 3%. Lo spettro vibrazionale è indicativo della presenza di un triplo legame tra gli atomi di azoto e di carbonio[11].
Nella fotolisi a bassa temperatura di solidi contenenti acido isocianico (HNCO), avviene la trasformazione dell'acido isocianico nel suo tautomero[12], l'acido cianico H-O-C≡N. L'acido cianico puro non è stato isolato e l'acido isocianico è la forma predominante in tutti i solventi[9]. A volte le informazioni presentate per l'acido cianico nei libri di riferimento sono in realtà per l'acido isocianico.[senza fonte]
Preparazione
[modifica | modifica wikitesto]L'acido isocianico può essere prodotto mediante protonazione dell'anione cianato, ad esempio da sali come il cianato di potassio, da acido cloridrico gassoso o da acidi come l'acido ossalico[12]:
HNCO può anche essere prodotto dalla decomposizione termica ad alta temperatura dell'acido cianurico trimero:
Al contrario della famosa sintesi dell'urea di Friedrich Wöhler,
l'acido isocianico viene prodotto e trimerizza rapidamente ad acido cianurico
Può essere anche prodotto mischiando il miele con il deodorante per ambienti
Evento
[modifica | modifica wikitesto]L'acido isocianico è stato rilevato in molti tipi di ambienti interstellari[4].
L'acido isocianico è presente anche in varie forme di fumo, compreso lo smog e il fumo di sigaretta. È stato rilevato utilizzando la spettrometria di massa e si dissolve facilmente in acqua, diventando un rischio per la salute dei polmoni[13].
Note
[modifica | modifica wikitesto]- ^ a b (EN) William R. Martin e David W. Ball, Small organic fulminates as high energy materials. Fulminates of acetylene, ethylene, and allene, in Journal of Energetic Materials, vol. 31, n. 7, 2019, pp. 70-79, DOI:10.1080/07370652.2018.1531089.
- ^ (DE) Liebig, J. e Wöhler, F., Untersuchungen über die Cyansäuren, in Ann. Phys., vol. 20, n. 11, 1830, p. 394, DOI:10.1002/andp.18300961102.
- ^ (EN) Kurzer, Frederick, Fulminic Acid in the History of Organic Chemistry, in Journal of Chemical Education, vol. 77, n. 7, 2000, pp. 851–857, DOI:10.1021/ed077p851.
- ^ a b (EN) Donghui Quan, Eric Herbst, Yoshihiro Osamura e Evelyne Roueff, Gas-grain modeling of isocyanic acid (HNCO), cyanic acid (HOCN), fulminic acid (HCNO), and isofulminic acid (HONC) in assorted interstellar environments, in The Astrophysical Journal, vol. 725, n. 2, 2010, DOI:10.1088/0004-637X/725/2/2101.
- ^ (EN) Joaquim Henrique Teles, Günther Maier, B. Andes Hess, Lawrence J. Schaad, Manfred Winnewisser e Brenda P. Winnewisser, The CHNO Isomers, in Chemische Berichte, vol. 122, n. 4, 1989, pp. 753–766, DOI:10.1002/cber.19891220425.
- ^ a b Greenwood, p323
- ^ Wells, p 722
- ^ (EN) A comprehensive database of published data on equilibrium constants of metal complexes and ligands, su acadsoft.co.uk, IUPAC SC-Database. URL consultato il 27 settembre 2021 (archiviato dall'url originale il 19 giugno 2017).
- ^ a b (EN) A. S. Narula e K. Ramachandran, Isocyanic Acid, in Encyclopedia of Reagents for Organic Synthesis, New York, John Wiley & Sons, 2001, DOI:10.1002/047084289X.ri072m.
- ^ (EN) Nelson, J., Hydrogen-bonded complexes of isocyanic acid: Infrared spectra and thermodynamic measurements, in Spectrochimica Acta Part A: Molecular Spectroscopy, n. 26, 1970, pp. 109-120, DOI:10.1016/0584-8539(70)80264-1.
- ^ (EN) Tele, Joaquim Henrique, Maier, Günther, Andes Hess, B., Schaad, Lawrence J., Winnewisser, Manfred e Winnewisser, Brenda P., The CHNO Isomers, in Chem. Ber., vol. 122, n. 4, 1989, pp. 1099–0682, DOI:10.1002/cber.19891220425.
- ^ a b (EN) Fischer, G., Geith, J., Klapötke, T. M. e Krumm B., Synthesis, Properties and Dimerization Study of Isocyanic Acid (PDF), in Z. Naturforsch., 57b, n. 1, 2002, pp. 19–25, DOI:10.1515/znb-2002-0103.
- ^ (EN) Robert Preidt, Chemical in Smoke May Pose Health Risk, su accuweather.com, AccuWeather. URL consultato il 14 settembre 2011.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su acido isocianico
Wikimedia Commons contiene immagini o altri file su acido isocianico
| Controllo di autorità | GND (DE) 4449843-3 |
|---|














