Indice
Precipitazione (chimica)

In chimica il termine precipitazione indica il fenomeno della separazione sotto forma di solido di un soluto (detto precipitato) che si trova in una soluzione in concentrazione maggiore del suo limite di solubilità,[1] per cui la soluzione, prima che sopraggiunga la precipitazione, si trova in condizioni di sovrasaturazione rispetto a tale soluto.
Tale separazione può avvenire a seguito di una reazione chimica (che aumenta la concentrazione di soluto all'interno della soluzione, fino al superamento del limite di solubilità) o per una variazione delle condizioni fisiche della soluzione - ad esempio, la temperatura (che determina una variazione della concentrazione massima di soluto che la soluzione è in grado di sciogliere).
Nelle equazioni chimiche il precipitato è evidenziato con una freccia che punta verso il basso (↓).
Meccanismo della precipitazione
[modifica | modifica wikitesto]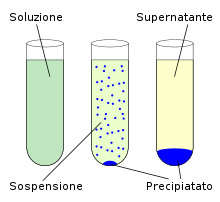
Quando la concentrazione di soluto nel solvente supera il limite di solubilità, il soluto inizia a cristallizzare. La cristallizzazione avviene in due fasi: nucleazione e accrescimento.
La nucleazione consiste nella formazione di microcristalli di soluto, appunto dei "nuclei" di cristallizzazione, che rimangono in sospensione a causa delle loro dimensioni ridotte. Un ulteriore aumento della concentrazione del soluto provoca la formazione di nuovi nuclei e l'accrescimento dei nuclei già esistenti, che danno così origine a cristalli. I cristalli scendono verso il fondo del recipiente dove la soluzione è contenuta e il loro accrescimento può continuare anche durante la discesa o dopo avere raggiunto il fondo.
È possibile che a causa di un'elevata soprassaturazione, la nucleazione prevalga sull'accrescimento, formando in tal caso un colloide, che è inseparabile mediante ordinari mezzi fisici dal resto della soluzione. Una soluzione colloidale è piuttosto stabile. A causa della presenza del doppio strato elettrico attorno a ciascun microcristallo di soluto, ciascun microcristallo è circondato da particelle di carica uguale, per cui tali microcristalli si respingono e non hanno la possibilità di coalescere e rimangono dunque in sospensione.
Talvolta può capitare che con l'aggiunta di un elettrolita si vada incontro alla formazione di un precipitato fioccoso o caseoso. La formazione di un precipitato fioccoso viene detta anche coagulazione o flocculazione e avviene quando si forma una sostanza idrofila, quindi nel reticolo cristallino della sostanza vengono intrappolate molecole d'acqua. La formazione di un precipitato caseoso avviene invece quando si forma una sostanza idrofoba.
Coprecipitazione
[modifica | modifica wikitesto]Assieme al fenomeno della precipitazione può avvenire anche il fenomeno (in genere indesiderato) della coprecipitazione che consiste nel introdurre un'impurità nel precipitato; tali impurità determinano delle interferenze quando si effettua un'analisi.
La coprecipitazione può avvenire per:
- adsorbimento di ioni estranei sulla superficie del precipitato principale;
- inclusione nel precipitato di composti estranei;
- occlusione in cavità che si formano nel precipitato durante l'accrescimento, di sostanze e ioni estranei.
Postprecipitazione
[modifica | modifica wikitesto]La postprecipitazione è un altro fenomeno che può interferire nell'analisi e consiste nella precipitazione di sostanze aventi uno ione in comune col precipitato principale sulla sua superficie.
Invecchiamento
[modifica | modifica wikitesto]L'invecchiamento del precipitato si ha quando il precipitato rimane troppo tempo nella soluzione madre oppure rimane a contatto con sostanze ossidanti o riducenti. Esso consiste nella modificazione della struttura o della composizione del precipitato.
Applicazioni
[modifica | modifica wikitesto]In laboratorio
[modifica | modifica wikitesto]La formazione di precipitati è alla base dei saggi a umido dell'analisi chimica qualitativa, in cui la verifica della presenza di un dato ione o gruppo funzionale viene resa evidente dalla comparsa di un precipitato a seguito del trattamento con un opportuno reagente - ad esempio, l'uso del nitrato d'argento per evidenziare la presenza di cloruri, bromuri e ioduri.
Nell'analisi gravimetrica, per far aggregare il precipitato in modo da filtrarlo più agevolmente, lo si fa bollire lentamente per 15-20 minuti (digestione).
Nell'industria
[modifica | modifica wikitesto]A livello industriale, il fenomeno della precipitazione prende parte in diversi processi di separazione fluido[2]-solido in presenza di un campo di forze.
Più precisamente, se il campo di forze responsabile della separazione è la forza di gravità, si parla di sedimentazione o decantazione, mentre se il campo di forze è quello elettrostatico, si parla di precipitazione elettrostatica.
La precipitazione ha un ruolo fondamentale anche nell'ambito dei processi di cristallizzazione e evaporazione, permettendo la separazione e il recupero della fase solida.
Precipitazione biotica
[modifica | modifica wikitesto]
Si parla di precipitazione biotica quando il processo di precipitazione viene svolto da un organismo vivente. Un esempio è il carbonato di calcio nello scheletro dei coralli marini o nel guscio di alcuni molluschi. In questo caso gli ioni di calcio e carbonato precipitano dall'acqua all'interno dell'organismo a formare la sua parte calcarea.
Note
[modifica | modifica wikitesto]- ^ (EN) IUPAC Gold Book, "precipitation"
- ^ Da notare che nella definizione chimica la "precipitazione" si riferisce al caso di solventi liquidi, mentre nel caso della definizione ingegneristica ci si può riferire anche a solventi gassosi.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikizionario contiene il lemma di dizionario «precipitazione»
Wikizionario contiene il lemma di dizionario «precipitazione» Wikimedia Commons contiene immagini o altri file su precipitazione
Wikimedia Commons contiene immagini o altri file su precipitazione
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) chemical precipitation / precipitation reaction, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 56141 · LCCN (EN) sh85106216 · BNF (FR) cb119667025 (data) · J9U (EN, HE) 987007533809005171 · NDL (EN, JA) 00573050 |
|---|











