| Ossido arsenioso | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| triossido di diarsenico | |
| Nomi alternativi | |
| triossido di arsenico,anidride arseniosa, sesquiossido di arsenico, arsenico bianco, ossido di arsenico(III)[1] | |
| Caratteristiche generali | |
| Formula bruta o molecolare | As2O3 |
| Massa molecolare (u) | 197,84 |
| Aspetto | solido bianco cristallino |
| Numero CAS | |
| Numero EINECS | 215-481-4 |
| PubChem | 261004 e 58886963 |
| DrugBank | DBDB01169 |
| SMILES | O=[As]O[As]=O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 3,865 (arsenolite) 4,15 (claudetite)[1] |
| Solubilità in acqua | 17 g/L a 16 °C[1] |
| Temperatura di fusione | 275 °C (527 °F) (arsenolite)[1] |
| Temperatura di ebollizione | 460 °C (860 °F)[1] |
| Sistema cristallino | polimorfo |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | –1313,9 (arsenolite)[2] |
| S0m(J·K−1mol−1) | 214 (arsenolite)[2] |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | 14,6 oral rat[1] |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
   
| |
| pericolo | |
| Frasi H | 300 - 314 - 350 - 410 [1] |
| Consigli P | 201 - 280 - 301+310 - 330 - 303+361+353 - 304+340 - 305+351+338 - 308+313 [1] |
L'anidride arseniosa o triossido di diarsenico è un composto inorganico con formula As2O3, dove l'arsenico ha numero di ossidazione +3. Questo ossido è il composto commercialmente più importante dell'arsenico, usato come base di partenza per altri composti dell'arsenico, compresi i composti organoarsenicali. Nel 1991 ne sono state prodotte quasi 50000 tonnellate.[3] Molte sue applicazioni sono controverse data l'alta tossicità dei composti dell'arsenico.
Struttura
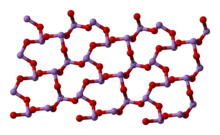
[modifica | modifica wikitesto]Il composto dà luogo a due modificazioni cristalline, che si osservano anche nei due minerali arsenolite e claudetite. La forma più comune è la arsenolite che ha struttura cristallina cubica; consiste di dimeri As4O6, isostrutturali con P4O6, disposti con un arrangiamento tipo diamante.[4][5] Per riscaldamento si ottiene la forma monoclina claudetite, che consiste di strati di piramidi AsO3 che condividono gli atomi di ossigeno.[4] In fase gassosa esistono molecole As4O6 che sopra gli 800 °C iniziano a dissociarsi formando il monomero As2O3. La condensazione del vapore al di sotto dei 250 °C dà arsenolite mentre al di sopra di questa temperatura si forma As2O3 vetroso.[3][4]
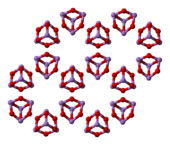
|

|
|
arsenolite (cubica) |
claudetite I (monoclina) |
claudetite II
(monoclina) |
Sintesi
[modifica | modifica wikitesto]
Industrialmente la maggior parte del triossido di arsenico viene ottenuto come sottoprodotto da minerali arsenicali che vengono trattati con lo scopo principale di ricavare metalli pregiati presenti in piccole quantità. I minerali più usati sono arsenopirite (FeAsS) e löllingite (FeAs2). Il minerale viene arrostito in condizioni accuratamente controllate in modo da formare composti volatili dell'arsenico, evitando di formare composti come As2O5 o arseniati, che rimarrebbero nel materiale arrostito. È importante ottenere un residuo con un basso tenore di arsenico, in modo da semplificare i trattamenti successivi dei residui, dai quali si ricavano metalli preziosi come argento, oro e rame, ma anche nichel, cobalto, piombo. I composti volatili contenenti arsenico vengono condensati, separati e trattati ulteriormente con tecniche diverse a seconda della effettiva composizione, fino ad arrivare a As2O3 al 95-99%. Solo in Cina i minerali arsenicali sono trattati con lo scopo principale di ottenere arsenico.[3]
In laboratorio il triossido di arsenico si può preparare bruciando arsenico elementare, o per idrolisi del tricloruro di arsenico:[4][6]
Reattività
[modifica | modifica wikitesto]Il triossido di arsenico è un ossido anfotero, poco solubile in acqua, dove forma soluzioni debolmente acide contenenti principalmente la specie As(OH)3. Questa specie non è mai stata isolata, ma si prevede che abbia una struttura piramidale. In ambiente alcalino la solubilità è maggiore, e per successiva deprotonazione di As(OH)3 a seconda del pH si formano le specie [AsO(OH)2]–, [AsO2(OH)]2– e [AsO3]3–.[4]
Con HF e HCl anidri reagisce formando rispettivamente AsF3 e AsCl3:[6]
Il triossido di arsenico deve essere trattato con ossidanti molto forti come ozono, perossido di idrogeno e acido nitrico per riuscire a ottenere il pentossido di arsenico o l'acido corrispondente:[6]
Il triossido di arsenico è quindi più resistente all'ossidazione del congenere triossido di fosforo, che per semplice riscaldamento brucia all'aria formando pentossido di fosforo.
Per riduzione di As2O3 si ottiene arsenico elementare o arsina (AsH3) a seconda delle condizioni usate.[6] Questa reazione è stata utilizzata in passato nel saggio di Marsh per determinare tracce di arsenico.
Usi
[modifica | modifica wikitesto]Il triossido di arsenico è usato su larga scala come materiale di partenza per la produzione di preservanti per il legno come l'arseniato di rame. Questi preservanti sono largamente usati negli Stati Uniti d'America e in Malaysia, ma questo utilizzo è controverso e vietato in molte altre nazioni.[3]
È inoltre usato per produrre erbicidi e insetticidi, nella conservazione delle pelli, come decolorante nell'industria del vetro, per preparare arsenico elementare e altri composti dell'arsenico, nell'industria elettronica.[3][5] Nel passato era usato per ottenere il pigmento verde di Parigi e il farmaco Neosalvarsan.
Il triossido di arsenico ha il pregio di essere uno standard primario e per questo viene utilizzato in chimica analitica per standardizzare gli ossidanti usati in volumetria.[5]
Applicazioni in medicina
[modifica | modifica wikitesto]Nonostante la tossicità dell'arsenico sia ben nota, il triossido di arsenico è stato utilizzato in medicina a partire dalla medicina tradizionale cinese, dove è noto come Pi Shuang ed è ancora usato per curare il cancro e altre malattie.[7] In omeopatia è chiamato arsenicum album. Il triossido di arsenico era contenuto in varie specialità medicinali risultate in seguito inefficaci o pericolose, come la soluzione di Fowler.[8]
Nel 1970 alcuni ricercatori cinesi hanno studiato se il triossido di arsenico usato nella medicina tradizionale cinese potesse essere impiegato nel trattamento della leucemia promielocitica acuta.[9] In seguito, studi di ricercatori sia cinesi che occidentali portarono allo sviluppo del farmaco Trisenox, che nel 2000 fu approvato dalla Food and Drug Administration (FDA) per il trattamento della leucemia.[10] Con il nome depositato Trisenox il triossido di arsenico è un chemioterapico approvato dalla FDA per i casi di leucemia promielocitica acuta che non rispondono a farmaci d'elezione come la tretinoina. È stato dimostrato che il triossido di arsenico induce apoptosi nelle cellule cancerose. Questo medicinale implica rischi significativi, data la tossicità dell'arsenico.[11][12] L'uso combinato di triossido di arsenico e tretinoina è stato approvato dalla FDA per il trattamento di alcuni tipi di leucemia.[13] All'Università di Hong Kong è stato anche sviluppato un farmaco contenente triossido di arsenico che può essere somministrato per via orale anziché endovenosa.[14]
Tossicologia
[modifica | modifica wikitesto]Le proprietà tossiche del triossido di arsenico sono leggendarie e trattate estesamente in letteratura.[15][16][17] Il triossido di arsenico viene assorbito rapidamente dal sistema digestivo. Sono noti anche effetti tossici per inalazione o contatto cutaneo. L'eliminazione è inizialmente rapida, con emivita di 1-2 giorni, in seguito a metilazione per formare acido monometilarsonico e acido dimetilarsonico, che vengono escreti con le urine. Tuttavia una certa quantità, che può essere il 30-40% in caso di esposizione ripetuta, viene incorporata in ossa, muscoli, pelle, capelli e unghie (tutti tessuti ricchi di cheratina) e viene eliminata in settimane o mesi.
I primi sintomi di avvelenamento acuto da arsenico sono a livello digestivo: vomito, dolori addominali, diarrea spesso accompagnata da sanguinamento. Dosi sub-letali possono dare convulsioni, problemi cardiovascolari, infiammazioni al fegato e ai reni, e anomalie nella coagulazione sanguigna. In seguito appaiono caratteristiche striature bianche sulle unghie (linee di Mees) e si ha caduta di capelli. Dosi minori provocano problemi a fegato e reni e variazioni della pigmentazione cutanea. Soluzioni anche diluite di triossido di arsenico sono pericolose per contatto con gli occhi.
L'avvelenamento cronico da arsenico è noto come arsenicosi. Questa patologia colpisce operai di fonderia, persone che bevono acqua potabile contenente quantità elevate di arsenico (0,3-0,4 ppm), e pazienti sottoposti a lunghi trattamenti con farmaci arsenicali. Studi su lavoratori in fonderie di rame di Stati Uniti, Giappone e Svezia indicano per i lavoratori più esposti un rischio di tumori ai polmoni 6–10 volte maggiore rispetto alla popolazione normale. L'ingestione per lunghi periodi di triossido di arsenico da acqua potabile o da medicinali può provocare tumori alla pelle. Si sono anche osservati problemi riproduttivi in uno studio su donne esposte a polveri di triossido di arsenico dato che erano impiegate o vivevano nei pressi di fonderie di rame.
In Austria esistono i cosiddetti "mangiatori d'arsenico di Stiria", persone che ingeriscono senza alcun problema apparente triossido di arsenico in dosi ben maggiori della dose letale.[17][18][19][20]
Note
[modifica | modifica wikitesto]- ^ a b c d e f g h GESTIS.
- ^ a b Doa98
- ^ a b c d e Grund e Hanusch 2002
- ^ a b c d e Greenwood e Earnshaw 1997
- ^ a b c Patnaik 2003
- ^ a b c d Brauer 1963
- ^ Gielen e Tiekink 2008, p. 298.
- ^ Gibaud e Jaouen 2010
- ^ Rao et al. 2013
- ^ Bian et al. 2012
- ^ Soignet et al. 2001
- ^ Antman 2001
- ^ Zhu et al. 2002
- ^ Au et al. 2003
- ^ Emsley 2005
- ^ Flaubert 1856
- ^ a b Whorton 2011
- ^ New York Times 1885
- ^ Allesch 1959
- ^ Przygoda et al. 2001
Bibliografia
[modifica | modifica wikitesto]- (DE) R. M. Allesch, Arsenik. Seine Geschichte in Österreich, in Archiv für vaterländische Geschichte und Topographie, vol. 54, Klagenfurt, Kleinmayr, 1959.
- (EN) K. H. Antman, Introduction: The history of arsenic trioxide in cancer therapy, in Oncologist, vol. 6, Supplement 2, 2001, pp. 1-2, PMID 11331433.
- (EN) W.-Y. Au, C. R. Kumana, M. Kou e altri, Oral arsenic trioxide in the treatment of relapsed acute promyelocytic leukemia, in Blood, vol. 102, n. 1, 2003, pp. 407–408, DOI:10.1182/blood-2003-01-0298.
- I. Bertini e F. Mani, Chimica Inorganica, CEDAM, ISBN 88-13-16199-9.
- (EN) Z. Bian, S. Chen, C. Cheng, J. Wang, H. Xiao e H. Qin, Developing new drugs from annals of Chinese medicine, in Acta Pharmaceutica Sinica B, vol. 2, n. 1, 2012, pp. 1-7, DOI:10.1016/j.apsb.2011.12.007.
- (EN) G. Brauer, Handbook of preparative inorganic chemistry, vol. 1, 2ª ed., New York, Academic Press, 1963, ISBN 0-323-16127-8.
- (EN) G. O. Doak, G. G. Long e L. D. Freedman, Arsenic compounds, in Kirk-Othmer Encyclopedia of Chemical Technology, 4ª ed., John Wiley & Sons, 1998.
- (EN) J. Emsley, Arsenic, in The elements of murder, Oxford, Oxford University Press, 2005, ISBN 0-19-280599-1.
- Gustave Flaubert, Madame Bovary, 1856.
- GESTIS, Diarsenic trioxide, su gestis-en.itrust.de. URL consultato il 17 novembre 2015. Pagina del triossido di arsenico nel data base GESTIS.
- (EN) S. Gibaud e G. Jaouen, Arsenic-Based Drugs: From Fowler's Solution to Modern Anticancer Chemotherapy, in Topics in Organometallic Chemistry, vol. 32, 2010, pp. 1–20, DOI:10.1007/978-3-642-13185-1_1.
- (EN) M. Gielen e E. R. Tiekink (a cura di), Metallotherapeutic Drugs and Metal-Based Diagnostic Agents: The Use of Metals in Medicine, Wiley, 2008, ISBN 0-470-86403-6.
- (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- (EN) S. C. Grund e K. Hanusch, Arsenic and arsenic compounds, in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, 2002, DOI:10.1002/14356007.a03_113.
- (EN) Arsenic Eaters, in New York Times, 26 luglio 1885.
- (EN) P. Patnaik, Handbook of inorganic chemicals, New York, McGraw-Hill, 2003, ISBN 0-07-049439-8.
- (EN) G. Przygoda, J. Feldmann e W. R. Cullen, The arsenic eaters of Styria: a different picture of people who were chronically exposed to arsenic, in Applied Organometallic Chemistry, vol. 15, n. 6, 2001, pp. 457–462, DOI:10.1002/aoc.126.
- (EN) Y. Rao, R. Li e D. Zhang, A drug from poison: how the therapeutic effect of arsenic trioxide on acute promyelocytic leukemia was discovered, in Sci. China Life Sci., vol. 56, n. 6, 2013, pp. 495–502, DOI:10.1007/s11427-013-4487-z.
- (EN) S. L. Soignet, S. R. Frankel, D. Douer e altri, United States multicenter study of arsenic trioxide in relapsed acute promyelocytic leukemia, in J. Clin. Oncol., vol. 19, n. 18, 2001, pp. 3852-60, PMID 11559723.
- (EN) J. C. Whorton, The Arsenic Century: How Victorian Britain was Poisoned at Home, Work, and Play, 1ª ed., Oxford University Press, 2011, ISBN 978-0-19-960599-6.
- (EN) J. Zhu, Z. Chen, V. Lallemand-Breitenbach e H. De Thé, How acute promyelocytic leukaemia revived arsenic, in Nature Reviews Cancer, vol. 2, n. 9, 2002, pp. 705–714, DOI:10.1038/nrc887.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su ossido arsenioso
Wikimedia Commons contiene immagini o altri file su ossido arsenioso













