| Prioni | |
|---|---|
 | |
| Classificazione filogenetica | |
| (clade) | (Mundus) Biota |
| (clade) | (Arborea) Terroa |
| (clade) | (Superimpero) Aribosa |
| (clade) | (Impero) Prioni |
| Classificazione classica | |
Un prione (dall'inglese prion, acronimo di Proteinaceous infective-only particle, particella proteica puramente infettiva) è una molecola di natura proteica, un isomero conformazionale di una glicoproteina, con la capacità di trasmettere la propria forma mal ripiegata a varianti normali della stessa proteina.[1][2][3]
Il nome fu attribuito da Stanley B. Prusiner. PrPres, proteina prionica resistente alle proteasi, e PrPsc, proteina della scrapie, sono la forma alterata di una proteina presente nei mammiferi tra cui l'uomo (PrPsen, proteina sensibile alle proteasi, e PrPc, proteina cellulare), in tutti gli organi, ma in particolare sulle cellule del tessuto nervoso.
Essendo una glicoproteina, non è un virus o un microrganismo ed è quindi privo di acidi nucleici e conseguentemente dell'informazione genetica basata su di essi.[4]
Per tutte le sue ricerche, che ancora continuano, Prusiner fu insignito del Premio Nobel per la medicina nel 1997.
Storia
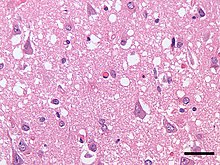
[modifica | modifica wikitesto]Il suo isolamento avvenne grazie alla decennale ricerca del neurobiologo californiano Prusiner e collaboratori nel campo delle cosiddette "neuropatie spongiformi", malattie nervose degenerative caratterizzate dalla presenza in determinate aree cerebrali di gruppi di neuroni intensamente vacuolizzati e di placche amiloidi "tipo Alzheimer" con assenza di ogni reazione infiammatoria.
Prima di capire che fossero i prioni i responsabili di tali patologie, alcuni scienziati ipotizzarono erroneamente il coinvolgimento di un virino, cioè un acido nucleico avvolto o associato a una proteina la cui esistenza è a oggi smentita, altri di un viroide, cioè un virus atipico costituito esclusivamente da un frammento di RNA.
Negli anni '50, Carleton Gajdusek iniziò una ricerca, per la quale alla fine vinse il premio Nobel nel 1976, che dimostrò che il kuru poteva essere trasmesso agli scimpanzé da quello che forse era un nuovo agente infettivo.
Le ipotesi di John Stanley Griffith
[modifica | modifica wikitesto]Negli anni '60, due ricercatori londinesi, la radiobiologa Tikvah Alper e il biofisico John Stanley Griffith e collaboratori dell'Hammersmith Institute di Londra, svilupparono l'ipotesi che le encefalopatie spongiformi trasmissibili fossero causate da un agente infettivo costituito esclusivamente da proteine.[5][6]
Indagini precedenti di E.J. Field su scrapie e kuru avevano trovato prove del trasferimento di polipeptidi patologicamente inerti che diventavano infettanti solo dopo il trasferimento nel nuovo ospite.[7][8] Alper e Griffith volevano anche essere i titolari della scoperta che il misterioso agente infettivo che causa le malattie della scrapie e della malattia di Creutzfeldt-Jakob resisteva alle radiazioni ionizzanti.[9]
Griffith ha proposto tre modi in cui una proteina potrebbe diventare un agente patogeno:[6] nella prima ipotesi, ha suggerito che se la proteina è il prodotto di un gene normalmente soppresso e l'introduzione della stessa risvegliasse il gene dormiente, allora il risultato sarebbe un processo indistinguibile dalla replicazione, poiché l'espressione del gene produrrebbe la proteina, che poi risveglierebbe il gene in altre cellule. La seconda ipotesi costituisce la base della moderna teoria dei prioni e propone che una forma anormale di una proteina cellulare può convertire proteine normali dello stesso tipo nella forma anormale, portando così alla replicazione. La sua terza ipotesi proponeva che l'agente potesse essere un anticorpo se l'anticorpo stesso fosse il proprio bersaglio, poiché un tale anticorpo comporterebbe la produzione di un numero sempre maggiore di anticorpi contro se stesso. Tuttavia, Griffith ha riconosciuto che questa terza ipotesi era improbabile a causa della mancanza di una risposta immunitaria rilevabile.[10]
Francis Crick ha riconosciuto il potenziale significato dell'ipotesi della proteina di Griffith per la propagazione della scrapie nella seconda edizione del suo Central dogma of molecular biology (1970): pur affermando che il flusso di informazioni di sequenza da proteina a proteina, o RNA e DNA erano "preclusi", ha notato che l'ipotesi di Griffith era una potenziale contraddizione.[11] L'ipotesi rivista è stata successivamente formulata, in parte, per accogliere la trascrizione inversa (che Temin e Baltimore scoprirono nel 1970).[12]
Le ricerche di Prusiner
[modifica | modifica wikitesto]Prusiner cominciò a interessarsi a queste malattie a partire dal 1972, venendo a conoscenza della teoria di Alper. A tal proposito lo scienziato statunitense dimostrò che gli agenti patogeni delle encefalopatie spongiformi trasmissibili risultavano invariati se esposti ad agenti fisici quali calore, radiazioni ionizzanti e ad agenti chimici (aldeidi e acidi forti). Ne concluse che questi agenti infettivi mostravano forme di resistenza a tutti i processi di degradazione degli acidi nucleici ma non ai fenomeni di proteolisi.
Dal 1974 cominciò un lungo lavoro per la purificazione dell'agente della scrapie da estratti di cervelli di criceti infetti, che si concluse nel 1982 con l'annuncio che tale agente risultava essere esclusivamente di natura proteica.
Per un certo periodo la comunità scientifica ignorò le ricerche di Prusiner, finché egli nel 1984 scoprì che il gene della proteina prionica era naturalmente presente nel genoma del criceto e probabilmente di tutti i mammiferi.
Caratteristiche fisico-chimiche
[modifica | modifica wikitesto]A differenza di virus e batteri i prioni rimangono intatti anche in presenza di ulteriori trattamenti, come un riscaldamento alle normali temperature di sterilizzazione per oltre un'ora, a forti dosi di radiazioni ionizzanti, al trattamento con formaldeide, varechina e acqua bollente. Inoltre, pur essendo proteine, sono resistenti alla maggior parte delle proteasi, pertanto l'organismo infettato (umano e non) non ha modo di degradarli.
I prioni sono estremamente resistenti a una gamma di agenti fisici e chimici, ma risultano sensibili ai seguenti trattamenti drastici con reagenti chimici:
- ipoclorito di sodio NaClO 2% per 1 h
- idrossido di sodio NaOH 2 M in autoclave a 121 °C per 30 min.
- acido formico HCOOH 98% per 1 h
Biochimica
[modifica | modifica wikitesto]La proteina di cui sono fatti i prioni, PrP, si trova in tutto il corpo, anche negli individui sani. Tuttavia, la PrP trovata nel materiale infettante ha una struttura diversa ed è resistente alle proteasi, gli enzimi nel corpo che normalmente possono distruggere le proteine. Nell'uomo la PrPc è codificata da un solo gene, PRNP, che sta nel braccio corto del cromosoma 20.
La forma normale della proteina è chiamata PrPC, mentre la forma infettiva è chiamata PrPsc: la C si riferisce alla PrP cellulare, mentre la Sc si riferisce alla scrapie, la malattia prionica prototipo, che si verifica nelle pecore.
Mentre PrPC è strutturalmente ben definita, PrPsc è polidisperso e meno definito. La PrP può essere indotta a ripiegarsi in altre isoforme più o meno ben definite in vitro e la loro relazione con le forme patogene in vivo non è ancora chiara.
La PrPsc differisce dalla proteina naturale PrPc per la conformazione tridimensionale: la PrPc ha una struttura più aperta contenente 3 segmenti ad alfa eliche e pochi foglietti beta; la PrPsc invece ha una struttura più compatta e stabile in cui troviamo un aumento di foglietti beta.
Si ipotizza che il meccanismo di conversione conformazionale all'isoforma della scrapie sia una proteina-ligando sfuggente, ma finora non è stato identificato alcun composto del genere. Tuttavia, un ampio corpo di ricerca si è sviluppato sui candidati e sulla loro interazione con il PrPC.
Rame, zinco, manganese e nichel sono ligandi confermati di PrP. Il legame con il ligando provoca un cambiamento conformazionale con effetto sconosciuto. Il legame dei metalli pesanti alla PrP è stato collegato alla resistenza allo stress ossidativo derivante dalla tossicità dei metalli pesanti.
Proteina PrP
[modifica | modifica wikitesto]La proteina PrP è altamente conservata nei mammiferi, dando credito alle conclusioni su animali da esperimento come i topi.
Il confronto tra i primati è particolarmente simile, con una somiglianza del 92,9-99,6% nelle sequenze di amminoacidi. La struttura della proteina umana è costituita da un dominio globulare con tre α-eliche e un foglietto β antiparallelo a due filamenti, una coda NH2-terminale e una corta coda COOH-terminale.[13]
Una membrana di glicofosfatidilinositolo si ancora ai legami COOH-terminali PrP alle membrane cellulari, e questo risulta essere parte integrante della trasmissione del cambiamento conformazionale; la PrP secreta priva del componente di ancoraggio non è influenzata dall'isoforma infettiva.[14]
La sequenza primaria di PrP è 253 aminoacidi prima della modifica post-traduzionale. Le sequenze segnale nelle estremità ammino- e carbossi-terminale vengono rimosse post-traduzione, risultando in una lunghezza matura di 208 amminoacidi.
Per la PrP umana e del criceto dorato, esistono due siti glicosilati sulle eliche 2 e 3 in Asn181 e Asn197. La PrP del topo ha siti di glicosilazione Asn180 e Asn196. Esiste un legame disolfuro tra Cys179 della seconda elica e Cys214 della terza elica (numerazione PrPC umana).
L'RNA messaggero di PrP contiene una struttura a pseudonodo (pseudonodo prionico), che si pensa sia coinvolta nella regolazione della traduzione della proteina PrP.[15]
Sebbene la funzione precisa della PrP non sia ancora nota, è possibile che sia coinvolta nel trasporto del rame ionico alle cellule dall'ambiente circostante. I ricercatori hanno anche proposto ruoli per PrP nella segnalazione cellulare o nella formazione di sinapsi.[16] PrPC si attacca alla superficie esterna della membrana cellulare da una molecola di glicosilfosfatidilinositolo al suo Ser231 C-terminale.
La proteina prionica contiene cinque ripetizioni di un octapeptide con sequenza PHGGGWGQ (sebbene la prima ripetizione abbia la sequenza PQGGGGWGQ leggermente modificata, carente di istidina). Si pensa che questo generi un dominio legante il rame tramite atomi di azoto dell'istidina dell'imidazolo delle catene laterali e dell'azoto ammidico deprotonato dalla 2ª e 3ª glicina nella ripetizione. La capacità di legare il rame è, quindi, dipendente dal pH. La RMN mostra i risultati del legame con il rame in un cambiamento conformazionale all'N-terminale.
La PrPC si trova sulle membrane cellulari, comprese le componenti del sangue, di cui le piastrine costituiscono il più grande serbatoio nell'uomo.[17] Ha 209 amminoacidi (nell'uomo), un legame disolfuro, una massa molecolare di 35-36 kDa e una struttura prevalentemente alfa-elica.
Esistono diverse forme; una forma di superficie ancorata tramite glicolipidi e due forme transmembrana.[18]
La proteina normale non è sedimentabile, il che significa che non può essere separata mediante tecniche di centrifugazione.[19]
La PrPC è prontamente digerita dalla proteinasi K e può essere liberata dalla superficie cellulare in vitro dall'enzima fosfoinositide fosfolipasi C (PI-PLC), che scinde l'ancora glicolipidica glicofosfatidilinositolo.[20] È stato segnalato che la PrP svolge ruoli importanti nell'adesione cellula-cellula e nella segnalazione intracellulare in vivo e può quindi essere coinvolta nella comunicazione cellula-cellula nel cervello.[21]
Ruolo biologico
[modifica | modifica wikitesto]La funzione fisiologica della proteina prionica è ancora poco conosciuta. Mentre i dati degli esperimenti in vitro suggeriscono molti ruoli dissimili, gli studi sui topi knockout per la PrP hanno fornito solo informazioni limitate, perché questi animali mostrano solo anomalie minori. In una ricerca condotta sui topi, è stato scoperto che la scissione delle proteine PrP nei nervi periferici induce l'attivazione della riparazione della mielina nelle cellule di Schwann, e che la mancanza di proteine PrP ha causato la demielinizzazione in quelle cellule.[22]
PrP e apoptosi
[modifica | modifica wikitesto]MAVS, RIP1 e RIP3 sono proteine simili ai prioni che si trovano in altre parti del corpo; inoltre, polimerizzano in fibre amiloidi filamentose che avviano l'apoptosi nel caso di un'infezione virale per prevenire la diffusione dei virioni ad altre cellule circostanti.[23]
PrP e memoria a lungo termine
[modifica | modifica wikitesto]Una revisione del 2005 ha suggerito che la PrP può avere un ruolo nel mantenimento della memoria a lungo termine.[24]
Inoltre, uno studio del 2004 ha scoperto che i topi privi di geni per la normale proteina PrP cellulare mostrano un'alterazione del long term potentiation dell'ippocampo.[25][26]
Si è scoperto che la proteina neuronale Cytoplasmic Polyadenylation Element Binding ha una sequenza genetica simile alle proteine prioniche del lievito. La formazione di tipo prionico di CPEB è essenziale per mantenere i cambiamenti sinaptici a lungo termine associati alla formazione della memoria a lungo termine.[27]
PrP e rinnovamento delle cellule staminali
[modifica | modifica wikitesto]Un articolo del 2006 del Whitehead Institute for Biomedical Research indica che l'espressione di PrP sulle cellule staminali è necessaria per l'auto-rinnovamento del midollo osseo di un organismo.
Lo studio ha mostrato che tutte le cellule staminali ematopoietiche a lungo termine esprimono PrP sulla loro membrana cellulare e che i tessuti ematopoietici con cellule staminali PrP-null mostrano una maggiore sensibilità alla deplezione cellulare.[28]
PrP e immunità innata
[modifica | modifica wikitesto]Ci sono alcune prove che la PrP possa svolgere un ruolo nell'immunità innata, poiché l'espressione di PRNP, il gene PrP, è sovraregolata in molte infezioni virali e la PrP ha proprietà antivirali contro molti virus, incluso l'HIV.[29]
Prioni noti
[modifica | modifica wikitesto]I prioni sono attualmente considerati universalmente gli agenti responsabili delle encefalopatie spongiformi trasmissibili (TSE) dei mammiferi; sono stati inoltre individuati un prione negli uccelli e diversi prioni dei funghi. Recentemente, inoltre, sono stati scoperti alcuni prioni presenti nel batterio Clostridium botulinum, secondo quanto descritto da una ricerca pubblicata su Science.[30]
- Prioni dei mammiferi, e loro varianti
- Agente della scrapie degli ovini;
- Agente dell'encefalopatia spongiforme bovina (BSE)
- Agente dell'encefalopatia degli ungulati esotici: nyala-kudu(EUE) (cervi mulo, wapiti, kudu, orici, antilopi alcine)
- Agente dell'encefalopatia trasmissibile del visone (TME)
- Agente della malattia del deperimento cronico del cervo (CWD)
- Agente dell'encefalopatia spongiforme dei felidi (FSE) (gatto, puma, ghepardo)
- Agente dell'encefalopatia spongiforme del dromedario (CPD)
- Agenti di altre encefalopatie spongiformi (umane o animali)
- Altri agenti individuati o trasmessi sperimentalmente in topi, cavie peruviane, criceti, maiali domestici, uistitì, scimmie scoiattolo.
- Prioni degli umani
- Agente della malattia di Creutzfeldt-Jakob (MCJ, o CJD)
- Agente della nuova variante di MCJ (nvMCJ)
- Agente della malattia di Gerstmann-Sträussler-Scheinker (MGSS)
- Agente del kuru
- Agente dell'insonnia familiare fatale (IFF)
- Prioni negli uccelli
- Agente dell'encefalopatia spongiforme nello struzzo
- Prioni nei funghi
- Prione PSI+ di Saccharomyces cerevisiae
- Prione URE3 di Saccharomyces cerevisiae
- Prione RNQ/PIN+ di Saccharomyces cerevisiae
- Prione MCA+ di Saccharomyces cerevisiae
- Prione SWI+ di Saccharomyces cerevisiae
- Prione OCT+ di Saccharomyces cerevisiae
- Prione MOT3+ di Saccharomyces cerevisiae
- Prione GAR+ di Saccharomyces cerevisiae
- Prione ISP+ di Saccharomyces cerevisiae
- Prione Het-s di Podospora anserina
Patologie prioniche
[modifica | modifica wikitesto]I prioni sono causa di una serie di malattie in una varietà di organismi, tra cui l'encefalopatia spongiforme bovina (BSE, nota anche come "malattia della mucca pazza") in bovini e la malattia di Creutzfeldt-Jakob (CJD) negli esseri umani.
Tutte le malattie animali da prioni note influenzano la struttura del sistema nervoso centrale o di altri elementi neurali dei tessuti,[31] e tutte sono attualmente inguaribili e sempre letali; il decorso clinico nell'animale e nell'uomo è progressivo, irreversibile e letale, l'incubazione dura generalmente parecchi anni. La comparsa dei sintomi della suddetta patologia si manifesta precocemente.
Secondo recenti scoperte, la proteina PrPc subisce modificazione conformazionale endogena (meccanismi ancora in fase di studio, anche se si ritiene possibile il coinvolgimento di agenti chimici e radiazioni ionizzanti) che la trasforma in una proteina PrPsc patogena.
In natura la trasmissione dei prioni può essere sia verticale (madre-figlio/ereditaria), sia orizzontale (contagio). Quest'ultima è spiegata, nella maggior parte dei casi, con il cannibalismo/carnivorismo (volontario o meno), mentre è incerta in altri casi, per esempio nella scrapie.
Il problema del salto di specie è emerso con i primi casi di BSE (da pecora a bovino) nel 1986, ma soprattutto con la "nuova variante della malattia di Creutzfeldt-Jakob" (da bovino a uomo) a partire dal 1996.
Superclassificazione
[modifica | modifica wikitesto]| Mundus | Biota / Vitae / Eobiontes | Abiotic / Mineralia | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Arborea | Terroa / Terrabiota / Geobiota | (Eso-Terroan / Exobiota?) | ||||||||||||||||||||||||||||||
| Superimpero | Ribosa | Aribosa | ||||||||||||||||||||||||||||||
| Impero | Cytota | Acytota / Aphanobionta | Xenobiota | Prioni | ||||||||||||||||||||||||||||
| Dominio | Eukaryota | Prokaryota | Virii | |||||||||||||||||||||||||||||
Legenda:
- Mineralia / Abiotic[32] -fattori non viventi[33] (materia ambientale dell'ecosistema[34])
- Biota / Vitae / Eobiontes[35][36] -fattori viventi (sistemi in uno stato energetico di disequilibrio stazionario in grado di dirigere una serie di reazioni chimiche[37])
- (Arborea: Exobiota)[38] -eventuale vita extraterrestre[39];
- Arborea: Terroa / Terrabiota / Geobiota[40] -vita terrestre[41];
Note
[modifica | modifica wikitesto]- ^ Prion Strain Mutation Determined by Prion Protein Conformational Compatibility and Primary Structure, Science, 28 maggio 2010: Vol. 328 no. 5982 pp. 1154-1158 doi:10.1126/science.1187107
- ^ Gruppo Di Studio Sull’encefalopatia Spongiforme Del Bovino, Numero speciale Gruppo di studio sulla BSE (PDF), in MEDICINA VETERINARIA PREVENTIVA, Regione Piemonte -Assessorato Alla Sanità - Direzione Sanità Pubblica, 26 gennaio 2012, p. 98;103. URL consultato il 6 luglio 2017 (archiviato dall'url originale il 15 dicembre 2017).
- ^ Sandro Montefusco, Studio del ruolo funzionale e caratterizzazione strutturale del cuprocomplesso TFF1-Cu, su elea.unisa.it, 26 gennaio 2012, p. 29.
- ^ Deleault NR, Harris BT, Rees JR, Supattapone S, Formation of native prions from minimal components in vitro, in Proceedings of the National Academy of Sciences of the United States of America, vol. 104, n. 23, giugno 2007, pp. 9741–6, DOI:10.1073/pnas.0702662104, PMC 1887554, PMID 17535913. URL consultato il 28 febbraio 2010.
- ^ (EN) Tikvah Alper, W. A. Cramp e D. A. Haig, Does the Agent of Scrapie Replicate without Nucleic Acid ?, in Nature, vol. 214, n. 5090, 1967-05, pp. 764–766, DOI:10.1038/214764a0. URL consultato il 1º giugno 2021.
- ^ a b (EN) J. S. Griffith, Nature of the Scrapie Agent: Self-replication and Scrapie, in Nature, vol. 215, n. 5105, 1967-09, pp. 1043–1044, DOI:10.1038/2151043a0. URL consultato il 1º giugno 2021.
- ^ (EN) E. J. Field, Transmission experiments with multiple sclerosis: an interim report., in BMJ, vol. 2, n. 5513, 3 settembre 1966, pp. 564–565, DOI:10.1136/bmj.2.5513.564. URL consultato il 1º giugno 2021.
- ^ (EN) D.H Adams e E.J Field, THE INFECTIVE PROCESS IN SCRAPIE, in The Lancet, vol. 292, n. 7570, 1968-09, pp. 714–716, DOI:10.1016/S0140-6736(68)90754-X. URL consultato il 1º giugno 2021.
- ^ (EN) E. J. Field, F. Farmer e E. A. Caspary, Susceptibility of Scrapie Agent to Ionizing Radiation, in Nature, vol. 222, n. 5188, 1969-04, pp. 90–91, DOI:10.1038/222090a0. URL consultato il 1º giugno 2021.
- ^ Prions, the Protein Hypothesis, and Scientific Revolutions, su researchgate.net, pp. 21-60.
- ^ (EN) Francis Crick, Central Dogma of Molecular Biology, in Nature, vol. 227, n. 5258, 1970-08, pp. 561–563, DOI:10.1038/227561a0. URL consultato il 1º giugno 2021.
- ^ (EN) John M. Coffin e Hung Fan, The Discovery of Reverse Transcriptase, in Annual Review of Virology, vol. 3, n. 1, 29 settembre 2016, pp. 29–51, DOI:10.1146/annurev-virology-110615-035556. URL consultato il 1º giugno 2021.
- ^ (EN) Hermann M. Schätzl, Maria Da Costa e Leslie Taylor, Prion Protein Gene Variation Among Primates, in Journal of Molecular Biology, vol. 245, n. 4, 1995-01, pp. 362–374, DOI:10.1006/jmbi.1994.0030. URL consultato il 1º giugno 2021.
- ^ (EN) B. Chesebro, Anchorless Prion Protein Results in Infectious Amyloid Disease Without Clinical Scrapie, in Science, vol. 308, n. 5727, 3 giugno 2005, pp. 1435–1439, DOI:10.1126/science.1110837. URL consultato il 1º giugno 2021.
- ^ I. Barrette, Pseudoknots in prion protein mRNAs confirmed by comparative sequence analysis and pattern searching, in Nucleic Acids Research, vol. 29, n. 3, 1º febbraio 2001, pp. 753–758, DOI:10.1093/nar/29.3.753. URL consultato il 1º giugno 2021.
- ^ (EN) Jamil Kanaani, Stanley B. Prusiner e Julia Diacovo, Recombinant prion protein induces rapid polarization and development of synapses in embryonic rat hippocampal neurons in vitro: Prion protein enhances neuronal polarization, in Journal of Neurochemistry, vol. 95, n. 5, 19 settembre 2005, pp. 1373–1386, DOI:10.1111/j.1471-4159.2005.03469.x. URL consultato il 1º giugno 2021.
- ^ (EN) Catherine Robertson, Stephanie A. Booth e Daniel R. Beniac, Cellular prion protein is released on exosomes from activated platelets, in Blood, vol. 107, n. 10, 15 maggio 2006, pp. 3907–3911, DOI:10.1182/blood-2005-02-0802. URL consultato il 1º giugno 2021.
- ^ R. S. Hegde, A Transmembrane Form of the Prion Protein in Neurodegenerative Disease, in Science, vol. 279, n. 5352, 6 febbraio 1998, pp. 827–834, DOI:10.1126/science.279.5352.827. URL consultato il 1º giugno 2021.
- ^ Brian K. Nunnally e Ira S. Krull, Prions and mad cow disease, Marcel Dekker, 2004, ISBN 0-8247-5684-3, OCLC 55742614. URL consultato il 1º giugno 2021.
- ^ (EN) Charles Weissmann, The state of the prion, in Nature Reviews Microbiology, vol. 2, n. 11, 2004-11, pp. 861–871, DOI:10.1038/nrmicro1025. URL consultato il 1º giugno 2021.
- ^ (EN) Edward Málaga-Trillo, Gonzalo P Solis e Yvonne Schrock, Regulation of Embryonic Cell Adhesion by the Prion Protein, in PLoS Biology, vol. 7, n. 3, 10 marzo 2009, pp. e1000055, DOI:10.1371/journal.pbio.1000055. URL consultato il 1º giugno 2021.
- ^ (EN) Alison Abbott, Healthy prions protect nerves, in Nature, 24 gennaio 2010, pp. news.2010.29, DOI:10.1038/news.2010.29. URL consultato il 1º giugno 2021.
- ^ (EN) Himani Nailwal e Francis Ka-Ming Chan, Necroptosis in anti-viral inflammation, in Cell Death & Differentiation, vol. 26, n. 1, 2019-01, pp. 4–13, DOI:10.1038/s41418-018-0172-x. URL consultato il 1º giugno 2021.
- ^ (EN) James Shorter e Susan Lindquist, Prions as adaptive conduits of memory and inheritance, in Nature Reviews Genetics, vol. 6, n. 6, 2005-06, pp. 435–450, DOI:10.1038/nrg1616. URL consultato il 1º giugno 2021.
- ^ (EN) Laura E. Maglio, Mariela F. Perez e Vilma R. Martins, Hippocampal synaptic plasticity in mice devoid of cellular prion protein, in Molecular Brain Research, vol. 131, n. 1-2, 2004-11, pp. 58–64, DOI:10.1016/j.molbrainres.2004.08.004. URL consultato il 1º giugno 2021.
- ^ (EN) M. D. Caiati, V. F. Safiulina e G. Fattorini, PrPC Controls via Protein Kinase A the Direction of Synaptic Plasticity in the Immature Hippocampus, in Journal of Neuroscience, vol. 33, n. 7, 13 febbraio 2013, pp. 2973–2983, DOI:10.1523/JNEUROSCI.4149-12.2013. URL consultato il 1º giugno 2021.
- ^ (EN) Indulekha P. Sudhakaran e Mani Ramaswami, Long-term memory consolidation: The role of RNA-binding proteins with prion-like domains, in RNA Biology, vol. 14, n. 5, 4 maggio 2017, pp. 568–586, DOI:10.1080/15476286.2016.1244588. URL consultato il 1º giugno 2021.
- ^ (EN) Cheng Cheng Zhang, Andrew D. Steele e Susan Lindquist, Prion protein is expressed on long-term repopulating hematopoietic stem cells and is important for their self-renewal, in Proceedings of the National Academy of Sciences, vol. 103, n. 7, 14 febbraio 2006, pp. 2184–2189, DOI:10.1073/pnas.0510577103. URL consultato il 1º giugno 2021.
- ^ Richard Lathe e Jean-Luc Darlix, Prion Protein PRNP: A New Player in Innate Immunity? The Aβ Connection, in Journal of Alzheimer's Disease Reports, vol. 1, n. 1, 16 dicembre 2017, pp. 263–275, DOI:10.3233/ADR-170037. URL consultato il 1º giugno 2021.
- ^ A bacterial global regulator forms a prion.
- ^ File non trovato (File not found) - Users.unimi.it, su users.unimi.it. URL consultato il 1º giugno 2021.
- ^ Los reinos de la vida (página 2) - Monografias.com.
- ^ Print · History of time and life. History of time and life
- ^ biotic and abiotic (archiviato dall'url originale il 28 aprile 2012).
- ^ Vitae (living organisms). BioLib: Vitae, Living Organisms
- ^ Biota - Classification - Systema Naturae 2000 (archiviato dall'url originale il 14 giugno 2010). Sistema Naturae 2000 classification Biota
- ^ DISF - Documentazione Interdisciplinare di Scienza e Fede.
- ^ Exobiology: Approaches to Life beyond the Earth.
- ^ CSI - An Alien Taxonomy.
- ^ Terrabiota (archiviato dall'url originale il 6 aprile 2013).
- ^ Yoichi Ezaki, Akira Yao e Jianbo Liu, Preface: Palaeozoic and Mesozoic Geobiota During Greenhouse Intervals, in Paleontological Research, vol. 13, n. 1, 2009/04, pp. 1–1, DOI:10.2517/1342-8144-13.1.001. URL consultato il 29 luglio 2020.
- ^ Toward a natural system of organisms Proposal for the.
- ^ Polymers perform non-DNA evolution.
- ^ Toward a natural system of organisms Proposal for the dominions.
- ^ A new mechanism of mass extinction - and 15 minutes about a new tree of life «Seminars «NAI «NASA Astrobiology (archiviato dall'url originale il 21 ottobre 2011).
- ^ Aphanobionta - Nomenclature & Taxonomy - The Taxonomicon.
- ^ Luketa S., New views on the megaclassification of life (PDF), in Protistology, vol. 7, n. 4, 2012, pp. 218–237.
- ^ Superkingdom Acytota - Nomenclature & Taxonomy - The Taxonomicon.
- ^ What is Non-Cellular Life?. What Is Non-Cellular Life
- ^ Cytota (archiviato dall'url originale il 25 maggio 2013).
Bibliografia
[modifica | modifica wikitesto]- Stanley B. Prusiner, I prioni, Le Scienze, dicembre 1984, pag. 36
- Stanley B. Prusiner, Malattie da prioni, Le Scienze, marzo 1995, pag. 22
- Stanley B. Prusiner, Sconfiggere la mucca pazza, Le Scienze, settembre 2004, pag. 36.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikizionario contiene il lemma di dizionario «prione»
Wikizionario contiene il lemma di dizionario «prione» Wikimedia Commons contiene immagini o altri file su prione
Wikimedia Commons contiene immagini o altri file su prione Wikispecies contiene informazioni su prione
Wikispecies contiene informazioni su prione
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) prion, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 37420 · LCCN (EN) sh86005911 · GND (DE) 4353535-5 · BNF (FR) cb12340093m (data) · J9U (EN, HE) 987007563414705171 · NDL (EN, JA) 00577666 |
|---|









