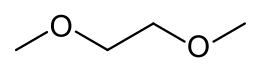
| 1,2-dimetossietano | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| 1,2-dimetossietano | |
| Nomi alternativi | |
| dimetossietano DME glicol dimetilico | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C4H10O2 |
| Massa molecolare (u) | 90,12 |
| Aspetto | liquido incolore |
| Numero CAS | |
| Numero EINECS | 203-794-9 |
| PubChem | 8071 |
| DrugBank | DBDB01749 |
| SMILES | COCCOC |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 0,87 |
| Solubilità in acqua | miscibile |
| Temperatura di fusione | −58 °C (215,15 K) |
| Temperatura di ebollizione | 85 °C (358,15 K) |
| Tensione di vapore (Pa) a 293,15 K | 7.800 |
| Indicazioni di sicurezza | |
| Punto di fiamma | −2 °C (271,15 K) |
| Limiti di esplosione | 1,6% - 10,4% |
| Temperatura di autoignizione | 200 °C (473,15 K) |
| Simboli di rischio chimico | |
  
| |
| pericolo | |
| Frasi H | 225 - 332 - 360 - EUH019 |
| Consigli P | 201 - 210 - 308+313 [1] |
1,2-dimetossietano, spesso noto più semplicemente come DME o come dimetossietano, è un etere liquido incolore utilizzato come solvente aprotico.
Sintesi
[modifica | modifica wikitesto]Il dimetossietano può essere prodotto tramite diversi metodi:[2]
- tramite reazione di Williamson, facendo reagire il sale sodico del 2-metossietanolo con clorometano:
- 2 CH3OCH2CH2OH + 2 Na → 2 CH3OCH2CH2ONa + H2↑
- CH3OCH2CH2ONa + CH3Cl → CH3OCH2CH2OCH3 + NaCl;
- tramite alchilazione del 2-metossietanolo con dimetilsolfato;
- attraverso la scissione dell'ossido di etilene in presenza di etere dimetilico. Questa reazione è catalizzata da acidi di Lewis (per esempio trifluoruro di boro o il suo complesso con etere dimetilico). Questo metodo non è particolarmente selettivo e produce dei sottoprodotti. La miscela di reazione è separata tramite distillazione.
Usi
[modifica | modifica wikitesto]Il dimetossietano è spesso utilizzato come alternativa a maggior punto di ebollizione rispetto ad altri solventi quali l'etere dietilico e il tetraidrofurano. Forma chelati con i cationi e si comporta da ligando bidentato. Viene utilizzato spesso in chimica organica per le sostituzioni nucleofile e in chimica metallorganica in reazioni come quelle con i reattivi di Grignard, riduzioni con idruro, e reazioni catalizzate da palladio come la condensazione di Suzuki e la reazione di Stille. Il dimetossietano è anche un buon solvente per oligo e polisaccaridi.
È utilizzato come componente a bassa viscosità nelle batterie al litio.
Note
[modifica | modifica wikitesto]- ^ (EN) Scheda IFA-GESTIS
- ^ (EN) Dimethoxyethane
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su 1,2-dimetossietano
Wikimedia Commons contiene immagini o altri file su 1,2-dimetossietano








