Pirrolidina
| Pirrolidina | |
|---|---|
 | |
 | |
| Nomi alternativi | |
| Azaciclopentano Tetraidropirrolo Tetrametilenammina | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C4H9N |
| Massa molecolare (u) | 71,12 |
| Aspetto | liquido incolore con odore pungente |
| Numero CAS | |
| Numero EINECS | 204-648-7 |
| PubChem | 31268 |
| DrugBank | DBDB16858 |
| SMILES | C1CCNC1 |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 0,86 |
| Costante di dissociazione acida (pKa) a 298 K | 11,3 |
| Solubilità in acqua | miscibile |
| Temperatura di fusione | -63 °C (210,15 K) |
| Temperatura di ebollizione | 87 °C (360,15 K) |
| Tensione di vapore (Pa) a 293,15 K | 6.450 |
| Indicazioni di sicurezza | |
| Punto di fiamma | 3 °C (276,15 K) |
| Limiti di esplosione | 1,6-10,6 %V |
| Temperatura di autoignizione | 320 °C (593,15 K) |
| Simboli di rischio chimico | |
  
| |
| pericolo | |
| Frasi H | 225 - 332 - 302 - 314 |
| Consigli P | 210 - 233 - 280 - 301+330+331 - 305+351+338 - 309+310 [1] |
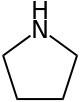
La pirrolidina o azaciclopentano, conosciuta anche come tetraidropirrolo, è un composto organico con formula molecolare C4H9N. È un'ammina secondaria ciclica formata da un anello eterociclico a cinque atomi, di cui 4 sono di carbonio e 1 di azoto. A temperatura ambiente si presenta come un liquido volatile, incolore se puro, tendente ad ingiallire all'aria, con un caratteristico odore pungente ammoniacale e di pesce. È completamente miscibile con l'acqua,[2] analogamente alla piperidina (molecola omologa con ciclo a 6 termini) e al tetraidrofurano (THF), è molto solubile in etere e alcool e nei comuni solventi organici non puramente idrocarburici.[3] La pirrolidina è un importante intermedio di sintesi in campo farmaceutico e in quello della chimica fine.
Occorrenza
[modifica | modifica wikitesto]L'anello pirrolidinico è presente nella struttura degli amminoacidi prolina e idrossiprolina e nella molecola della nicotina come N-metil derivato.
La pirrolidina è stata riscontrata in natura nelle foglie di piante quali tabacco, carota e belladonna.[4] La struttura ciclica della pirrolidina è presente in molti alcaloidi naturali, come la nicotina e l'igrina. È inoltre presente in molti farmaci tra i quali prociclidina e bepridil. Essa entra anche a far parte della struttura dei racetam (per esempio, piracetam, aniracetam e oxiracetam) e di diversi pesticidi.
Sintesi
[modifica | modifica wikitesto]La pirrolidina può essere sintetizzata facendo reagire tetraidrofurano con ammoniaca in fase gassosa, in presenza di ossido di alluminio che catalizza la disidratazione.[5] Un altro metodo consiste nella idrogenazione del pirrolo, che può essere ottenuto a sua volta per deidrogenazione della pirrolidina (reazione inversa).
Basicità
[modifica | modifica wikitesto]La pirrolidina, pur essendo tra le basi deboli (dato che Kb << 1), è una base alquanto più forte dell'ammoniaca e più forte della dimetilammina (la più forte delle metilammine) e anche un po' più forte della dietilammina (la corrispondente ammina a catena aperta), il che la colloca tra le ammine semplici a maggiore carattere basico. Il suo acido coniugato possiede pKa = 11,27, che corrisponde per la pirrolidina a una pKb = 2,73;[6] una sua soluzione acquosa a concentrazione di 100 g/L ha pH 12,9 a 20 °C.[2]
Reazioni
[modifica | modifica wikitesto]In chimica organica la pirrolidina è usata per attivare chetoni e aldeidi (che abbiano almeno un atomo H in posizione α al carbonile) verso l'addizione nucleofila tramite formazione di una enammina;[7] in questo stesso ruolo, oltre che come ammina secondaria eterociclica, si può citare il suo omologo a sei termini piperidina, o anche la morfolina.[8] Reagisce con acido nitroso o con nitriti alcalini in ambiente acido per dare la nitrosammina corrispondente, la N-nitrosopirrolidina (CH2)4N–N=O.[9]
Note
[modifica | modifica wikitesto]- ^ Scheda IFA-GESTIS Archiviato il 16 ottobre 2019 in Internet Archive.
- ^ a b GESTIS-Stoffdatenbank, su gestis.dguv.de. URL consultato il 4 giugno 2021.
- ^ (EN) PubChem, Piperidine, su pubchem.ncbi.nlm.nih.gov. URL consultato il 12 giugno 2022.
- ^ Derek Barton, Kōji Nakanishi; Otto Meth-Cohn, Comprehensive Natural Products Chemistry: Amino acids, peptides, porphyrins, and alkaloids, Pergamon, 2001, ISBN 978-0-08-043156-7.
- ^ (EN) U.S. Patent 2525584, "Production of pyrrolidine"
- ^ Hall, H.K., J. Am. Chem. Soc., 1957, 79, 5441. DOI: 10.1021/ja01577a030
- ^ R.O.C. Norman, 7.2, in CHIMICA ORGANICA Principi e Applicazioni alla Sintesi, traduzione di Paolo Da Re, Piccin, 1973, pp. 242-243.
- ^ Michael B. Smith e Jerry March, MARCH’S ADVANCED ORGANIC CHEMISTRY, 6ª ed., 2007, p. 635, ISBN 978-0-471-72091-1.
- ^ Michael B. Smith e Jerry March, MARCH’S ADVANCED ORGANIC CHEMISTRY, 6ª ed., 2007, pp. 846-847, ISBN 978-0-471-72091-1.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Pirrolidina
Wikimedia Commons contiene immagini o altri file su Pirrolidina
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) pyrrolidine, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.








