Idronio
| Ione idronio | |
|---|---|
 | |
| Nome IUPAC | |
| Ossonio | |
| Caratteristiche generali | |
| Formula bruta o molecolare | H3O⁺ |
| Massa molecolare (u) | 19.02 g/mol |
| Numero CAS | |
| PubChem | 123332 e 44144404 |
| SMILES | [OH3+] |
| Indicazioni di sicurezza | |
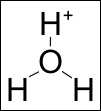
Ione idronio è il termine obsoleto[1] utilizzato in passato per indicare il catione ossonio, detto anche senza ambiguità idrossonio (o impropriamente idrogenione o semplicemente protone), con formula bruta reale H3O+, in quanto l'ossigeno forma tre legami covalenti di uguale lunghezza ed angoli di 108°, mentre il quarto orbitale ibrido sp3 è riempito da una coppia elettronica libera (lone pair, in inglese)[2]. Ciò rende il catione idrossonio un tipico acido di Brønsted-Lowry.
Il catione è responsabile del carattere acido di tutte le sostanze in ambiente acquoso e del relativo effetto livellante. Esso consiste in un catione derivante direttamente dalla formazione di un legame covalente fra uno ione H+ (denominato idrone, che in soluzione acquosa non può esistere allo stato libero) e una molecola di H2O. Si trova secondo la teoria di dissociazione di Brønsted-Lowry di sostanze anfotere e in tutti gli acidi inorganici e organici, siano essi forti o deboli.
In conclusione, lo ione idrossonio ha una struttura tetraedrica; l'atomo di ossigeno ibridato sp3 è posto al centro del tetraedro, i tre atomi di idrogeno occupano i tre vertici della base triangolare, mentre il quarto orbitale sp3 è occupato da una coppia di elettroni di non legame, o "lone pair", che è responsabile della maggior parte delle proprietà chimico-fisiche del catione stesso. I tre angoli di legame H-O-H sono approssimativamente di 108°[3]. Esperimenti di marcatura radioisotopica con trizio hanno evidenziato che i tre atomi di idrogeno sono equivalenti, ovvero quando lo ione ossonio si dissocia per tornare a formare acqua, lo ione H+ scambiato non è necessariamente quello acquisito in precedenza. In soluzione acquosa il catione idrossonio stabilisce legami a idrogeno solvatandosi con ulteriori tre molecole di acqua, assumendo la struttura più complessa (e maggiormente in accordo coi dati sperimentali) H9O4+. L'originale meccanismo di Grotthuss rende conto della peculiare dinamica e cinetica di trasferimento del protone in soluzione acquosa.
Produzione di cationi idrossonio: sostanze anfotere e acidi
[modifica | modifica wikitesto]Il catione H3O+ è naturalmente presente nelle sostanze anfotere in soluzione acquosa, come ad esempio l'anione idrogenocarbonato HCO3-, l'anione mono-idrogenosolfato HSO4- e l'acqua stessa (vedi autodissociazione dell'acqua). Esso deriva dall'equilibrio di autoprotolisi, secondo il quale queste sostanze tendono a perdere un protone tramutandosi nella propria base coniugata e liberando un protone H+; questo non può esistere libero in soluzione e, come detto in precedenza, si lega all'acqua formando un catione idrossonio.
Alcuni esempi sono:
Inoltre, anche gli acidi in soluzione acquosa contengono ioni idrossonio a diverse concentrazioni; proprio da questo valore, esprimibile come [H3O+], dipende poi il pH delle sostanze. Gli acidi forti si ionizzano (dissociano) completamente se disciolti in acqua, e - poiché tutte le reazioni chimiche sono di equilibrio - la loro reazione di dissociazione è completamente spostata verso destra. Un esempio è la seguente:
Gli acidi che invece sono definiti deboli danno luogo a reazioni di equilibrio di dissociazione in soluzione acquosa con formazione di cationi idrossonio. Ciò è quanto per esempio accade all'aceto, che è essenzialmente una soluzione acquosa diluita di acido acetico:
Infine, il catione idrossonio è presente anche nelle soluzioni delle sostanze che non hanno carattere acido, le basi, ma in concentrazioni assolutamente trascurabili, in quanto dev'essere sempre rispettato il valore del prodotto ionico dell'acqua KW = [H3O+] [OH-] che è pari a 1,0×10−14 M2 in condizioni standard.
Note
[modifica | modifica wikitesto]- ^ secondo le raccomandazioni delle Divisioni di Chimica Inorganica, di Chimica Organica e di Nomenclatura della IUPAC
- ^ (EN) IUPAC Gold Book, "oxonium ions"
- ^ Jian Tang and Takeshi Oka (1999). "Infrared spectroscopy of H3O+: the v1 fundamental band.". J. Mol. Spectrosc. 196 (1): 120. Bibcode 1999JMoSp.196..120T. doi:10.1006/jmsp.1999.7844. PMID 10361062
Voci correlate
[modifica | modifica wikitesto]- pH
- Ione idrossido
- Protonazione
- Autoionizzazione dell'acqua
- Meccanismo di Grotthuss
- Dimero dell'acqua protonato
Altri progetti
[modifica | modifica wikitesto] Wikizionario contiene il lemma di dizionario «idronio»
Wikizionario contiene il lemma di dizionario «idronio» Wikimedia Commons contiene immagini o altri file su idronio
Wikimedia Commons contiene immagini o altri file su idronio
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) hydronium ion, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.














