Indice
Attinoidi
| Numero atomico | Nome | Simbolo |
|---|---|---|
| 89 | Attinio | Ac |
| 90 | Torio | Th |
| 91 | Protoattinio | Pa |
| 92 | Uranio | U |
| 93 | Nettunio | Np |
| 94 | Plutonio | Pu |
| 95 | Americio | Am |
| 96 | Curio | Cm |
| 97 | Berkelio | Bk |
| 98 | Californio | Cf |
| 99 | Einsteinio | Es |
| 100 | Fermio | Fm |
| 101 | Mendelevio | Md |
| 102 | Nobelio | No |
| 103 | Laurenzio | Lr |

La serie degli attinoidi (in passato attinidi) si riferisce ai quindici elementi chimici compresi fra il radio e il ruterfordio sulla tavola periodica, con numeri atomici fra l'89 e il 103 inclusi.[1][2][3]
Il nome deriva dal primo elemento della serie, l'attinio, e solitamente il generico elemento di questa categoria si indica con il simbolo An. Tutti gli attinoidi fanno parte del blocco f della tavola periodica, ovvero riempiono l'orbitale 5f; il laurenzio costituisce un'eccezione, in quanto facente parte del blocco d. Questa divergenza causa confusione sulla corretta disposizione degli elementi attinoidi nella tavola periodica.
Per caratteristiche chimiche sono molto simili agli elementi della serie dei lantanoidi: gli attinoidi con il numero atomico più alto non sono reperibili in natura per via della loro emivita molto breve: quasi tutti gli attinoidi sono fortemente radioattivi. Il plutonio, inoltre, è anche estremamente velenoso.
Possiedono poi anche una buona elettropositività: ciò significa che tendono a cedere i loro elettroni per diventare cationi (comportamento tipico dei metalli).
Le loro proprietà chimiche sono talmente simili che all'inizio l'intera serie fu considerata come un solo elemento: infatti hanno elettronegatività molto simile (1,3); tendono a fare passare l'unico elettrone del guscio 6s al guscio sottostante 5f; possiedono una densità piuttosto alta e possono produrre più allotropi. Differiscono però tra loro se si esaminano i numeri di ossidazione: se per i lantanoidi è +3, lo stesso non si può dire per gli attinoidi, i quali possiedono numeri più elevati e solo gli attinoidi pesanti tornano ad avere il numero di ossidazione +3.
Come i lantanoidi (Ln), anche gli attinoidi (An) talvolta sono rappresentati al di fuori della tavola periodica, nello stesso modo e per gli stessi motivi: occupazione da parte degli elettroni degli orbitali di tipo f ma anche una maggior chiarezza nella tavola periodica (per evitare che si allarghi eccessivamente).
Storia
[modifica | modifica wikitesto]
Come nel caso dei lantanoidi, gli attinoidi formano una famiglia di elementi con proprietà simili in cui coesistono due gruppi sovrapposti: gli elementi transuranici, che seguono l'uranio, e gli elementi transplutonici, ovvero quelli che si susseguono al plutonio spostandosi verso destra nel periodo della tavola periodica. Rispetto ai lantanidi che, con l'eccezione del promezio, si trovano in natura in quantità abbastanza apprezzabili, gli elementi di questa serie sono piuttosto rari e prevalentemente sintetizzati in laboratorio. I più abbondanti, nonché più facili da preparare, sono l'uranio e il torio, seguiti da americio, attinio, protoattinio e nettunio.[4]
La scoperta della maggior parte di questi elementi è piuttosto recente, risalendo al secolo scorso. L'esistenza di alcuni elementi transuranici fu suggerita da Enrico Fermi, sulla base dei suoi esperimenti nucleari, già nel 1934.[5][6] All'epoca erano conosciuti appena quattro lantanoidi e ancora non si ipotizzava che potessero formare una famiglia come i lantanidi. L'opinione prevalente che ha dominato nell'ambito delle ricerche scientifiche fino agli anni quaranta, era che si trattasse di regolari elementi appartenenti al 7º periodo. Lentamente la sintesi di altri elementi o composti transuranici ha minato alla base questa teoria largamente diffusa, portando i chimici a rivedere la configurazione della tavola periodica. Gli esperimenti più importanti sono quelli condotti a Berkeley, in California, tra il 1941 e il 1944 e che provarono l'esistenza dell'americio, del curio, del berkelio e di tanti altri.
Nonostante la clamorosa scoperta, fino al termine degli anni cinquanta la comunità scientifica non ha espresso un parere condiviso sulla giusta collocazione degli attinoidi all'interno del sistema periodico. Prima di allora, infatti, vigeva la cosiddetta "ipotesi attinidica" (actinide hypothesis), ovvero un insieme di varie proposte su come "catalogare" gli elementi appena scoperti.[7][8][9]
Dall'attinio all'uranio
[modifica | modifica wikitesto]I primi attinoidi a essere scoperti sono stati, rispettivamente, l'uranio e il torio. L'uranio (il cui simbolo chimico è U) fu identificato nel 1789 dal chimico tedesco Martin Heinrich Klaproth all'interno del minerale uraninite, nota anche come pechblenda. Klaproth decise di denominare l'elemento uranio in riferimento al pianeta Urano, scoperto appena otto anni prima.[10] Lo scienziato fu, inoltre, in grado di precipitare un composto giallo (secondo alcuni studiosi moderni si trattò di diuranato sodico) sciogliendo un campione di pechblenda in acido nitrico e neutralizzando la soluzione ottenuta con un po' di idrossido di sodio. Riducendo in polvere il composto ottenuto e sfruttando del carbone, estrasse una sostanza nera che inizialmente scambiò per un metallo.[11] Soltanto 60 anni dopo, il francese Eugène-Melchior Péligot identificò il composto di Klaproth come ossido di uranio (UO2). Sempre Péligot isolò il primo campione di uranio metallico riscaldando il tetracloruro di uranio con del potassio e calcolandone la massa atomica con un valore di circa 120 u[12], corretto da Dmitrij Mendeleev nel 1872 con il valore di 240 u, secondo le leggi di periodicità. I calcoli di Mendeleev furono confermati nel 1882 da K. Zimmerman.[13][14]
L'ossido di torio (ThO2) fu invece scoperto da Friedrich Wöhler in un minerale rinvenuto in Norvegia nel 1827.[15] Jöns Jacob Berzelius analizzò e portò alla luce dettagli più interessanti di questo materiale nel 1828. Come farà poi Péligot, Berzelius ridusse il tetracloruro di torio con il potassio e isolò per la prima volta il metallo, attribuendogli il nome di torio in riferimento a Thor, il dio nordico dei fulmini, e il simbolo Th.[16][17]
Quando la corsa alla ricerca di nuovi elementi sembrava avere subito una battuta d'arresto, nel 1899 André-Louis Debierne, un assistente di Marie Curie, scoprì l'attinio (Ac) analizzando i rifiuti di pechblenda rimasti dopo la rimozione dal minerale di tracce di radio e polonio. Debierne descrisse la sostanza come simile al titanio e, dopo attenti studi, si convinse che fosse, al contrario, più simile al torio (1900). La scoperta dell'attinio da parte di Debierne è stata messa in discussione nel 1971 e nel 2000 delle ricerche specifiche hanno evidenziato che le pubblicazioni di Debierne del 1904 contraddicevano quelle del 1899-1900. La conclusione è che Debierne non isolò un nuovo elemento, sebbene ne predisse indirettamente l'esistenza. Vi sono dei dubbi anche sull'origine del nome. Attualmente, con una certa sicurezza, si ritiene che sia stato Victor Goldschimidt, nel 1937, ad attribuire all'elemento il nome attinio, derivato dal greco ακτίς, ακτίνος (aktis, aktinos) con il significato di "raggio di luce" o anche "fascio", poiché fu scoperto solo dall'analisi delle radiazioni emesse da nuclidi figli, ovvero radioisotopi prodotti dal suo decadimento. Recenti studi inducono a credere che attinio vero e proprio non sia stato sintetizzato prima del 1950.
Il protoattinio (Pa) fu isolato nel 1900 da William Crookes, sebbene vi siano parecchi dubbi al riguardo. D'altro canto, si è certi che fu identificato nel 1913 da Kasimir Fajans e Oswald Helmuth Göhring durante i loro studi sul decadimento dell'isotopo 238U. I due scienziati chiamarono il nuovo elemento brevium, dal latino brevis, ovvero "breve" in riferimento al tempo di dimezzamento di appena 1,17 minuti. Negli anni il nome è stato cambiato in protoattinio (dal greco πρῶτος + ἀκτίς che significa "primo raggio"), adottato dalla comunità scientifica e dalla letteratura a cominciare dal 1918 quando due gruppi di scienziati, uno guidato dall'austriaca Lise Meitner e dal tedesco Otto Hahn e l'altro con a capo Frederick Soddy e John Cranston in Gran Bretagna, scoprirono indipendentemente l'uno dall'altro l'isotopo 231Pa. Nel 1949 la IUPAC riconobbe ufficialmente l'elemento e confermò Otto Hahn e Lise Meitner come scopritori, riducendone però il nome a protattinio (sebbene alcuni testi attuali riportino entrambe le diciture e l'elemento sia comunemente noto come protoattinio). Maggiori informazioni sulle proprietà e il comportamento chimico del protoattinio arrivarono nel 1960, quando Maddock e i suoi collaboratori, nel Regno Unito, produssero circa 130 grammi di protoattinio a partire da 60 tonnellate di rifiuti rimasti dopo l'estrazione di uranio dal suo minerale principale.
La scoperta del nettunio e gli esperimenti a Berkeley
[modifica | modifica wikitesto]Nel 1934 a Roma Enrico Fermi e la sua cerchia di collaboratori conducevano esperimenti a livello nucleare. Durante questi test emersero nuovi isotopi mai studiati prima di allora. Tuttavia la scoperta non destò scalpore e per molto tempo i cosiddetti transuranici rimasero un mistero.
Il nettunio (indicato con Np e con il nome derivato dal pianeta Nettuno, che nel sistema solare segue Urano) fu scoperto da Edwin McMillan e Philip Abelson nel 1940 a Berkeley, in California.[18] Presso delle strutture universitarie, i due scienziati isolarono un nuovo elemento producendo l'isotopo 239Np (con una emivita stimata di 2,4 giorni) bombardando l'uranio con dei neutroni lenti. Fu il primo elemento transuranico a essere sintetizzato in laboratorio.[19] I due chimici decisero di chiamarlo nettunio in riferimento al precedente elemento, l'uranio, mantenendo così una sorta di "denominazione cosmologica" (lo stesso dicasi per il plutonio).
| Elemento | Scoperta | Metodo |
|---|---|---|
| Nettunio | 1940 | Bombardando 238U con neutroni |
| Plutonio | 1941 | Bombardando 238U con deutoni |
| Americio | 1944 | Bombardando 239Pu con neutroni |
| Curio | 1944 | Bombardando 239Pu con particelle α |
| Berkelio | 1949 | Bombardando 241Am con particelle α |
| Californio | 1950 | Bombardando 242Cm con particelle α |
| Einsteinio | 1952 | Prodotto da esplosioni nucleari |
| Fermio | 1952 | Prodotto di esplosioni nucleari |
| Mendelevio | 1955 | Bombardando 253Es con particelle α |
| Nobelio | 1965 | Bombardando 243Am con N o 238U con particelle α |
| Laurenzio | 1961-1971 | Bombardando 252Cf con B |
Gli anni quaranta sono un periodo denso di scoperte in campo chimico. Sulla scia del successo ottenuto da McMillan e Abelson con la tecnica del bombardare l'uranio, nel 1941 e successivamente a partire dal 1944 fino agli anni cinquanta, Glenn Seaborg e il suo gruppo, all'università di Berkeley, sintetizzarono parecchi nuovi elementi:
- plutonio (dal nome del pianeta Plutone e con il simbolo Pu);
- americio (Am) dal continente America, in analogia con l'elemento al di sopra nella tavola periodica, l'europio;
- curio (Cm), in onore ai coniugi Pierre e Marie Curie;
- berkelio (in italiano trascritto anche come berchelio, Bk), dalla città di Berkeley, in California;
- californio (Cf), prende il nome dallo stato dove fu scoperto, la California;
- einstenio (Es), in onore al fisico Albert Einstein;
- fermio (Fm), in onore al fisico Enrico Fermi;
- nobelio (No), in onore a Alfred Nobel.
Negli anni a seguire fu sintetizzato anche l'elemento 106, recentemente chiamato seaborgio (Sg) in onore a Seaborg. I ricercatori individuarono, infine, oltre 100 tipi diversi di radioisotopi.
Come appena sottolineato tutti questi elementi transuranici sono prodotti in laboratorio e non si trovano in quantità apprezzabili in natura, fatte poche eccezioni. È opportuno, comunque, tenere in considerazione i numerosi test nucleari condotti sia in terra che nell'alta atmosfera. Difatti la ricaduta radioattiva seguente alle varie esplosioni nucleari verificatesi prima degli anni ottanta hanno rilasciato nell'ambiente tracce, più o meno significative, di questi elementi.
In questo modo, Enrico Fermi e i suoi collaboratori, usando il primo reattore nucleare, ottennero significative quantità di plutonio-239, successivamente impiegate per le armi nucleari.[22]
Isotopi
[modifica | modifica wikitesto]Al 2010 sono stati identificati ben trentuno isotopi di attinio e otto stati isomerici eccitati di alcuni dei suoi nuclidi. Tre di questi isotopi, 225Ac, 227Ac e 228Ac, sono stati trovati in natura (tenendo conto anche degli effetti post test nucleari) mentre tutti gli altri sono artificiali; soltanto gli isotopi naturali trovano delle applicazioni industriali. L'attinio-225 è un membro della serie dei radioisotopi del nettunio. Fu scoperto nel 1947 come prodotto di fissione dell'uranio-233, è un emettitore di radiazioni α, le quali hanno un tempo di dimezzamento (t½) di circa 10 giorni. L'attinio-225 è meno disponibile dell'attinio-228 ma è più promettente come radiotracciante. L'attinio-227 (con una emivita di 21-22 anni) si può rilevare in tutti i minerali dell'uranio, ma in quantità davvero esigue. Un grammo di uranio contiene solo 2×10−10 g di 227Ac.
Attinidi minori
[modifica | modifica wikitesto]Gli attinoidi minori sono tutti gli attinoidi ad esclusione di plutonio e uranio (denominati attinoidi maggiori), che compongono il combustibile nucleare esaurito.
Proprietà
[modifica | modifica wikitesto]Gli attinoidi hanno proprietà molto simili a quelle dei lantanoidi. I gusci elettronici 6d e 7s sono riempiti nell'attinio e nel torio e il 5f viene riempito mano a mano che aumenta il numero atomico. Il 4f è pieno nei lantanoidi. La prima prova sperimentale della completezza dell'orbitale 5f negli attinidi fu ottenuta da McMillan e Abelson nel 1940, quando isolarono il nettunio. Proprio come i lantanoidi, anche questi elementi subiscono una riduzione del raggio (detta contrazione attinidica, analogamente alla contrazione lantanoidea).
| Proprietà | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Carica | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 | 100 | 101 | 102 | 103 |
| Massa atomica | [227] | 232,0381 | 231,03588 | 238,02891 | [237] | [244] | [243] | [247] | [247] | [251] | [252] | [257] | [258] | [259] | [266] |
| Numero di isotopi naturali[25] | 3 | 9 | 5 | 9 | 4 | 5 | 5 | 8 | 2 | 5 | — | — | — | — | — |
| Isotopi naturali[25][26] | 225, 227÷228 | 226÷232, 234÷235 | 231, 233÷236 | 232÷240 | 237÷240 | 238÷240, 242, 244 | 241÷245 | 242÷249 | 249÷250 | 249÷253 | — | — | — | — | — |
| Isotopo più longevo | 227 | 232 | 231 | 238 | 237 | 244 | 243 | 247 | 247 | 251 | 252 | 257 | 258 | 259 | 266 |
| Tempo di dimezzamento dell'isotopo più logevo | 21,8 anni | 14 miliardi di anni | 32 500 anni | 4,47 miliardi di anni | 2,14 milioni di anni | 80,8 milioni di anni | 7 370 anni | 15,6 milioni di anni | 1 400 anni | 900 anni | 1,29 anni | 100,5 giorni | 52 giorni | 58 min | 11 ore |
| Configurazione elettronica allo stato fondamentale | 6d17s2 | 6d27s2 | 5f26d17s2or 5f16d27s2 | 5f36d17s2 | 5f46d17s2or 5f57s2 | 5f67s2 | 5f77s2 | 5f76d17s2 | 5f97s2or 5f86d17s2 | 5f107s2 | 5f117s2 | 5f127s2 | 5f137s2 | 5f147s2 | 5f147s27p1 |
| Stati di ossidazione | 2, 3 | 2, 3, 4 | 2, 3, 4, 5 | 2, 3, 4, 5, 6 | 3, 4, 5, 6, 7 | 3, 4, 5, 6, 7, 8 | 2, 3, 4, 5, 6, 7 | 2, 3, 4, 6, 8 | 2, 3, 4 | 2, 3, 4 | 2, 3, 4 | 2, 3 | 2, 3 | 2, 3 | 3 |
| Raggio metallico (nm) | 0,203 | 0,180 | 0,162 | 0,153 | 0,150 | 0,162 | 0,173 | 0,174 | 0,170 | 0,186 | 0,186 | ? 0,198 | ? 0,194 | ? 0,197 | ? 0,171 |
| Raggio ionico (in nm): An4+ An3+ |
— 0,126 |
0,114 — |
0,104 0,118 |
0,103 0,118 |
0,101 0,116 |
0,100 0,115 |
0,099 0,114 |
0,099 0,112 |
0,097 0,110 |
0,096 0,109 |
0,085 0,098 |
0,084 0,091 |
0,084 0,090 |
0,084 0,095 |
0,083 0,088 |
| Temperatura (°C): fusione ebollizione |
1050 3198 |
1842 4788 |
1568 ? 4027 |
1132.2 4131 |
639 ? 4174 |
639.4 3228 |
1176 ? 2607 |
1340 3110 |
986 2627 |
900 ? 1470 |
860 ? 996 |
1530 — |
830 — |
830 — |
1630 — |
| Densità (g/cm³) | 10,07 | 11,78 | 15,37 | 19,06 | 20,45 | 19,84 | 11,7 | 13,51 | 14,78 | 15,1 | 8,84 | ||||
| Potenziale standard (in V): E° (An4+/An0) E° (An3+/An0) |
— −2,13 |
−1,83 — |
−1,47 — |
−1,38 −1,66 |
−1,30 −1,79 |
−1,25 −2,00 |
−0,90 −2,07 |
−0,75 −2,06 |
−0,55 −1,96 |
−0,59 −1,97 |
−0,36 −1,98 |
−0,29 −1,96 |
— −1,74 |
— −1,20 |
— −2,10 |
| Colore [M(H2O)n]4+ [M(H2O)n]3+ |
— Incolore |
Incolore Blue |
Giallo Blu scuro |
Verde Magenta |
Giallo-verde Porpora |
Marrone Viola |
Rosso Rosa |
Giallo Incolore |
Beige Giallo-verde |
Verde Verde |
— Rosa |
— — |
— — |
— — |
— — |
| Stato di ossidazione | 89 | 90 | 91 | 92 | 93 | 94 | 95 | 96 | 97 | 98 | 99 |
| +3 | Ac3+ | Th3+ | Pa3+ | U3+ | Np3+ | Pu3+ | Am3+ | Cm3+ | Bk3+ | Cf3+ | Es3+ |
| +4 | Th4+ | Pa4+ | U4+ | Np4+ | Pu4+ | Am4+ | Cm4+ | Bk4+ | Cf4+ | ||
| +5 | PaO+2 | UO+2 | NpO+2 | PuO+2 | AmO+2 | ||||||
| +6 | UO2+2 | NpO2+2 | PuO2+2 | AmO2+2 | |||||||
| +7 | NpO3+2 | PuO3+2 | [AmO6]5− |
Proprietà fisiche
[modifica | modifica wikitesto]
|
|
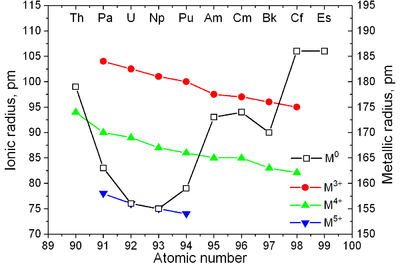
| Diagramma di fase degli attinoidi | Raggi metallici e ionici degli attinoidi[24] |

Gli attinoidi sono tipici metalli. Presentano tutti una colorazione bianco-argentea allo stato solido metallico, più scura se lasciati a contatto con l'aria. Sono relativamente molto densi e con una buona plasticità. In genere tendono a essere soffici, al punto che alcuni si possono tagliare con un coltello. La resistività elettrica varia dai 15 ai circa 150 µohm·cm.
La durezza del torio è simile a quella dell'acciaio perciò, se riscaldato, il torio puro può essere ridotto in lamine o trasformato in fili sottili (proprietà tipiche dei metalli chiamate, rispettivamente, malleabilità e duttilità). Il torio è denso quasi la metà dell'uranio e del plutonio, anche se risulta più duro di entrambi.
Tutti gli attinidi sono radioattivi, paramagnetici e, tranne l'attinio, presentano diverse fasi cristalline: il plutonio ne ha sette, mentre uranio, nettunio e californio ne hanno tre. Le strutture cristalline di protattinio, uranio, nettunio e plutonio non hanno perfetti corrispettivi all'interno dei lantanoidi e sono essenzialmente più simili ai metalli di transizione 3d.
In genere tutti gli attinidi sono piroforici (o pirofori), ovvero "portatori di fuoco": infatti, se finemente divisi, si incendiano spontaneamente all'aria. Il punto di fusione degli attinoidi non ha una dipendenza specifica dal numero di elettroni degli orbitali f. A ogni modo l'insolito punto di fusione basso di nettunio e plutonio (circa 640 °C) si può spiegare parlando di ibridazione degli orbitali 5f e 6d, con la formazione di legami direzionali all'interno di questi metalli.
| Lantanoidi | Ln3+, Å | Attinoidi | An3+, Å | An4+, Å |
|---|---|---|---|---|
| Lantanio | 1,061 | Attinio | 1,11 | – |
| Cerio | 1,034 | Torio | 1,08 | 0,99 |
| Praseodimio | 1,013 | Protattinio | 1,05 | 0,93 |
| Neodimio | 0,995 | Uranio | 1,03 | 0,93 |
| Promezio | 0,979 | Nettunio | 1,01 | 0,92 |
| Samario | 0,964 | Plutonio | 1,00 | 0,90 |
| Europio | 0,950 | Americio | 0,99 | 0,89 |
| Gadolinio | 0,938 | Curio | 0,98 | 0,88 |
| Terbio | 0,923 | Berkelio | – | – |
| Disprosio | 0,908 | Californio | – | – |
| Olmio | 0,894 | Einstenio | – | – |
| Erbio | 0,881 | Fermio | – | – |
| Tulio | 0,869 | Mendelevio | – | – |
| Itterbio | 0,858 | Nobelio | – | – |
| Lutezio | 0,848 | Laurenzio | – | – |
Proprietà chimiche
[modifica | modifica wikitesto]Applicazioni
[modifica | modifica wikitesto]| Reattore nucleare[23][29][30] |
 I neutroni veloci vengono rallentati dai moderatori, che contengono la cosiddetta acqua pesante. Il progredire della reazione è controllato introducendo ulteriori aste cave in boro o cadmio o un liquido assorbente, come l'acido borico. I reattori per la produzione di plutonio sono chiamati breeder reactors. |

Sebbene alcuni attinoidi abbiano delle piccole applicazioni in ambito quotidiano, come per esempio i rilevatori di fumo (con componenti in americio[31][32]) o nelle reticelle a gas,[33] questi elementi vengono principalmente adoperati per la costruzione di armi nucleari o come combustibili nei reattori nucleari,[33] questo perché rilasciano grandi quantità di energia e, in opportune condizioni, possono avviare una reazione a catena ad autosostentamento.
Dal punto di vista energetico, l'isotopo più importante è certamente l'uranio-235. Esso viene impiegato nei reattori termali e la sua concentrazione all'interno dell'uranio normale non supera lo 0,72%. Questo isotopo assorbe i neutroni termici rilasciando parecchia energia. Basti pensare che un grammo di 235U si converte in circa 1 MW al giorno. Di notevole importanza è il fatto che tale isotopo emetta più neutroni di quanti ne assorba; nel raggiungere la massa critica, 235U entra in una reazione a catena che si sostiene da sola. Tipicamente il nucleo di uranio si divide in due frazioni con il rilascio di due o anche tre neutroni, per esempio:
Altre promettenti isotopi di impiego nucleare sono il torio-232 e l'uranio-233. [34] L'emissione di neutroni durante la fissione dell'uranio non è importante solo per il mantenimento della reazione a catena, ma anche per la sintesi di metalli attinoidi più pesanti. L'uranio-239 si trasforma, attraverso decadimento β, in plutonio-239, il quale, a sua volta, può andare incontro a fissione spontanea. In fondo bisogna anche ricordare che il primissimo reattore nucleare non venne progettato e poi costruito per scopi energetici, bensì per armi nucleari. Ciò lascia intende quanto sia intensa la ricerca scientifica in questo settore.
Tossicità
[modifica | modifica wikitesto]
Le sostanze radioattive possono compromettere la salute degli esseri umani e di altri animali mediante la contaminazione locale sulla pelle, l'esposizione interna dovuta all'ingestione di isotopi radioattivi (si parla di avvelenamento) e l'eccessiva esposizione esterna all'emissione di raggi beta o gamma. Insieme al radio e agli elementi transuranici, l'attinio è un elemento parecchio pericoloso da maneggiare, considerando l'alta radioattività dovuta alla specifica attività delle radiazioni alfa. La caratteristica saliente dell'attinio è la sua abilità nell'accumularsi e nel permanere a lungo sulla superficie delle ossa. Nella fase iniziale dell'avvelenamento l'attinio si concentra nel fegato, da cui poi si diffonde nell'organismo. Solo una minima parte entra nel sistema circolatorio, ancora meno la percentuale di attinio che il corpo riesce a espellere tramite urina. Poiché decade velocemente, ipotizzando di poterlo rimuovere in fretta dall'organismo, si avrebbero comunque seri danni agli organi interni, pesantemente colpiti dalle radiazioni.[35]

Elementi con almeno un isotopo stabile.
Elementi leggermente radioattivi: l'isotopo più stabile è veramente longevo, con un'emivita di oltre 4 milioni di anni.
Elementi moderatamente radioattivi: l'isotopo più stabile ha un'emivita tra gli 800 e i 34 000 anni.
Elementi molto radioattivi: l'isotopo più stabile decade in un giorno o entro 103 anni.
Elementi molto radioattivi: l'isotopo più longevo e stabile ha un'emivita compresa tra i pochi minuti e l'arco di un giorno.
Elementi estremamente radioattivi: l'isotopo più stabile ha un'emivita inferiore al minuto. A causa dell'elevata instabilità si sa poco o nulla riguardo a questi elementi.
Il protattinio nel corpo tende ad accumularsi nei reni e nelle ossa. La massima dose tollerabile dal nostro organismo è di circa 0,5 μg di 231Pa. Questo isotopo, che potrebbe essere presente nell'aria in forma di aerosol, può essere addirittura più letale dall'acido cianidrico.[36]
Il plutonio, quando penetra nell'organismo attraverso l'aria, cibi avvelenati o tramite il sangue (per esempio attraverso una ferita) si deposita nei polmoni (se inalato) oppure nelle ossa e nel fegato. Soltanto il 10% si diffonde intorno al resto degli organi e, purtroppo, vi rimane inevitabilmente per decenni. L'incredibile residenza del plutonio nel corpo si spiega grazie alla sua scarsa solubilità in acqua: se fosse il contrario, la grande abbondanza di acqua nel corpo umano ne consentirebbe una più o meno rapida espulsione. Alcuni isotopi del plutonio, inoltre, emettono radiazioni alfa ionizzanti, potenzialmente cancerogene in quanto danneggiano le cellule circostanti. È bene ricordare che le particelle alfa non sono pericolose poiché, in genere, se non concentrate, non sono in grado di oltrepassare strati spessi di materia (talvolta vengono respinte da fogli di carta). Se però consideriamo che la distanza tra la sorgente di queste radiazioni (quando si trova nel corpo) e le cellule è praticamente nulla, diventa ovvia la comprensione del perché siano così dannose all'organismo, causando mutazioni o errori genetici. Da studi condotti sugli animali, la dose letale per gli umani è di soli 22 mg per un adulto medio del peso di 70 kg. Queste piccole quantità sono praticamente invisibili al microscopio e questo complica elaborare una stima più o meno certa della dose letale. Si può asserire che la contaminazione tramite cibo sia la meno pericolosa, nonché la meno probabile, poiché solo una ridottissima percentuale di plutonio potrebbe restare intrappolata nell'organismo, senza essere espulsa.[37]
L'utilizzo degli attinidi nei combustibili nucleari ha dei benefici innegabili. Tuttavia un serio problema è rappresentato dall'elevata radiotossicità di questi elementi quando vengono dispersi nell'ambiente.[38] L'uso di forme instabili chimicamente degli attinidi nei MOX non segue appropriatamente gli standard di sicurezza attualmente vigenti (2015). È una vera sfida sviluppare materiali che siano in grado di contenere la "minaccia radioattiva" degli elementi attinoidi sfruttati in campo nucleare. L'obiettivo è quello di prevenire il rilascio nell'ambiente sviluppando nuovi materiali per uno stoccaggio sicuro. Se gli attinidi si riversassero in un'area naturale diversificata, causerebbero l'avvelenamento delle falde acquifere con conseguenze disastrose sulla catena alimentare e sulla sopravvivenza delle specie viventi della zona.[39]
Note
[modifica | modifica wikitesto]- ^ (EN) Periodic Table of the Elements, su iupac.org, IUPAC, 2003-2007. URL consultato il 23 febbraio 2011 (archiviato dall'url originale il 17 maggio 2008).
- ^ (EN) Periodic Table of Elements (PDF), su iupac.org, IUPAC, 2007.
- ^ (EN) Red Book (PDF), su old.iupac.org, IUPAC, 2005.
- ^ Myasoedov, p. 7
- ^ Fermi, E., Possible Production of Elements of Atomic Number Higher than 92, in Nature, vol. 133, n. 3372, 1934, pp. 898–899, Bibcode:1934Natur.133..898F, DOI:10.1038/133898a0.
- ^ Jagdish Mehra e Helmut Rechenberg, The historical development of quantum theory, Springer, 20 aprile 2001, pp. 966–, ISBN 978-0-387-95086-0. URL consultato il 19 giugno 2011.
- ^ Seaborg, G. T., Ch. 118. Origin of the actinide concept, in K.A. Gschneidner, Jr., L, Eyring, G.R. Choppin and G.H. Landet (a cura di), Handbook on the Physics and Chemistry of Rare Earths, 18 – Lanthanides/Actinides: Chemistry, Elsevier, 1994, pp. 4–6, 10–14.
- ^ J. C. Wallmann, The first isolations of the transuranium elements: A historical survey, in Journal of Chemical Education, vol. 36, n. 7, 1959, p. 340, Bibcode:1959JChEd..36..340W, DOI:10.1021/ed036p340.
- ^ Myasoedov, p. 9
- ^ Greenwood, p. 1250
- ^ Martin Heinrich Klaproth, Chemische Untersuchung des Uranits, einer neuentdeckten metallischen Substanz, in Chemische Annalen, vol. 2, 1789, pp. 387–403.
- ^ E.-M. Péligot, Recherches Sur L'Uranium, in Annales de chimie et de physique, vol. 5, n. 5, 1842, pp. 5–47.
- ^ Ingmar Grenthe, Uranium, in The Chemistry of the Actinide and Transactinide Elements, 2006, DOI:10.1007/1-4020-3598-5_5.
- ^ Zimmerman, Ann., 213, 290 (1882); 216, 1 (1883); Ber. 15 (1882) 849
- ^ Golub, p. 214
- ^ Berzelius, J. J., Untersuchung eines neues Minerals und einer darin erhalten zuvor unbekannten Erde (Investigation of a new mineral and of a previously unknown earth contained therein), in Annalen der Physik und Chemie, vol. 16, n. 7, 1829, pp. 385–415, Bibcode:1829AnP....92..385B, DOI:10.1002/andp.18290920702.
- ^ Berzelius, J. J., Undersökning af ett nytt mineral (Thorit), som innehåller en förut obekant jord" (Investigation of a new mineral (thorite), as contained in a previously unknown earth), in Kungliga Svenska Vetenskaps Akademiens Handlingar (Transactions of the Royal Swedish Science Academy), 1829, pp. 1–30.
- ^ Mcmillan, Edwin e Philip Abelson, Radioactive Element 93, in Physical Review, vol. 57, n. 12, 1940, pp. 1185–1186, Bibcode:1940PhRv...57.1185M, DOI:10.1103/PhysRev.57.1185.2.
- ^ V.A. Mikhailov (a cura di), Analytical chemistry of neptunium, Moscow, Nauka, 1971.
- ^ Greenwood, p. 1252
- ^ Nobelio e laurenzio sono stati scoperti quasi contemporaneamente da un gruppo di scienziati americani e uno di sovietici
- ^ E. Fermi, The Development of the first chain reaction pile, in Proceedings of the American Philosophical Society, vol. 90, n. 1, 1946, pp. 20–24, JSTOR 3301034.
- ^ a b Yu.D. Tretyakov (a cura di), Non-organic chemistry in three volumes, Chemistry of transition elements, vol. 3, Moscow, Academy, 2007, ISBN 5-7695-2533-9.
- ^ a b Greenwood, p. 1263
- ^ a b John Emsley, Nature's Building Blocks: An A-Z Guide to the Elements, New, New York, NY, Oxford University Press, 2011, ISBN 978-0-19-960563-7.
- ^ Peterson, Ivars, Uranium displays rare type of radioactivity, Science News, 7 dicembre 1991. URL consultato il 19 aprile 2015 (archiviato dall'url originale il 18 gennaio 2012).
- ^ Greenwood, p. 1265
- ^ Myasoedov, pp. 30–31
- ^ GG Bartolomei, Baybakov VD, Alkhutov MS, Bach G. A., Basic theories and methods of calculation of nuclear reactors, Moscow, Energoatomizdat, 1982.
- ^ Greenwood, pp. 1256–1261
- ^ (EN) Smoke Detectors and Americium, su uic.com.au, Nuclear Issues Briefing Paper 35, maggio 2002. URL consultato il 26 agosto 2015 (archiviato dall'url originale il 1º gennaio 1996)., Smoke Detectors and Americium, su uic.com.au (archiviato dall'url originale l'11 settembre 2002).
- ^ Greenwood, p. 1262
- ^ a b Greenwood, p. 1255
- ^ (RU) Sergey Popov, Alexander Sergeev, Universal Alchemy, in Vokrug Sveta, vol. 2811, n. 4, 2008.
- ^ Z. K. Karalova, B. Myasoedov, Actinium, Analytical chemistry items, Moscow, Nauka, 1982.
- ^ E.S. Palshin, Analytical chemistry of protactinium, Moscow, Nauka, 1968.
- ^ B.A. Nadykto and L.F. Timofeeva (a cura di), Plutonium, Fundamental Problems, vol. 1, Sarov, VNIIEF, 2003, ISBN 5-9515-0024-9.
- ^ M. I. Ojovan, W.E. Lee, An Introduction to Nuclear Waste Immobilisation, Amsterdam, Elsevier, 2005, ISBN 0-08-044462-8.
- ^ B.E. Burakov, M.I Ojovan, W.E. Lee, Crystalline Materials for Actinide Immobilisation, World Scientific, 2010, ISBN 1-84816-418-1.
Bibliografia
[modifica | modifica wikitesto]- (RU) A.M. Golub, Общая и неорганическая химия (Chimica generale e inorganica), 1971.
- (EN) Norman N. Greenwood e Alan Earnshaw, Chemistry of the Elements, 2ª ed., Butterworth-Heinemann, 1997, ISBN 0-08-037941-9.
- (EN) B. Myasoedov, Analytical Chemistry of Transplutonium Elements, Mosca, Nauka, 1972, ISBN 0-470-62715-8.
- R. Bertani, D. A. Clemente, G. Depaoli, P. Di Bernardo, M. Gleria, B. Longato, U. Mazzi, G. A. Rizzi, G. Sotgiu e M. Vidali, Chimica Generale ed Inorganica, 3ª ed., CEA, 2010, ISBN 978-88-08-18462-7.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su attinoidi
Wikimedia Commons contiene immagini o altri file su attinoidi
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) Larned B. Asprey e Lester Morss, actinoid element, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 23907 · LCCN (EN) sh85000700 · GND (DE) 4141330-1 · BNE (ES) XX530121 (data) · BNF (FR) cb121509511 (data) · J9U (EN, HE) 987007293854005171 · NDL (EN, JA) 00560152 |
|---|










![{\displaystyle \mathrm {{}_{~92}^{238}U+{}_{0}^{1}n\ {\xrightarrow {\ }}\ {}_{~92}^{239}U\ {\xrightarrow[{23,5\ min}]{\beta ^{-}}}\ {}_{~93}^{239}Np\ {\xrightarrow[{2,3\ giorni}]{\beta ^{-}}}\ {}_{~94}^{239}Pu\ {\xrightarrow[{2,4\times 10^{4}\ anni}]{\alpha }}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/9197c07af11e0332ebcc22d3413806cc7659f65b)


