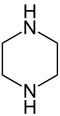
Piperazina
| Piperazina | |
|---|---|
 | |
| Nome IUPAC | |
| Piperazina | |
| Nomi alternativi | |
| 1,4-dietilendiammina Esaidropirazina Piperazidina | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C4H10N2 |
| Massa molecolare (u) | 86,14 |
| Aspetto | solido cristallino deliquescente |
| Numero CAS | |
| Numero EINECS | 203-808-3 |
| PubChem | 4837 |
| DrugBank | DBDB00592 |
| SMILES | C1CNCCN1 |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,1 |
| Costante di dissociazione basica a 298,15 K | 6,46·10-5 |
| Solubilità in acqua | solubile a 293,15K |
| Temperatura di fusione | 106 °C (379,15 K) |
| Temperatura di ebollizione | 146 °C (419,15 K) |
| Tensione di vapore (Pa) a 293,15 K | 280 Pa |
| Indicazioni di sicurezza | |
| Punto di fiamma | 65 °C (338,15 K) |
| Limiti di esplosione | 4-14% |
| Simboli di rischio chimico | |
 
| |
| pericolo | |
| Frasi H | 314 - 334 - 317 - 361df |
| Consigli P | 280 - 301+330+331 - 304+341 - 305+351+338 - 309+310 [1] |
La piperazina o 1,4-diazacicloesano (nome sistematico) è un composto eterociclico esa-atomico saturo in cui sono presenti due atomi di azoto in posizione 1,4 ed ha quindi due funzioni amminiche secondarie. Il composto si presenta sotto forma di cristalli aghiformi incolori, deliquescenti, dall'odore pungente di ammine e dal gusto salino.[2] Il suo nome deriva dalla somiglianza con la piperidina, un costituente della piperina estratta dal pepe nero (Piper nigrum).
La struttura della piperazina figura in un'ampia classe di composti chimici dall'importante attività farmacologica.[3][4] Tra questi si annoverano, ad esempio, il viagra e il levitra, l'imatinib, la ciclizina, il trazodone, il nefazodone, antidepressivi e varie droghe da abuso. La piperazina e alcuni suoi derivati sono inoltre utilizzati come antielmintici.
Proprietà chimiche e sintesi
[modifica | modifica wikitesto]
La piperazina è molto solubile in solventi polari protici quali l'acqua e il glicole etilenico, ben solubile in metanolo ed etanolo, ma anche in cloroformio, mentre è pochissimo solubile in benzene e praticamente insolubile in etere dietilico.[3]
Essendo una diammina, è una base biprotica avente pKb1 = 4,27 e pKb2 = 8,65, a 25 °C,[5] valori corrispondenti a pKa1 = 5,35 e pKa2 = 9,73; pertanto, è una base più forte dell'ammoniaca (pKb = 4,75); infatti, lasciata esposta all'aria, tende non solo ad assorbire rapidamente l'umidità, di cui è molto avida ma, per la sua spiccata basicità, anche l'anidride carbonica,[5] con la quale si combina formando l'acido coniugato del corrispondente ione carbammato; per lo stesso motivo è anche capace di assorbire acido solfidrico (H2S).[6][7] Le sue soluzioni acquose al 10% hanno pH compreso tra 10,8 11,8.[3]
Sebbene molti derivati della piperazina siano diffusi in natura, la piperazina può essere sintetizzata facendo reagire l'ammoniaca con 1,2-dicloroetano in ambiente alcolico, il sodio e il glicole etilenico con l'etilendiammina cloridrato o riducendo la pirazina con sodio in etanolo.
Una comune forma commerciale della piperazina è il suo esaidrato: , un solido cristallino incolore che fonde a 44 °C e bolle tra 125 e 130 °C.
Note
[modifica | modifica wikitesto]- ^ scheda del composto su IFA-GESTIS Archiviato il 16 ottobre 2019 in Internet Archive.
- ^ BZP/piperazines drug profile, su emcdda.europa.eu.
- ^ a b c (EN) PubChem, Piperazine, su pubchem.ncbi.nlm.nih.gov. URL consultato il 12 giugno 2022.
- ^ (EN) Ravi Ranjan Kumar, Bhaskar Sahu e Shelly Pathania, Piperazine, a Key Substructure for Antidepressants: Its Role in Developments and Structure‐Activity Relationships, in ChemMedChem, vol. 16, n. 12, 17 giugno 2021, pp. 1878–1901, DOI:10.1002/cmdc.202100045. URL consultato il 12 giugno 2022.
- ^ a b (EN) Farhad Khalili, Amr Henni e Allan L. L. East, p K a Values of Some Piperazines at (298, 303, 313, and 323) K, in Journal of Chemical & Engineering Data, vol. 54, n. 10, 8 ottobre 2009, pp. 2914–2917, DOI:10.1021/je900005c. URL consultato l'11 giugno 2022.
- ^ (EN) Dirk Speyer e Gerd Maurer, Solubility of Hydrogen Sulfide in Aqueous Solutions of Piperazine in the Low Gas-Loading Region, in Journal of Chemical & Engineering Data, vol. 56, n. 4, 14 aprile 2011, pp. 763–767, DOI:10.1021/je900721q. URL consultato il 12 giugno 2022.
- ^ (EN) Dirk Speyer, Arne Böttger e Gerd Maurer, Solubility of Hydrogen Sulfide in Aqueous Solutions of N -Methyldiethanolamine and Piperazine, in Industrial & Engineering Chemistry Research, vol. 51, n. 38, 26 settembre 2012, pp. 12549–12556, DOI:10.1021/ie301657y. URL consultato il 12 giugno 2022.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Piperazina
Wikimedia Commons contiene immagini o altri file su Piperazina
Collegamenti esterni
[modifica | modifica wikitesto]- Scheda monografica della piperazina (PDF) (PDF), su ecb.jrc.it. URL consultato il 22 marzo 2007 (archiviato dall'url originale il 21 febbraio 2007).
| Controllo di autorità | NDL (EN, JA) 01119873 |
|---|









