Indice
Edoxaban
| Edoxaban | |
|---|---|
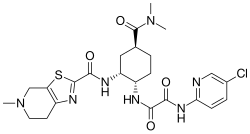 | |
| Nome IUPAC | |
| N'-(5-cloropyridin-2-il)-N-[(1S,2R,4S)-4-(dimetilcarbamoil)-2-[(5-metil-6,7-diidro-4H-[1,3]thiazolo[5,4-c]pyridine-2-carbonil)ammino]cycloesil]ossamide | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C24H30ClN7O4S |
| Massa molecolare (u) | 548,056 |
| Numero CAS | |
| Codice ATC | none |
| PubChem | 25022378 |
| DrugBank | DBDB09075 |
| SMILES | CN1CCC2=C(C1)SC(=N2)C(=O)NC3CC(CCC3NC(=O)C(=O)NC4=NC=C(C=C4)Cl)C(=O)N(C)C |
| Dati farmacologici | |
| Teratogenicità | ? |
| Modalità di somministrazione | orale |
| Dati farmacocinetici | |
| Emivita | 9-11 ore |
| Escrezione | urine (33%), feci (66%) |
| Indicazioni di sicurezza | |
Edoxaban (già noto con la sigla DU-176b) è un composto anticoagulante, un inibitore diretto del fattore Xa. Il farmaco è stato sviluppato dalla società farmaceutica Daiichi Sankyo. Nel luglio 2011 è stato approvato in Giappone per la prevenzione del tromboembolismo venoso dopo intervento ortopedico sugli arti inferiori.[1] Il farmaco viene venduto nella formulazione farmacologica di compresse da 15 mg, 30 mg e 60 mg.
Farmacodinamica
[modifica | modifica wikitesto]Edoxaban è un inibitore potente, reversibile, diretto ed estremamente selettivo del sito attivo del fattore Xa. L'anticoagulante non necessita dell'antitrombina III per svolgere l'attività antitrombotica. Edoxaban inibisce sia il fattore Xa libero che quello legato al coagulo. Edoxaban non inibisce direttamente l'aggregazione delle piastrine, ma impedisce indirettamente l'aggregazione piastrinica che viene indotta dalla trombina. Come conseguenza dell'attività inibitoria esercitata sul fattore X attivato (FXa) la molecola determina un prolungamento di diversi test di coagulazione, ed in particolare del tempo di protrombina (PT), dell'International Normalized Ratio (INR) e del tempo di tromboplastina parziale attivata (aPTT).
Farmacocinetica
[modifica | modifica wikitesto]Dopo somministrazione per via orale edoxaban viene rapidamente assorbito dal tratto gastrointestinale. L'effetto del cibo sull'assorbimento è clinicamente irrilevante.[2] La biodisponibilità della molecola è ottima e l'emivita breve e variabile tra le 9 e le 11 ore.[3][4][5] Il farmaco viene eliminato dall'organismo sia per via renale (33% circa) che tramite la via fecale (66% circa).
Studi clinici
[modifica | modifica wikitesto]Sul farmaco sono stati condotti diversi studi clinici di fase II, ad esempio per la tromboprofilassi dopo protesi totale dell'anca.[6]
In questi studi edoxaban, a basso (15 – 30 mg) ed alto dosaggio (60 e 90 mg), ha dimostrato di ridurre in modo significativo l'incidenza di tromboembolismo venoso dopo intervento in elezione di protesi totale d'anca.[6] Il medesimo effetto è stato registrato nei pazienti sottoposti ad artroplastica totale di ginocchio. Inoltre il tasso di sanguinamento è stato sovrapponibile a quello registrato in un gruppo di soggetti trattati con placebo.[7]
Sempre in uno studio in fase II la molecola, al dosaggio di 30 e 60 mg, ha mostrato di avere un profilo di sicurezza simile al warfarin, sia pure con una maggiore tendenza al sanguinamento, quando somministrata a soggetti affetti da fibrillazione atriale.[8]
Trial clinici in fase III sono stati eseguiti raffrontando il farmaco rispetto ad enoxaparina), e valutandone l'efficacia nella prevenzione dell'ictus cerebrale nei soggetti affetti da fibrillazione atriale.
Nello studio in fase III ENGAGE-AF-TIMI48 edoxaban è stato paragonato a warfarin nella prevenzione del tromboembolismo in soggetti con fibrillazione atriale. Lo studio ha reclutato 20.500 pazienti e si conclude ad ottobre 2012. Scopo dello studio è verificare la non inferiorità di edoxaban rispetto a warfarin, considerato il "gold standard".[9]
Interazioni
[modifica | modifica wikitesto]Il farmaco presenta interazioni con gli inibitori della P-glicoproteina, tra cui chinidina, verapamil, amiodarone e dronedarone.
Note
[modifica | modifica wikitesto]- ^ J. Gras, Edoxaban for the prevention of thromboembolic events after surgery., in Drugs Today (Barc), vol. 47, n. 10, Ott 2011, pp. 753-61, DOI:10.1358/dot.2011.47.10.1709241, PMID 22076490.
- ^ J. Mendell, M. Tachibana; M. Shi; S. Kunitada, Effects of food on the pharmacokinetics of edoxaban, an oral direct factor Xa inhibitor, in healthy volunteers., in J Clin Pharmacol, vol. 51, n. 5, Mag 2011, pp. 687-94, DOI:10.1177/0091270010370974, PMID 20534818.
- ^ K. Ogata, J. Mendell-Harary; M. Tachibana; H. Masumoto; T. Oguma; M. Kojima; S. Kunitada, Clinical safety, tolerability, pharmacokinetics, and pharmacodynamics of the novel factor Xa inhibitor edoxaban in healthy volunteers., in J Clin Pharmacol, vol. 50, n. 7, Lug 2010, pp. 743-53, DOI:10.1177/0091270009351883, PMID 20081065.
- ^ BI Eriksson, Quinlan DJ, Weitz JI, Comparative pharmacodynamics and pharmacokinetics of oral direct thrombin and factor xa inhibitors in development, in Clin Pharmacokinet., vol. 48, n. 1, 2009, pp. :1-22, DOI:10.2165/0003088-200948010-00001, PMID 19071881.
- ^ N. Chung, HK. Jeon; LM. Lien; WT. Lai; HF. Tse; WS. Chung; TH. Lee; SA. Chen, Safety of edoxaban, an oral factor Xa inhibitor, in Asian patients with non-valvular atrial fibrillation., in Thromb Haemost, vol. 105, n. 3, marzo 2011, pp. 535-44, DOI:10.1160/TH10-07-0451, PMID 21136011.
- ^ a b G. Raskob, AT. Cohen; BI. Eriksson; D. Puskas; M. Shi; T. Bocanegra; JI. Weitz, Oral direct factor Xa inhibition with edoxaban for thromboprophylaxis after elective total hip replacement. A randomised double-blind dose-response study., in Thromb Haemost, vol. 104, n. 3, Set 2010, pp. 642-9, DOI:10.1160/TH10-02-0142, PMID 20589317.
- ^ T. Fuji, S. Fujita; S. Tachibana; Y. Kawai, A dose-ranging study evaluating the oral factor Xa inhibitor edoxaban for the prevention of venous thromboembolism in patients undergoing total knee arthroplasty., in J Thromb Haemost, vol. 8, n. 11, novembre 2010, pp. 2458-68, DOI:10.1111/j.1538-7836.2010.04021.x, PMID 20723033.
- ^ JI. Weitz, SJ. Connolly; I. Patel; D. Salazar; S. Rohatagi; J. Mendell; H. Kastrissios; J. Jin; S. Kunitada, Randomised, parallel-group, multicentre, multinational phase 2 study comparing edoxaban, an oral factor Xa inhibitor, with warfarin for stroke prevention in patients with atrial fibrillation., in Thromb Haemost, vol. 104, n. 3, Set 2010, pp. 633-41, DOI:10.1160/TH10-01-0066, PMID 20694273.
- ^ CT. Ruff, RP. Giugliano; EM. Antman; SE. Crugnale; T. Bocanegra; M. Mercuri; J. Hanyok; I. Patel; M. Shi; D. Salazar; CH. McCabe, Evaluation of the novel factor Xa inhibitor edoxaban compared with warfarin in patients with atrial fibrillation: design and rationale for the Effective aNticoaGulation with factor xA next GEneration in Atrial Fibrillation-Thrombolysis In Myocardial Infarction study 48 (ENGAGE AF-TIMI 48)., in Am Heart J, vol. 160, n. 4, Ott 2010, pp. 635-41, DOI:10.1016/j.ahj.2010.06.042, PMID 20934556.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su edoxaban
Wikimedia Commons contiene immagini o altri file su edoxaban









