Indice
Diamante sintetico

Un diamante sintetico è un diamante prodotto attraverso un processo tecnologico, mentre i diamanti naturali vengono prodotti da un processo di natura geologica. Il diamante sintetico è anche conosciuto come diamante HPHT o CVD, sigle che ne definiscono il metodo produttivo: High - Pressure High - Temperature (sintesi ad elevata pressione e temperatura) e Chemical Vapor Deposition (sintesi a deposizione chimica da vapore).
I tentativi di produrre diamanti sintetici sono stati numerosi, e documentati tra il 1879 e il 1928, la maggior parte dei quali sono stati analizzati attentamente, ma nessuno fu confermato. Solo a partire dal 1940, negli Stati Uniti, in Svezia e nell'Unione sovietica, usando i processi CVD e HPHO ha avuto inizio una vera e propria ricerca sistematica.
La prima sintesi riproducibile venne realizzata intorno al 1953. Un terzo metodo, noto come Detonation Synthesis, sintesi per detonazione, è entrato nel mercato dei diamanti solo alla fine del 1990. In questo processo, vengono creati granelli di diamante di dimensioni nanometriche tramite una detonazione di esplosivi contenenti carbonio. In laboratorio è stato dimostrato un quarto metodo trattando grafite con ultrasuoni ad alta potenza, ma attualmente non ha applicazioni commerciali.
Le proprietà del diamante sintetico dipendono dai dettagli dei processi produttivi, e possono essere inferiori o superiori a quelle del diamante naturale: la durezza, la conducibilità termica e la mobilità degli elettroni sono superiori in alcuni diamanti sintetici. Di conseguenza, il diamante sintetico è ampiamente usato in prodotti abrasivi, in strumenti di taglio e lucidatura, e in dissipatori di calore.
Sono in fase di sviluppo anche diamanti sintetici per applicazioni elettroniche, compresi in dispositivi ad alta potenza nelle centrali elettriche, nei transistor per alte frequenze e nei LED. Diamanti sintetici vengono utilizzati nelle strutture di ricerca ad alta energia all'interno di rivelatori a raggi ultravioletti (UV). Grazie alla sua combinazione unica di stabilità termica e chimica, bassa dilatazione termica ed alta trasparenza ottica in una vasta gamma spettrale, il diamante sintetico è ormai il materiale più importante per finestre ottiche a laser CO2 ad alta potenza e per il gyrotron[1].
Storia
[modifica | modifica wikitesto]Dopo la scoperta del 1797 che il diamante era composto da carbonio puro, furono fatti molti tentativi per convertire quest'ultimo in diamante. I primi successi vennero ottenuti da James Ballantyne Hannay nel 1879[2] e da Ferdinando Frédéric Henri Moissan nel 1893. Il loro metodo richiedeva il riscaldamento di una fornace a carbone fino alla temperatura di 3.500 °C di ferro fuso in un crogiolo di carbonio.
Mentre Hannay utilizzò un tubo riscaldato a fiamma, Moissan applicò una sua recente invenzione, il forno elettrico ad arco, in cui un arco elettrico venne fatto scoccare fra barre di carbonio all'interno di blocchi di calce[3]. Il ferro fuso veniva poi rapidamente raffreddato mediante l'immersione in acqua. La contrazione generata dal raffreddamento presumibilmente produsse l'alta pressione necessaria per trasformare la grafite in diamante. Moissan pubblicò nel 1894 il suo lavoro in una serie di articoli.[4]
Molti altri scienziati provarono a replicare gli esperimenti di Moissan. William Crookes rivendicò il successo nel 1909. Otto Ruff lo rivendicò nel 1917 per aver prodotto diamanti fino a 7 mm di diametro,[5] ma in seguito ritrattò la sua dichiarazione[6]. Nel 1926, il Dr. Willard Hershey del Mc Pherson College replicò gli esperimenti di Moissan e Ruff[7][8], producendo un diamante sintetico, esemplare in mostra presso il Museo McPherson in Kansas[9]. Nonostante le affermazioni di Moissan, Ruff e Hershey, altri sperimentatori non furono in grado di riprodurre i loro esperimenti.[10][11]
I tentativi definitivi di riproduzione vennero eseguiti da Charles Algernon Parsons, scienziato di primo piano e ingegnere, noto per l'invenzione della turbina a vapore. Impiega 40 anni (1882-1922) e una parte considerevole della sua fortuna cercando di riprodurre gli esperimenti di Moissan e Hannay, ma anche adattando i suoi processi[12]. Parsons era noto per il suo approccio accurato e scrupoloso, e la metodica conservazione della documentazione. Tutti i suoi campioni ottenuti sono stati conservati da terzi per ulteriori analisi.[13] Ha scritto numerosi articoli, alcuni dei primi sul diamante HPHT in cui affermava di aver prodotto piccoli diamanti[14]. Tuttavia nel 1928 ha autorizzato il dottor C.H. Desch a pubblicare un articolo,[15] in cui affermava la sua convinzione che nessuno dei diamanti sintetici[16] era stato prodotto fino a tale data. Parson ha suggerito che la maggior parte dei diamanti prodotti fino a quel momento erano probabilmente spinelli sintetici[10].
Diamond Project della General Electric
[modifica | modifica wikitesto]
Nel 1941 è stato effettuato un accordo tra la General Electric (GE) e la Norton e Carborundum, per sviluppare ulteriormente la sintesi del diamante. Sono stati in grado di scaldare, per alcuni secondi, del carbonio a circa 3.000 °C e ad una pressione di 3,5 Gigapascal (GPa) (circa 35.000 bar). Il progetto venne interrotto poco dopo la Seconda guerra mondiale, e ripreso nel 1951 da F.P. Bundye H.M. Forte, presso i laboratori Schenectady della General Electric. Poco dopo, Tracy Hall e altri ingegneri aderirono.[17]. Il gruppo di Schenectady perfezionava, una cella a incudine di diamante, (DAC), un dispositivo progettato da Percy Bridgman, che, per il suo lavoro ha ricevuto nel 1946 il premio Nobel. Bundy e Strong hanno contribuito ai primi miglioramenti, poi, molti altri ne sono stati fatti da Hall. Il team della General Electric ha utilizzato incudini DAC a carburo di tungsteno all'interno di una pressa idraulica per comprimere un campione di materiale carbonioso tenuto in un contenitore di catlinite,[18] la polvere finiva però in una guarnizione posta al fuori del contenitore.
Hall raggiunse il primo successo commerciale nella sintesi del diamante il 16 dicembre 1954, il cui annuncio è avvenuto solo il 15 febbraio 1955. La sua scoperta è avvenuta utilizzando una pressa a cinghia, in grado di produrre pressioni superiori a 10 GPa[19](100.000 bar) a temperature oltre i 2.000 °C[20]. La pressa a cinghia utilizzava un contenitore di pirofillite in cui venne sciolta grafite all'interno di nichel fuso, cobalto o ferro. Tali metalli hanno agito come una sorta di "solvente catalizzatore", in grado di sciogliere il carbonio accelerando la sua trasformazione in diamante.
Il diamante più grande prodotto è risultato di soli 0,15 mm di diametro, troppo piccolo e visivamente imperfetto per i gioielli, ma utilizzabile per abrasivi industriali. I collaboratori di Hall sono stati in grado di replicare il suo lavoro, e la scoperta fu pubblicata sulla rivista inglese Nature.[21][22] Era il primo ricercatore a sviluppare un diamante sintetico mediante un processo riproducibile, verificabile e ben documentato. Hall ha lasciato la General Electric nel 1955, e tre anni dopo ha sviluppato un nuovo apparato per la sintesi del diamante, una pressa tetraedrica dotata di quattro incudini, per evitare di violare un ordine segreto della US Department of Commerce in merito alle domande di brevetto appartenute alla General Electric.[23]. Hall ha ricevuto il Premio American Chemical Society per l'Invenzione Creativa per il suo lavoro sulla sintesi del diamante[24].
Ultimi sviluppi
[modifica | modifica wikitesto]Una sintesi del diamante indipendente venne realizzata il 16 febbraio 1953 a Stoccolma dall'ASEA (Allmänna Svenska Elektriska Aktiebolaget)[25], una delle principali società svedesi di produzione elettrica. A partire dal 1949, l'ASEA ha impiegato un team di cinque scienziati e ingegneri come parte di un progetto top-secret di "fabbricazione di diamanti" col nome in codice di QUINTUS.
Il team ha utilizzato un ingombrante apparecchio progettato dagli ingegneri Baltzar von Platen e Anders Kämpe[26]. È stata mantenuta per un'ora, all'interno del dispositivo, una pressione di 8,4 GPa, dopo la quale, sono stati prodotti un paio di piccoli diamanti, ma non gemme di qualità o dimensioni accettabili.
Il lavoro venne reso pubblico solo nel 1980[27]. Contemporaneamente, in Corea apparve una nuova azienda concorrente, la ILJIN Diamond, seguita da centinaia di imprese cinesi. Nel 1988, la Iljin Diamond ha presumibilmente realizzato la sintesi del diamante attraverso un'appropriazione indebita di segreti commerciali della General Electric da parte di un coreano ex dipendente.[28][29]

La General Electric dal 1970 produce cristalli di diamante sintetico di qualità gemma, produzione resa pubblica solo nel 1971. Per realizzare i primi diamanti e con successo, hanno utilizzato un tubo in pirofillite seminato ad ogni estremità con pezzi sottili di diamante. La grafite venne posta al centro e il metallo solvente, il nichel, tra la grafite ed i semi di diamante. Il contenitore era riscaldato e la pressione portata a circa 5,5 GPa. I cristalli si sono sviluppati dal centro verso l'estremità del tubo, ed estendendo la durata del processo, hanno prodotto grandi cristalli. Inizialmente il processo di crescita in una settimana ha prodotto gemme di qualità, di circa 5 mm[30], con condizioni di processo più stabili possibili. La grafite fu presto sostituita da granelli di diamante, perché questi hanno consentito un controllo migliore nella progettazione della forma del cristallo finale[22].
I primi gioielli di qualità gemma (trasparente o semitrasparente) erano sempre variegati in una gamma di colori che andava dal giallo al marrone, a causa della contaminazione con l'azoto. Le inclusioni erano comuni, in particolare i diamanti "piastriformi" provenienti dal nichel. Rimuovendo dal processo tutto l'azoto con aggiunta di alluminio o titanio, si sono prodotte pietre incolori, e, rimuovendo l'azoto e aggiungendo boro, sono state prodotte pietre blu[31]. La rimozione dell'azoto ha altresì rallentato il processo di crescita e ha ridotto la qualità cristallina, così che il processo è stato normalmente eseguito con presenza di azoto.
Anche se le pietre prodotte dalla General Electric e i diamanti naturali erano chimicamente identici, le loro proprietà fisiche non erano le stesse. Le pietre incolori, sottoposte alla luce ultravioletta ad alta frequenza, producevano forte fluorescenza e fosforescenza, ma erano inerti sotto la luce ultravioletta a bassa frequenza.
Tra i diamanti naturali, solo le più rare gemme blu mostrano queste proprietà. A differenza dei diamanti naturali, tutte le pietre della General Electric hanno registrato sotto i raggi X, una forte fluorescenza di colore giallo[32]. Il De Beers Diamond Research Laboratory ha prodotto per fini di ricerca, pietre fino a 25 carati. Sono state tenute condizioni stabili HPHT per ben sei settimane per produrre diamanti di queste dimensioni e di alta qualità. Per motivi economici, la crescita della maggior parte dei diamanti sintetici termina quando raggiungono un peso da 1 a 1,5 carati[33].
Negli anni 1950 si è avviata una ricerca, sia in Unione Sovietica che negli Stati Uniti, sulla crescita dei diamanti sintetici da pirolisi di gas di idrocarburi, alla temperatura relativamente bassa di 800 °C. Questo processo a bassa pressione è conosciuto come Deposizione chimica da vapore (CVD).
Nel 1953, William G. Eversole affermò di aver ottenuto la deposizione di vapore di diamante su un substrato di diamante, ma tale risultato venne reso pubblico solo nel 1962[34]. La deposizione di film di diamante fu riprodotta nel 1968, e in modo indipendente, da Angus e collaboratori[35], e nel 1970 da Deryagin e Fedoseev[36]. Eversole e Angus hanno usato grandi, costosi, singoli cristalli di diamante come substrati, mentre Deryagin e Fedoseev riuscirono a realizzare film di diamante su materiali non-diamante (silicio e metalli). Questo successo, negli anni 80, ha dato un forte impulso ad una massiccia ricerca sulla creazione di rivestimenti più economici di film di diamante[37].
Tecnologie di produzione
[modifica | modifica wikitesto]Vi sono diversi metodi utilizzati per la produzione di diamanti sintetici. Il metodo originale utilizza alta pressione ed alta temperatura (HPHT), ed è ancora ampiamente utilizzato a causa del suo costo di produzione relativamente basso. Il processo prevede presse di grandi dimensioni del peso di centinaia di tonnellate per produrre una pressione di 5 GPa (50.000 bar) alla temperatura di 1.500 °C. Il secondo metodo, mediante deposizione chimica da vapore (CVD), crea un plasma di carbonio su un substrato sul quale si depositano atomi di carbonio atti a formare il diamante. Altri metodi includono la formazione di diamanti tramite detonazione (nanodiamanti da detonazione) e sonicazione in soluzioni di grafite.[38][39][40].
Alta pressione, alta temperatura (HPHT)
[modifica | modifica wikitesto]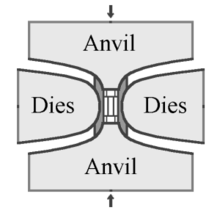
Nel metodo HPHT, sono state realizzati tre diversi modelli di presse utilizzate per fornire la pressione e la temperatura necessarie per la produzione di diamanti sintetici: la pressa a cinghia, la pressa cubica e la pressa split-sphere (BARS). L'invenzione originale della General Electric di Tracy Hall, utilizza la pressa a cinghia. In questa pressa l'incudine superiore e inferiore forniscono il carico di pressione necessario, ad una cella cilindrica interna. Questa pressione interna è limitata a raggiera da una cintura di fasce d'acciaio. Le incudini servono anche come elettrodi che forniscono corrente elettrica alla cella compressa. Una variante della pressa a cinghia utilizza la pressione idraulica, piuttosto che le cinghie in acciaio, per confinare la pressione interna[41]. Le presse a cinghia sono ancora oggi utilizzate, ma sono costruite su una scala molto più grande di quelle del progetto originale[42].
La seconda tipologia è la pressa cubica. È dotata di sei incudini che forniscono simultaneamente la pressione su tutte le facce di un volume a forma di cubo.[43] La prima pressa multi-incudine era a forma tetraedrica, e utilizzava quattro incudini convergenti su un volume a forma di tetraedro[44]. La pressa cubica venne creata di lì a poco per aumentare il volume sul quale viene applicata la pressione. Una pressa cubica è in genere più piccola di una pressa a cinghia e può raggiungere più rapidamente la pressione e la temperatura necessaria per creare il diamante sintetico.
Tuttavia, la pressa cubica non può essere facilmente progettata per grandi volumi: il volume pressurizzato può essere aumentato utilizzando grandi incudini, ma questo aumenta anche la forza necessaria agli incudini, per raggiungere la stessa pressione. Un'alternativa è quella di aumentare il rapporto superficie / volume pressurizzato, utilizzando più incudini in grado di convergere su un solido platonico di ordine superiore, come un dodecaedro. Tuttavia, una tale pressa risulta complessa e difficile da produrre[43].

La macchina BARS è la più compatta, efficiente ed economica di tutte le presse per la produzione di diamanti. Nel centro di un dispositivo BARS è situata una "capsula di sintesi" cilindrica in ceramica di circa 2 cm³. La cella è collocata in un cubo di materiale, ed è atta a favorire la trasmissione della pressione, ad esempio la pirofillite ceramica, pressata da incudini interni in carburo cementato (ad esempio, carburo di tungsteno o in lega VK10)[45]. La cavità ottaedrica esterna viene premuta da 8 incudini esterni in acciaio. Dopo il montaggio, il tutto è bloccato in una "botte" di un diametro di circa 1 metro. La botte è riempita di olio, pressurizzata nella fase di riscaldamento, e trasferito alla cella centrale. La capsula di sintesi è riscaldata da un riscaldatore coassiale in grafite, mentre la temperatura è misurata mediante una termocoppia[46].
Deposizione chimica da vapore
[modifica | modifica wikitesto]La deposizione chimica da vapore (CVD da Chemical Vapor Deposition) è un metodo attraverso il quale si realizzano diamanti partendo da una miscela di gas di idrocarburi. Dall'inizio degli anni '80 questo metodo fu oggetto di intensa ricerca in tutto il mondo. Considerando che la produzione di massa di cristalli di diamante di alta qualità rendono il processo HPHT la scelta più adatta per le applicazioni industriali, la flessibilità e la semplicità della CVD spiegano la popolarità della sua crescita nei laboratori di ricerca. I vantaggi della crescita del diamante col metodo CVD includono la possibilità di "coltivare" diamanti su vaste aree e su supporti diversi, con il controllo preciso delle impurità chimiche e, quindi, delle proprietà del diamante prodotto. A differenza del processo HPHT, il processo CVD non richiede alte pressioni, la crescita si verifica in genere ad una pressione inferiore a 27 kPa[38][47].
La crescita dei diamanti mediante processo CVD comporta la preparazione di un substrato, alimentando in una camera, una quantità variabile di vari gas. La sua preparazione comprende la scelta del materiale appropriato, il suo orientamento cristallografico, la pulizia dello stesso con polvere di diamante ottimizzando la temperatura del substrato durante la crescita a circa 800 °C, attraverso una serie di prove. I gas includono sempre una fonte di carbonio, tipicamente metano e idrogeno al tipico rapporto di 1:99. L'idrogeno è essenziale in quanto corrode selettivamente il carbonio non-diamante. I gas vengono ionizzati in radicali chimicamente attivi nella camera di crescita utilizzando microonde, un filamento caldo, un arco elettrico, un laser, un fascio elettronico o altri mezzi.
Durante la crescita, i materiali della cavità sono incisi dal plasma e si possono incorporare nel diamante in crescita. In particolare, il diamante CVD è spesso contaminato da silicio proveniente sia dalla cavità che dal substrato di silicio[48]. Contaminanti di boro nella cavità, anche a bassissima percentuale, lo rendono inadatto alla crescita del diamante puro.[38]
Detonazione di esplosivi
[modifica | modifica wikitesto]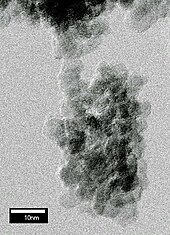
È possibile formare nanocristalli di diamante (5 nm di diametro) detonando alcuni esplosivi contenenti carbone all'interno di una camera metallica. Questi nanocristalli sono chiamati "nanodiamanti da detonazione". Durante l'esplosione, la pressione e la temperatura nella camera di diventano abbastanza alti per convertire il carbonio degli esplosivi in diamante. Immersa in acqua, la camera dopo l'esplosione si raffredda rapidamente, impedendo la conversione del diamante appena formato, in grafite più stabile[49]. In una variante di questa tecnica, un tubo metallico riempito con polvere di grafite è posto nella camera di detonazione. L'esplosione scalda e comprime la grafite in misura sufficiente per la sua conversione in diamante[50]. Il prodotto è sempre ricco in grafite e altre forme di carbonio non-diamante e richiede per scioglierlo una prolungata ebollizione in acido nitrico caldo (circa 1 giorno a 250 °C)[39]. La polvere recuperata di nanodiamanti viene utilizzata principalmente in lucidatura. È prodotto principalmente in Cina, Russia e Bielorussia e solo ora sta iniziando a raggiungere il mercato con quantità all'ingrosso[51].
Cavitazione ultrasonica
[modifica | modifica wikitesto]A partire da una sospensione di grafite in un liquido organico a pressione atmosferica e temperatura ambiente utilizzando la cavitazione ultrasonica è possibile sintetizzare cristalli di diamante di dimensioni micrometriche. La resa in diamante è di circa il 10% del peso iniziale della grafite. Il costo stimato di diamante prodotto con questo metodo è paragonabile a quella del metodo HPHT; la perfezione cristallina del prodotto è significativamente peggiore per la sintesi ad ultrasuoni, ma è una tecnica che richiede un'attrezzatura relativamente semplice, come anche sono semplici le procedure, ma è stato solo segnalata da due gruppi di ricerca, e, per ora, non ha alcun uso industriale. I numerosi parametri di processo, come la preparazione iniziale della polvere di grafite, la scelta della potenza degli ultrasuoni, il tempo di sintesi e il solvente, non sono ancora ottimizzati, per cui lasciano una finestra di potenziale miglioramento sia nell'efficienza che nella riduzione dei costi.[40][52].
Proprietà
[modifica | modifica wikitesto]Tradizionalmente, l'assenza di difetti nel cristallo è considerata la qualità più importante in un diamante. Purezza ed alta perfezione cristallina li rendono trasparenti e chiari, considerando che la loro durezza, la dispersione ottica (lucentezza) e la stabilità chimica, ne fanno una gemma popolare. Per le applicazioni tecniche, è anche importante l'alta conducibilità termica. Mentre l'alta dispersione ottica è una proprietà intrinseca di tutti i diamanti, le loro altre proprietà variano a seconda di come il diamante è stato creato[53].
Cristallinità
[modifica | modifica wikitesto]Il diamante può essere monocristallino, o può essere composto di tanti piccoli cristalli (policristallino). Il diamante monocristallino grande, chiaro e trasparente è in genere utilizzato in gioielleria. Il diamante policristallino è composto da numerosi piccoli grani, che sono facilmente visibili ad occhio nudo attraverso il forte assorbimento di luce e dispersione, ma non è adatto per le gemme e viene utilizzato per applicazioni industriali, nelle miniere e negli utensili da taglio. Il diamante policristallino è spesso descritto per le dimensioni medie (o cristallite) dei cristalli che lo compongono. I grani cristallini vanno dal nanometro al centinaio di micrometri, solitamente indicati rispettivamente come diamanti "nanocristallini" e diamanti "microcristallini"[54].
Durezza
[modifica | modifica wikitesto]Il diamante ha una durezza di 10 sulla scala di Mohs.[55] La durezza del diamante sintetico dipende dalla sua purezza, dalla perfezione cristallina e dall'orientamento: la durezza maggiore è presente nei cristalli perfetti orientati nella direzione [111][56][57]. Nanocristalli di diamante prodotti attraverso la crescita CVD possono avere una durezza che vanno dal 30 al 75% di quelli di diamante di cristallo singolo, e la durezza può essere controllata per applicazioni specifiche. Alcuni diamanti sintetici monocristallini e diamanti HPHT nanocristallini (vedi diamante aggregato nanorod) sono più duri rispetto a qualsiasi diamante naturale conosciuto[58][59][60].
Impurità e inclusioni
[modifica | modifica wikitesto]Ogni diamante contiene altri tipi di atomi oltre che il carbonio, in concentrazioni individuabili mediante tecniche analitiche. Tali atomi si possono aggregare in fasi macroscopiche chiamate inclusioni. Le impurità sono generalmente evitate, ma possono essere introdotte intenzionalmente per controllare alcune proprietà del diamante stesso. Per esempio, il diamante puro è un isolante elettrico, ma il diamante con boro aggiunto è un conduttore elettrico (e, in alcuni casi, un superconduttore[61]) permettendo di essere utilizzato nelle applicazioni elettroniche. Le impurità di azoto ostacolano il movimento delle dislocazioni reticolari (difetti dentro la struttura cristallina) aumentando così la durezza e la resistenza[62].
Conducibilità termica
[modifica | modifica wikitesto]Diversamente dalla maggior parte degli isolanti elettrici, il diamante puro è un buon conduttore di calore a causa del forte legame covalente all'interno del cristallo. La conducibilità termica del diamante puro è la più alta di qualsiasi solido conosciuto. Monocristalli di diamante sintetico arricchito in 12C (99,9%) hanno la più alta conducibilità termica di qualsiasi altro materiale, 3000 W·m−1·K−1 a temperatura ambiente, 7,5 volte superiore a quella del rame; la conducibilità del diamante naturale è ridotta dell'1,1% dal 13C naturalmente presente, che agisce come una disomogeneità presente nel reticolo.
La conducibilità termica del diamante è sfruttata dai gioiellieri e dai gemmologi, i quali possono impiegare una sonda termica elettronica per separare i diamanti veri dalle imitazioni. Le sonde sono costituite da una coppia di termistori a batteria, montata in una punta di rame raffinato. Un termistore funziona come un dispositivo di riscaldamento, mentre l'altro misura la temperatura della punta di rame: se la pietra in prova è un diamante, esso condurrà l'energia termica della punta sufficiente a produrre un calo di temperatura misurabile. Questo test richiede circa 2-3 secondi[63].
Applicazioni
[modifica | modifica wikitesto]Lavorazioni meccaniche e utensili da taglio
[modifica | modifica wikitesto]
La maggior parte delle applicazioni industriali di diamanti sintetici sono da tempo associate alla loro durezza. Questa proprietà fa del diamante il materiale ideale per macchine utensili e utensili da taglio. Conosciuto come il materiale più duro in natura, il diamante può essere usato per lucidare, tagliare, o asportare via tutti gli altri materiali, compresi altri diamanti.
Applicazioni industriali che sfruttano questa qualità, includono punte diamantate, seghe, e uso di polvere di diamante come abrasivo[64]. Queste sono di gran lunga le più importanti applicazioni industriali del diamante sintetico. Sebbene anche il diamante naturale sia usato per questi scopi, il diamante sintetico HPHT è più popolare, soprattutto grazie a ad una migliore riproducibilità delle sue proprietà meccaniche. Il diamante non è adatto a lavorare leghe ferrose ad alta velocità, infatti il carbonio è solubile nel ferro alle alte temperature create queste lavorazioni, con conseguente notevole usura degli utensili diamantati rispetto alle alternative[65].
La forma usuale del diamante in utensili da taglio è in grani di dimensioni micrometriche, dispersi in una matrice metallica (di solito cobalto), sinterizzata sullo strumento. Questo è tipicamente indicato nell'industria come diamante policristallino (PCD). Strumenti a punta diamantata (PCD) vengono utilizzati nel settore minerario e nelle applicazioni da taglio. Per i quindici anni passati, il lavoro è stato fatto per ricoprire strumenti metallici con diamanti CVD, e sebbene il lavoro mostri ancora promesse, non ha significativamente sostituito i tradizionali strumenti in PCD[66].
Conduttori termici
[modifica | modifica wikitesto]Considerando che la maggior parte dei materiali aventi alta conducibilità termica sono elettricamente conduttivi (metalli), il diamante sintetico puro possiede sia un'ottima conducibilità termica che un'irrilevante conducibilità elettrica. Questa combinazione ha un valore inestimabile per l'elettronica, dove viene utilizzato come dissipatore di calore per laser di alta potenza e transistors di alta potenza. Un'efficiente dissipazione del calore prolunga la durata di tali dispositivi, e il loro costo elevato giustifica l'uso di efficienti, anche se relativamente costosi, dissipatori di calore in diamante[67][68]. Nella tecnologia dei semiconduttori, i dissipatori di calore in diamante sintetico evitano il surriscaldamento al silicio e ad altri materiali semiconduttori[69].
Materiali ottici
[modifica | modifica wikitesto]Il diamante è duro, chimicamente inerte, possiede un'alta conducibilità termica e un basso coefficiente di dilatazione termica. Queste caratteristiche lo rendono superiore a qualsiasi altro materiale esistente, utilizzato per la trasmissione della radiazione infrarossa e la radiazione microonde. Pertanto, il diamante sintetico va man mano sostituendo il seleniuro di zinco come interfaccia di output di alta potenza per laser a CO2[70] e gyrotrons. Tali interfacce in diamante sintetico sono a forma di disco a grande diametro (circa 10 cm per i gyrotrons) e spessori piccoli (per ridurre l'absorbimento) e possono essere prodotti solo con la tecnica CVD[71][72].
I recenti progressi nelle tecniche di sintesi HPHT e CVD hanno migliorato la purezza e la perfezione della struttura cristallografica del diamante monocristallino, sufficienti a sostituire il silicio in un reticolo di diffrazione a interfacce in sorgenti di radiazione ad alta potenza, ad esempio i sincrotroni[73][74]. Sia i processi CVD che gli HPHT sono utilizzati anche per creare incudini di diamante otticamente trasparenti, come strumenti per misurare le proprietà elettriche e magnetiche di materiali ad altissima pressione con una cella a incudine di diamante[75].
Elettronica
[modifica | modifica wikitesto]Il diamante sintetico ha un uso potenziale anche come semiconduttore[76], in quanto può essere drogato con impurità, quali il boro e il fosforo. Dal momento che questi elementi contengono un elettrone di valenza in più o in meno rispetto al carbonio, trasformano il diamante sintetico in semiconduttore di tipo-p o di tipo-n. Fare una giunzione p-n dal doping sequenziale di diamanti sintetici con boro e fosforo produce diodi a emettitore di luce (LED) che produce luce UV a 235 nm[77]. Un'altra proprietà utile del diamante sintetico per l'elettronica è l'alta mobilità elettrica, che raggiunge i 4.500 centimetri2/(V·s) nel diamante monocristallino CVD[78]. L'elevata mobilità è vantaggiosa per i transistor ad effetto di campo (FET) di alta frequenza. L'ampio intervallo di banda del diamante (5,5 eV) conferisce ottime caratteristiche dielettriche. In combinazione con l'elevata stabilità meccanica del materiale, queste proprietà vengono utilizzate in prototipi di interruttori ad alta potenza utilizzati nelle centrali elettriche[79].
Sono stati prodotti in laboratorio transistors in diamante sintetico, funzionanti ad una temperatura molto più alta rispetto ai dispositivi in silicio, e resistenti sia danni chimici che da radiazioni. Mentre nessun transistor in diamante è ancora stato integrato con successo nell'elettronica commerciale. È comunque promettente per l'uso di applicazioni che richiedono potenze elevate, e in ambienti ostili non ossidanti[80].
Il diamante sintetico è già utilizzato come dispositivo di rilevazione delle radiazioni.
I diamanti CVD conduttivi sono utilizzati come elettrodi in molte circostanze.[81] Sono stati sviluppati, per esempio, metodi fotochimici per legare covalentemente uno strato sottile (film) di DNA alla superficie policristallina di un diamante prodotto mediante CVD. Tale film di DNA modificato può essere utilizzato per la rilevazione di varie biomolecole, che interagiscono con il DNA modificando in tal modo la conducibilità elettrica del film di diamante.[82] Inoltre, i diamanti possono essere utilizzati per rilevare reazioni redox di bassa intensità, e, in alcuni casi degradare i contaminanti organici redox-reattivi in approvvigionamenti idrici. Poiché il diamante è meccanicamente e chimicamente stabile, può essere usato come elettrodo per distruggere materiali tradizionali. Come elettrodo, i diamanti sintetici possono essere impiegati nel trattamento delle acque reflue degli effluenti organici[83] e la produzione di forti ossidanti[84].
Pietre preziose
[modifica | modifica wikitesto]
I diamanti sintetici utilizzati come pietre preziose sono coltivati con i metodi HPHT[33] o CVD[85]. Sono disponibili nei colori giallo e blu e, in misura minore, incolore (o bianco). Il colore giallo deriva da impurità di azoto nel processo di produzione, mentre il colore blu dal boro[31]. Altri colori come il rosa o il verde sono realizzabili dopo la sintesi mediante irradiazione[86]. Diverse compagnie offrono anche diamanti memoriali composti con resti cremati.[87]
Diamanti di qualità gemma coltivati in laboratorio possono essere chimicamente, fisicamente e otticamente identici ai diamanti presenti in natura, anche se si possono distinguere da un esame spettroscopico nella lunghezza d'onda dell'infrarosso, ultravioletto, o raggi X. Il tester DiamondView della De Beers utilizza la fluorescenza a ultravioletti per rilevare tracce di impurità di azoto, nichel e altri metalli in diamanti HPHT o CVD[88].
Il settore dei diamanti estratti sta valutando contromisure di marketing e di distribuzione a causa della comparsa di diamanti sintetici sul mercato delle gemme. I tre maggiori distributori di diamanti naturali hanno assicurato che le loro gemme saranno messe in vendita rendendo pubblica l'intera storia del diamante stesso, incidendo, nella loro pietra preziosa e con microscopici fasci laser numeri di serie, al fine di distinguere ogni gemma estratta.[85]
Note
[modifica | modifica wikitesto]- ^ Generatore che impiega un accoppiamento di risonanza tra i campi a microonde del ciclotrone e le microonde emesse da un fascio di elettroni
- ^ J. B. Hannay, On the Artificial Formation of the Diamond, in Proc. R. Soc. Lond., vol. 30, 1879, pp. 450–461, DOI:10.1098/rspl.1879.0144.</
- ^ C. Royère, The electric furnace of Henri Moissan at one hundred years: connection with the electric furnace, the solar furnace, the plasma furnace?, in Annales pharmaceutiques françaises, vol. 57, n. 2, 1999, p. 116, PMID 10365467.
- ^ H. Moissan, Nouvelles expériences sur la reproduction du diamant, in Comptes Rendus, vol. 118, 1894, p. 320.
- ^ O. Ruff, Über die Bildung von Diamanten, in Zeitschrift für anorganische und allgemeine Chemie, vol. 99, n. 1, 1917, pp. 73–104, DOI:10.1002/zaac.19170990109.
- ^ K. Nassau, Gems made by Man, Chilton Book Co, 1980, pp. 12–25, ISBN 0-8019-6773-2.
- ^ J. Willard Hershey, The Book of Diamonds: Their Curious Lore, Properties, Tests and Synthetic Manufacture, Kessinger Publishing, 2004, pp. 123–130, ISBN 1-4179-7715-9.
- ^ J. Willard Hershey PhD, Book of Diamonds, Heathside Press, New York, 1940, pp. 127–132, ISBN 0-486-41816-2. URL consultato l'8 febbraio 2011 (archiviato dall'url originale il 5 novembre 2012).
- ^ Permanent collection, su mcphersonmuseum.com, McPherson museum. URL consultato l'8 agosto 2009 (archiviato dall'url originale il 18 maggio 2009).
- ^ a b K. Lonsdale, Further Comments on Attempts by H. Moissan, J. B. Hannay and Sir Charles Parsons to Make Diamonds in the Laboratory (PDF) [collegamento interrotto], in Nature, vol. 196, 1962, p. 104, DOI:10.1038/196104a0.
- ^ M. O'Donoghue, Gems, Elsevier, 2006, pp. 473, ISBN 0-7506-5856-8.
- ^ R. S. Feigelson, 50 years progress in crystal growth: a reprint collection, Elsevier, 2004, pp. 194, ISBN 0-444-51650-6.
- ^ Barnard, pp. 6–7
- ^ C. A. Parson, Some notes on carbon at high temperatures and pressures (PDF) [collegamento interrotto], in Proceedings of the Royal Society of London, 79a, 1907, p. 532, DOI:10.1098/rspa.1907.0062.
- ^ C.H. Desch, The Problem of Artificial Production of Diamonds, in Nature, vol. 121, 1928, p. 799, DOI:10.1038/121799a0.
- ^ Compresi quelli di Moissan e altri.
- ^ R. M. Hazen, The diamond makers, Cambridge University Press, 1999, pp. 100–113, ISBN 0-521-65474-2.
- ^ sf. [sec. XIX; dal nome del mineralogista G. Catlin]. Roccia argillosa, di colore rossastro, contenente notevoli quantità di [[ematite]] e di [[sericite]]. Si ritrova come intercalazione nelle [[quarzite|quarziti]] del [[Cambriano]] dell'America Settentrionale ([[Minnesota]], [[Wisconsin]], ecc.). Era usata per la fabbricazione delle pipe cerimoniali dei pellirosse dette [[calumet]].
- ^ Giga Pascal
- ^ H. T. Hall, Ultra-high pressure apparatus (PDF) [collegamento interrotto], in Rev. Sci. Instr., vol. 31, 1960, p. 125, DOI:10.1063/1.1716907.
- ^ F. P. Bundy, H. T. Hall, H. M. Strong and R. H. Wentorf, Man-made diamonds, in Nature, vol. 176, 1955, p. 51.
- ^ a b H. P. Bovenkerk, F. P. Bundy, H. T. Hall, H. M. Strong and R. H. Wentorf, Preparation of diamond, in Nature, vol. 184, 1959, p. 1094.
- ^ Barnard, pp. 40–43
- ^ ACS Award for Creative Invention, su webapps.acs.org, American Chemical Society. URL consultato l'8 agosto 2009 (archiviato dall'url originale il 5 ottobre 2011).
- ^ Azienda Elettrica Svedese-Tedesca
- ^ H. Liander and E. Lundblad, Artificial diamonds, in ASEA Journal, vol. 28, 1955, p. 97.
- ^ Barnard, pp. 31–33
- ^ General Electric v. Sung, 843 F. Supp. 776: "granting production injunction against Iljin Diamond" cited in M. A. Epstein, Epstein on intellectual property, Aspen Publishers Online, 1998, pp. 121, ISBN 0-7355-0319-2.
- ^ Wm. C. Hannas, The writing on the wall, University of Pennsylvania Press, 2003, pp. 76–77, ISBN 0-8122-3711-0.
- ^ di 1 carato pari a 0,2 g
- ^ a b R. C. Burns, V. Cvetkovic and C. N. Dodge, Growth-sector dependence of optical features in large synthetic diamonds, in Journal of Crystal Growth, vol. 104, 1990, p. 257, DOI:10.1016/0022-0248(90)90126-6.
- ^ Barnard, p. 166
- ^ a b R. Abbaschian et al., High pressure-high temperature growth of diamond crystals using split sphere apparatus, in Diam. Rel. Mater., vol. 14, 2005, p. 1916, DOI:10.1016/j.diamond.2005.09.007.
- ^ W. G. Eversole "Synthesis of diamond" (EN) US3030188, United States Patent and Trademark Office, Stati Uniti d'America., April 17, 1962
- ^ J. C. Angus et al., Growth of Diamond Seed Crystals by Vapor Deposition, in J. Appl. Phys., vol. 39, 1968, p. 2915, DOI:10.1063/1.1656693.
- ^ B.V. Deryagin e D. V. Fedoseev, Epitaxial Synthesis of Diamond in the Metastable Region, in Rus. Chem. Rev. 39, vol. 39, 1970, p. 783, DOI:10.1070/RC1970v039n09ABEH002022.
- ^ Spear and Dismukes, pp. 265–266
- ^ a b c M. Werner et al., Growth and application of undoped and doped diamond films, in Rep. Prog. Phys., vol. 61, 1998, p. 1665, DOI:10.1088/0034-4885/61/12/002.
- ^ a b Osawa, E, Recent progress and perspectives in single-digit nanodiamond, in Diamond and Related Materials, vol. 16, 2007, pp. 2018, DOI:10.1016/j.diamond.2007.08.008.
- ^ a b E. M. Galimov et al., Experimental Corroboration of the Synthesis of Diamond in the Cavitation Process, in Doklady Physics, vol. 49, 2004, p. 150, DOI:10.1134/1.1710678.
- ^ HPHT synthesis, su diamondlab.org, International Diamond Laboratories. URL consultato il 5 maggio 2009 (archiviato dall'url originale il 1º maggio 2009).
- ^ Barnard, p. 150
- ^ a b E. Ito, Multianvil cells and high-pressure experimental methods, in Treatise of Geophysics, a cura di G. Schubert, vol. 2, Elsevier, Amsterdam, 2007, pp. 197–230, ISBN 0-8129-2275-1.
- ^ H. T. Hall, Ultrahigh-Pressure Research: At ultrahigh pressures new and sometimes unexpected chemical and physical events occur (PDF) [collegamento interrotto], in Science, vol. 128, n. 3322, 1958, p. 445, DOI:10.1126/science.128.3322.445, PMID 17834381.
- ^ M. G. Loshak and L. I. Alexandrova, Rise in the efficiency of the use of cemented carbides as a matrix of diamond-containing studs of rock destruction tool, in Int. J. Refractory Metals and Hard Materials, vol. 19, 2001, p. 5, DOI:10.1016/S0263-4368(00)00039-1.
- ^ N. Pal'yanov et al., Fluid-bearing alkaline carbonate melts as the medium for the formation of diamonds in the Earth's mantle: an experimental study, in Lithos, vol. 60, 2002, p. 145, DOI:10.1016/S0024-4937(01)00079-2.
- ^ S. Koizumi, C. E. Nebel and M. Nesladek, Physics and Applications of CVD Diamond, Wiley VCH, 2008, p. 50, ISBN 3527408010.
- ^ J. Barjon, E. Rzepka, F. Jomard, J.-M. Laroche, D. Ballutaud, T. Kociniewski e J. Chevallier, Silicon incorporation in CVD diamond layers, in Physica status solidi (a), vol. 202, 2005, pp. 2177, DOI:10.1002/pssa.200561920.
- ^ K. Iakoubovskii, Structure and defects of detonation synthesis nanodiamond, in Diamond and Related Materials, vol. 9, 2000, pp. 861, DOI:10.1016/S0925-9635(99)00354-4.
- ^ P. Decarli, J. Jamieson, Formation of Diamond by Explosive Shock, in Science, vol. 133, n. 3467, giugno 1961, pp. 1821–1822, DOI:10.1126/science.133.3467.1821, PMID 17818997.
- ^ V. Yu. Dolmatov, Development of a rational technology for synthesis of high-quality detonation nanodiamonds, in Russian Journal of Applied Chemistry, vol. 79, 2006, p. 1913, DOI:10.1134/S1070427206120019.
- ^ A. Kh. Khachatryan et al., Graphite-to-diamond transformation induced by ultrasonic cavitation, in Diam. Relat. Mater., vol. 17, 2008, p. 931, DOI:10.1016/j.diamond.2008.01.112.
- ^ Spear and Dismukes, pp. 308–309
- ^ Cynthia G. Zoski, Handbook of Electrochemistry, Elsevier, 2007, pp. 136, ISBN 0-444-51958-0.
- ^ P. G. Read, Gemmology, Butterworth-Heinemann, 2005, pp. 49–50, ISBN 0-7506-6449-5.
- ^ Lungo la diagonale del reticolo cubico del diamante.
- ^ A. J. Neves and M. H. Nazaré, Properties, Growth and Applications of Diamond, IET, 2001, pp. 142–147, ISBN 0-85296-785-3.
- ^ V. Blank et al., Ultrahard and superhard phases of fullerite C60: comparison with diamond on hardness and wear (PDF), in Diamond and Related Materials, vol. 7, 1998, p. 427, DOI:10.1016/S0925-9635(97)00232-X (archiviato dall'url originale il 19 novembre 2008).
- ^ H. Sumiya, Super-hard diamond indenter prepared from high-purity synthetic diamond crystal, in Rev. Sci. Instrum., vol. 76, 2005, p. 026112, DOI:10.1063/1.1850654.
- ^ C-S Yan et al., Ultrahard diamond single crystals from chemical vapor deposition, in Phys. Stat. Solidi (a), vol. 201, 2005, p. R25, DOI:10.1002/pssa.200409033.
- ^ E. Ekimov et al., Superconductivity in diamond (PDF), in Nature, vol. 428, n. 6982, 2004, p. 542, DOI:10.1038/nature02449, PMID 15057827.
- ^ S. A. Catledge e Yogesh K. Vohra, Effect of nitrogen addition on the microstructure and mechanical properties of diamond films grown using high-methane concentrations, in Journal of Applied Physics, vol. 86, 1999, p. 698, DOI:10.1063/1.370787.
- ^ J. F. Wenckus "Method and means of rapidly distinguishing a simulated diamond from natural diamond" (EN) US4488821, United States Patent and Trademark Office, Stati Uniti d'America. December 18, 1984
- ^ C. Holtzapffel, Turning And Mechanical Manipulation, Holtzapffel, 1856, pp. 176–178, ISBN 1-879335-39-5.
- ^ R. T. Coelho et al., The application of polycrystalline diamond (PCD) tool materials when drilling and reaming aluminum-based alloys including MMC, in International journal of machine tools & manufacture, vol. 35, 1995, p. 761, DOI:10.1016/0890-6955(95)93044-7.
- ^ W. Ahmed et al., Diamond films grown on cemented WC-Co dental burs using an improved CVD method, in Diamond and Related Materials, vol. 12, 2003, p. 1300, DOI:10.1016/S0925-9635(03)00074-8.
- ^ CVD Thick-Film Diamond Heat Spreaders, su sp3inc.com, sp3 diamond technologies. URL consultato il 5 maggio 2009 (archiviato dall'url originale il 20 agosto 2008).
- ^ M. Sakamoto, J. G. Endriz, D. R. Scifres, 120 W CW output power from monolithic AlGaAs (800 nm) laser diode array mounted on diamond heatsink, in Electronics Letters, vol. 28, n. 2, 1992, pp. 197–199, DOI:10.1049/el:19920123.
- ^ Kramadhati V. Ravi et al. "Diamond-silicon hybrid integrated heat spreader" (EN) US6924170, United States Patent and Trademark Office, Stati Uniti d'America., August 2, 2005
- ^ D. C. Harris, Materials for infrared windows and domes: properties and performance, SPIE Press, 1999, pp. 303–334, ISBN 0-8194-3482-5.
- ^ T. Inai et al., The diamond window for a milli-wave zone high power electromagnetic wave output, in New Diamond, vol. 15, 1999, p. 27.
- ^ G. S. Nusinovich, Introduction to the physics of gyrotrons, JHU Press, 2004, pp. 229, ISBN 0-8018-7921-3.
- ^ A. M. Khounsary et al, Diamond Monochromator for High Heat Flux Synchrotron X-ray Beams, su aps.anl.gov, Argonne National Laboratory. URL consultato il 5 maggio 2009 (archiviato dall'url originale il 12 ottobre 2008).
- ^ J. Heartwig et al, Diamonds for Modern Synchrotron Radiation Sources, su esrf.eu, European Synchrotron Radiation Facility. URL consultato il 5 maggio 2009 (archiviato dall'url originale il 24 marzo 2015).
- ^ D.D. Jackson et al. Jackson, D. D., C. Aracne-Ruddle, V. Malba, S. T. Weir, S. A. Catledge e Y. K. Vohra, Magnetic susceptibility measurements at high pressure using designer diamond anvils, in Rev. Sci. Instrum., vol. 74, 2003, p. 2467, DOI:10.1063/1.1544084.
- ^ A. Denisenko and E. Kohn, Diamond power devices. Concepts and limits, in Diamond and Related Materials, vol. 14, 2005, p. 491, DOI:10.1016/j.diamond.2004.12.043.
- ^ S. Koizumi et al., Ultraviolet Emission from a Diamond pn Junction, in Science, vol. 292, n. 5523, 2001, p. 1899, DOI:10.1126/science.1060258, PMID 11397942.
- ^ J. Isberg et al., High Carrier Mobility in Single-Crystal Plasma-Deposited Diamond, in Science, vol. 297, n. 5587, 2002, p. 5587, DOI:10.1126/science.1074374, PMID 12215638.
- ^ J. Isberg, M. Gabrysch, A. Tajani, and D.J. Twitchen, High-field Electrical Transport in Single Crystal CVD Diamond Diodes, in Advances in Science and Technology, vol. 48, 2006, p. 73, DOI:10.4028/www.scientific.net/AST.48.73.
- ^ T. A. Railkar et al., A critical review of chemical vapor-deposited (CVD) diamond for electronic applications, in Critical Reviews in Solid State and Materials Sciences, vol. 25, 2000, p. 163, DOI:10.1080/10408430008951119.
- ^ M. Panizza and G. Cerisola, Application of diamond electrodes to electrochemical processes, in Electrochimica Acta, vol. 51, 2005, p. 191, DOI:10.1016/j.electacta.2005.04.023.
- ^ C. E. Nebel et al., Inhomogeneous DNA bonding to polycrystalline CVD diamond, in Diamond and Related Materials, vol. 16, 2007, p. 1648, DOI:10.1016/j.diamond.2007.02.015.
- ^ D. Gandini, E. Mahé, P.A. Michaud, W. Haenni, A. Perret, Ch. Comninellis, Oxidation of carbonylic acids at boron-doped diamond electrodes for wastewater treatment, in Journal of Applied Electrochemistry, vol. 20, 2000, p. 1345, DOI:10.1023/A:1026526729357.
- ^ P.A. Michaud, E. Mahé, W. Haenni, A. Perret, Ch. Comninellis, Preparation of peroxodisulfuric acid using Boron-Doped Diamond thin film electrodes, in Electrochemical and Solid-State Letters, vol. 3, 2000, p. 77, DOI:10.1149/1.1390963.
- ^ a b Amanda Yarnell, The Many Facets of Man-Made Diamonds, in Chemical & Engineering News, vol. 82, n. 5, American Chemical Society, 2 febbraio 2004, pp. 26–31, ISSN 0009-2347.
- ^ J. Walker, Optical absorption and luminescence in diamond, in Rep. Prog. Phys., vol. 42, 1979, p. 1605, DOI:10.1088/0034-4885/42/10/001.
- ^ Memorial Diamonds Deliver Eternal Life, su reuters.com, Reuters, 23 giugno 2009. URL consultato l'8 agosto 2009 (archiviato dall'url originale il 12 settembre 2012).
- ^ O'Donoghue, p. 115
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Diamante sintetico
Wikimedia Commons contiene immagini o altri file su Diamante sintetico
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) synthetic diamond, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- (EN) IUPAC Gold Book, "diamond by CVD", su goldbook.iupac.org.
| Controllo di autorità | LCCN (EN) sh85037571 · J9U (EN, HE) 987007553034305171 |
|---|









