Indice
Bicromato di sodio
| Bicromato di sodio | |
|---|---|
 | |
 | |
| Nomi alternativi | |
| dicromato di sodio | |
| Caratteristiche generali | |
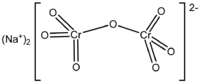
| Formula bruta o molecolare | Na2Cr2O7 |
| Massa molecolare (u) | 261,97 g/mol |
| Aspetto | solido arancione |
| Numero CAS | |
| Numero EINECS | 234-190-3 |
| PubChem | 25408 e 129628287 |
| SMILES | [O-][Cr](=O)(=O)O[Cr](=O)(=O)[O-].[Na+].[Na+] |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 2,35 (20 °C) (diidrato) |
| Solubilità in acqua | 731,8 g/l (20 °C) (diidrato) |
| Temperatura di fusione | 356 °C (629 K) (sost. anidra) |
| Temperatura di ebollizione | 400 °C (673 K) (decomposizione) |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
    
| |
| pericolo | |
| Frasi H | 272 - 301 - 312 - 330 - 314 - 317 - 334 - 340 - 372 - 350 - 360fd - 410 |
| Consigli P | 201 - 273 - 280 - 301+330+331 - 302+352 - 304+340 - 305+351+338 - 308+310 [1] |
Il dicromato di sodio è il composto inorganico di formula Na2Cr2O7. Di solito, tuttavia, il sale si trova in forma diidrata Na2Cr2O7 · 2H2O. Praticamente tutto il minerale di cromo viene lavorato tramite conversione in dicromato di sodio e praticamente tutti i composti e i materiali a base di cromo vengono preparati da questo sale.[2] In termini di reattività e aspetto, il dicromato di sodio e il dicromato di potassio sono molto simili. Il sale di sodio è, tuttavia, circa venti volte più solubile in acqua del sale di potassio (49 g/L a 0 °C) e anche il suo peso equivalente è inferiore.[3]
Produzione
[modifica | modifica wikitesto]Il dicromato di sodio viene prodotto su larga scala da minerali contenenti ossidi di cromo(III). Il minerale è fuso con una base, tipicamente carbonato di sodio, a circa 1000 °C in presenza di aria (fonte di ossigeno):
Questo passaggio solubilizza il cromo e ne consente l'estrazione in acqua calda. In questa fase, altri componenti del minerale, come alluminio e composti del ferro, sono scarsamente solubili. L'acidificazione dell'estratto acquoso risultante con acido solforico o anidride carbonica produce il dicromato:
Il dicromato è isolato come il diidrato per cristallizzazione. In questo modo vengono prodotti ogni anno milioni di chilogrammi di dicromato di sodio.
Poiché il cromo(VI) è tossico, specialmente in forma di polvere, tali fabbriche sono soggette a severi regolamenti. Ad esempio, gli effluenti di tali raffinerie vengono trattati con agenti riducenti per riportare qualsiasi cromo(VI) al cromo(III), che è meno pericoloso per l'ambiente.[2] Sono noti una varietà di idrati di questo sale, che vanno dal decaidrato inferiore a 19,5 °C, nonché esa-, tetra- e diidrati. Sopra 62 °C, questi sali perdono acqua spontaneamente per dare il materiale anidro. Si cristallizza a 30-35 °C.
Reazioni
[modifica | modifica wikitesto]I sali di dicromato e cromato sono agenti ossidanti. Per la concia della pelle, il dicromato di sodio viene prima ridotto con anidride solforosa.
Nella sintesi organica,[3] questo composto ossida legami benzilici e allilici C-H in derivati del carbonile. Ad esempio, il 2,4,6-trinitrotoluene viene ossidato nell'acido carbossilico corrispondente.[4] Analogamente, il 2,3-dimetilnaftalene viene ossidato da Na2Cr2O7 in acido 2,3-naftalendicarbossilico.[5]
Gli alcoli secondari sono ossidati al corrispondente chetone, per es. mentolo al mentone;[6] diidrocolesterolo a colestanone:[7]
Rispetto al sale di potassio, il principale vantaggio del dicromato di sodio è la sua maggiore solubilità in acqua e solventi polari, come l'acido acetico.
Il dicromato di sodio può essere utilizzato nella conversione di fluorene in fluorenone.
Sicurezza
[modifica | modifica wikitesto]Come tutti i composti di cromo esavalente, il dicromato di sodio è cancerogeno.[8] Il composto è anche corrosivo e l'esposizione può provocare gravi lesioni oculari o cecità.[9] L'esposizione prolungata può causare inoltre ridotta fertilità, danni genetici ereditari e danni al feto.
Note
[modifica | modifica wikitesto]- ^ scheda del bicromato di sodio su IFA-GESTIS Archiviato il 16 ottobre 2019 in Internet Archive.
- ^ a b Gerd Anger, Jost Halstenberg, Klaus Hochgeschwender, Christoph Scherhag, Ulrich Korallus, Herbert Knopf, Peter Schmidt, Manfred Ohlinger, "Chromium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005. DOI: 10.1002/14356007.a07_067
- ^ a b Freeman, F. "Sodium Dichromate" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI: 10.1002/047084289.
- ^ (EN) Organic Syntheses, http://www.orgsyn.org/demo.aspx?prep=cv1p0543.
- ^ (EN) Organic Syntheses, http://www.orgsyn.org/demo.aspx?prep=cv5p0810.
- ^ (EN) Organic Syntheses, vol. 9, http://www.orgsyn.org/demo.aspx?prep=cv1p0340.
- ^ (EN) Organic Syntheses, http://www.orgsyn.org/demo.aspx?prep=cv2p0139.
- ^ IARC, Volume 100C: Arsenic, Metals, Fibres, and Dusts (PDF), Lyon, International Agency for Research on Cancer, 2012 [17-24 March 2009], ISBN 978-92-832-0135-9. URL consultato il 5 gennaio 2020 (archiviato dall'url originale il 17 marzo 2020).«There is sufficient evidence in humans for the carcinogenicity of chromium (VI) compounds. Chromium (VI) compounds cause cancer of the lung. Also positive associations have been observed between exposure to Chromium (VI) compounds and cancer of the nose and nasal sinuses. There is sufficient evidence in experimental animals for the carcinogenicity of chromium (VI) compounds. Chromium (VI) compounds are carcinogenic to humans (Group 1).»
- ^ ILO 1369 - Sodium Dichromate
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Bicromato di sodio
Wikimedia Commons contiene immagini o altri file su Bicromato di sodio
Collegamenti esterni
[modifica | modifica wikitesto]- Bicromato di Sodio, sulla Matrice di esposizione a cancerogeni - MATline, su dors.it.
- (EN) sodium dichromate, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.













