Aldeide salicilica
| Aldeide salicilica | |
|---|---|
 | |
| Nome IUPAC | |
| 2-idrossibenzaldeide | |
| Nomi alternativi | |
| Salicilaldeide | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C7H6O2 |
| Massa molecolare (u) | 122,12 g/mol |
| Aspetto | liquido giallastro |
| Numero CAS | |
| Numero EINECS | 201-961-0 |
| PubChem | 6998 |
| SMILES | C1=CC=C(C(=C1)C=O)O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,17 (20 °C) |
| Solubilità in acqua | 14 g/l (20 °C) appena solubile |
| Temperatura di fusione | −7 °C (266 K) |
| Temperatura di ebollizione | 194 °C (467 K) |
| Indicazioni di sicurezza | |
| Punto di fiamma | 77 °C (350 K) |
| Simboli di rischio chimico | |
 
| |
| pericolo | |
| Frasi H | 302 - 311 - 315 - 319 - 341 |
| Consigli P | 280 - 305+351+338 - 312 [1] |
L'aldeide salicilica è un'aldeide aromatica. Insieme alla 3-idrossibenzaldeide e alla 4-idrossibenzaldeide, è uno dei tre isomeri dell'idrossibenzaldeide.
A temperatura ambiente si presenta come un liquido oleoso da incolore a giallo chiaro dall'odore caratteristico di mandorle amare. È una delle sostanze che compongono l'aroma del grano saraceno[2].
L'aldeide salicilica è precursore di una grande varietà di agenti chelanti.
Produzione
[modifica | modifica wikitesto]L'aldeide salicilica viene prodotta per trattamento del fenolo con cloroformio in presenza di idrossido di potassio, secondo la reazione di Reimer-Tiemann:[3]
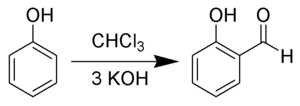
nelle condizioni di reazione viene generato un diclorocarbene :CCl2 che è la specie elettrofila con cui reagisce il fenolo; gli atomi di cloro vengono successivamente allontanati per idrolisi alcalina.
In alternativa, viene prodotta per condensazione del fenolo o derivati con formaldeide per dare alcool idrossibenzilico, che viene poi ossidato ad aldeide.
In generale le salicilaldeidi possono essere preparate dal corrispondente fenolo mediante la reazione di Duff, o mediante trattamento con paraformaldeide in presenza di cloruro di magnesio e una base.[4]
Biologia
[modifica | modifica wikitesto]L'aldeide salicilica è una componente aromatica caratteristica del grano saraceno.[5]
È anche uno dei componenti del castoreum, l'essudato prodotto dal castoro nordamericano e il castoro europeo, utilizzato in profumeria.
Inoltre, la salicilaldeide è presente nelle secrezioni difensive delle larve di diverse specie di coleotteri appartenenti alla famiglia dei Chrysomelina.[6] Un esempio di coleottero che produce l'aldeide salicilica è il coleottero rosso Chrysomela populi.
Reazioni e applicazioni
[modifica | modifica wikitesto]- L'ossidazione con perossido di idrogeno fornisce 1,2-diidrossibenzene (reazione di Dakin).[7]
- L'eterificazione con acido cloroacetico seguita da ciclizzazione da l'eterociclo benzofurano.[8]
- La salicilaldeide viene convertita in chelanti per condensazione con ammine.
- La condensazione aldolica con dietil malonato da la 3-carbetossicumarina (un derivato della cumarina).[9]
Note
[modifica | modifica wikitesto]- ^ Sigma Aldrich; rev. del 16.12.2010
- ^ Janes D, Kreft S: Salicylaldehyde is a characteristic aroma component of buckwheat groats, Food Chemistry 2008; 109: 293-298, DOI: 10.1016/j.foodchem.2007.12.032
- ^ (EN) Friedrich Brühne e Elaine Wright, Benzaldehyde, in Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, American Cancer Society, 2005, DOI:10.1002/14356007.a03_463. URL consultato il 28 marzo 2018 (archiviato il 28 maggio 2021).
- ^ (EN) Trond Vidar Hansen e Lars Skattebøl, Ortho-Formylation of Phenols; Preparation of 3-Bromosalicylaldehyde, in Organic Syntheses, American Cancer Society, 2005, pp. 64–68, DOI:10.1002/0471264229.os082.10. URL consultato il 28 marzo 2018 (archiviato il 28 maggio 2021).
- ^ Damjan Janeš e Samo Kreft, Salicylaldehyde is a characteristic aroma component of buckwheat groats, in Food Chemistry, vol. 109, n. 2, 2008, pp. 293–298, DOI:10.1016/j.foodchem.2007.12.032. URL consultato il 28 marzo 2018.
- ^ (EN) Gerhard Pauls, Tobias Becker e Peter Rahfeld, Two Defensive Lines in Juvenile Leaf Beetles; Esters of 3-nitropropionic Acid in the Hemolymph and Aposematic Warning, in Journal of Chemical Ecology, vol. 42, n. 3, 1º marzo 2016, pp. 240–248, DOI:10.1007/s10886-016-0684-0. URL consultato il 28 marzo 2018 (archiviato il 28 marzo 2018).
- ^ Dakin, H. D. (1923) "Chatechol" in Organic Syntheses 3: 28. Collective Volume 1, p. 149
- ^ Burgstahler, A. W.; Worden, L. R. (1966). "Coumarone" in Organic Syntheses, 46: 28. ; Collective Volume 5, p. 251
- ^ Horning, E. C.; Horning, M. G.; Dimmig, D. A. (1948). "3-Carbethoxycoumarin" in Organic Syntheses. 28: 24. ; Collective Volume, 3, p. 165
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Aldeide salicilica
Wikimedia Commons contiene immagini o altri file su Aldeide salicilica
| Controllo di autorità | GND (DE) 4178953-2 |
|---|








