Utente:Grasso Luigi/sanbox1/isodiazene
| Grasso Luigi/sanbox1/isodiazene | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| diazano | |
| Nomi alternativi | |
| diammina diammide idruro di azoto | |
| Caratteristiche generali | |
| Formula bruta o molecolare | N2H4 |
| Massa molecolare (u) | 32,1 |
| Aspetto | liquido incolore |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,01 |
| Solubilità in acqua | completa |
| Temperatura di fusione | 2 °C (275 K) |
| Temperatura di ebollizione | 113 °C (386 K) |
| Tensione di vapore (Pa) a 293 K | 1400 |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | 50,63 (liq) |
| ΔfG0 (kJ·mol−1) | 159,4 |
| S0m(J·K−1mol−1) | 121,52 (liq) |
| C0p,m(J·K−1mol−1) | 48,4 |
| Indicazioni di sicurezza | |
| Punto di fiamma | 38 °C (311 K) |
| Limiti di esplosione | 1,8 - 100% vol. |
| Temperatura di autoignizione | variabile a seconda del supporto: da 24 °C (297 K) a contatto con superfici di ferro arrugginito a 270 °C (435 K) su lastre di vetro. |
| Simboli di rischio chimico | |
    
| |
| Frasi H | 226 - 350 - 301 - 310 - 330 - 314 - 317 - 410 |
| Consigli P | 301+310 - 303+361+353 - 305+351+338 - 320 - 361 - 405 - 501 [1][2] |
L'idrazina (o diammide, o diammina, o idruro di azoto) è un composto dell'azoto di formula bruta N2H4 (formula di struttura NH2-NH2): a temperatura ambiente è un liquido incolore e dall'odore pungente.
Il termine idrazine si riferisce a una classe di composti organici derivati dall'idrazina sostituendo uno o più atomi d'idrogeno con un gruppo organico (formula di struttura NR2-NR2).[3]
Tossicità
[modifica | modifica wikitesto]È una sostanza corrosiva, tossica e cancerogena: la soglia di contaminazione dell'aria è di 1 ppm, mentre la soglia olfattiva (oltre la quale l'odore è avvertibile) è di 3-5 ppm: già a 20 °C i vapori possono raggiungere tali concentrazioni. A temperature superiori ai 38 °C, se i vapori non vengono dispersi, la miscela aria-vapori di idrazina può raggiungere concentrazioni tali da essere esplosiva.
Sintomi
[modifica | modifica wikitesto]I sintomi immediati del contatto con l'idrazina sono dovuti alla corrosività della sostanza: quindi bruciore, e nel caso di inalazione dei vapori, tosse, capogiro e difficoltà respiratoria: tali sintomi possono presentarsi anche a distanza di 10-12 ore dal contatto.
La tossicità è a carico del fegato, dei reni e del sistema nervoso centrale: i sintomi di un avvelenamento da idrazina sono nausea, vomito, debolezza, confusione, stato di incoscienza. Se l'avvelenamento è avvenuto per inalazione di vapori si può avere edema polmonare. L'ingestione può essere letale.
Proprietà chimiche
[modifica | modifica wikitesto]Chimicamente è una base medio forte e un forte nucleofilo; reagisce violentemente con altri ossidanti, con molti metalli e ossidi.
Ioni dell'idrazina
[modifica | modifica wikitesto]L'idrazina possiede una certa tendenza a protonarsi; a seconda dei casi può subire una protonazione singola o doppia con la formazione rispettivamente del catione idrazinio e dell'idrazinio dicatione [4].
Idrazinio
[modifica | modifica wikitesto]L'idrazinio (conosciuto anche come diazanio[5]) è un catione di formula N2H5+ derivato dalla protonazione dell'idrazina
- H2N-NH2 + H+ → H3N+-NH2
L'idrazinio rappresenta la forma ionica principale impiegata nella preparazione dei sali di idrazina, come ad esempio il solfato di idrazina o il HNF.
Idrazinio dicatione
[modifica | modifica wikitesto]L'idrazinio dicatione è un catione di formula N2H62+. Presenta due cariche positive nette dislocate sugli atomi di azoto, cariche che derivano dalla doppia protonazione dell'idrazina
- H2N-NH2 + 2H+ → H3N+-N+H3
Utilizzi
[modifica | modifica wikitesto]
Viene impiegata come combustibile per missili e per razzi di controllo orbitale e d'assetto, nei satelliti artificiali, nello Space Shuttle come pure nella fabbricazione di alcuni esplosivi a base liquida chiamati astroliti.
L'idrazina si decompone a temperature elevate in presenza di ossigeno liberando azoto e acqua: viene perciò usata come additivo nell'acqua delle caldaie ad alta pressione per deossigenarla ed evitarne la corrosione delle pareti.
Alcuni aerei militari (ad esempio gli F-16 che sono stati in dotazione all'Aeronautica Militare Italiana) utilizzano piccole turbine a gas, dette EPU (Emergency Power Unit), alimentate a idrazina (H-70: miscela di idrazina/acqua 30%/70%), da utilizzarsi come generatore elettrico e idraulico di emergenza in caso di avaria dei generatori principali.
Viene utilizzata anche come rivelatore in fotografia tradizionale ai sali d'argento.[6]
Reazioni tipiche
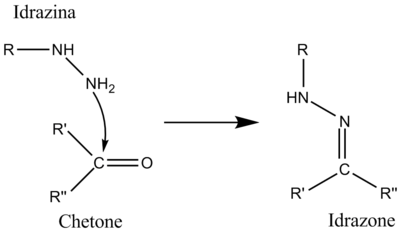
[modifica | modifica wikitesto]Addizione nucleofila di idrazine a chetoni
[modifica | modifica wikitesto]L'idrazina è un composto molto nucleofilo perché i due atomi di azoto si influenzano a vicenda (effetto alfa). La reazione avviene solo con composti chetonici o aldeidici ed è perciò selettiva, può essere infatti usata per separare chetoni e/o aldeidi da altri composti. Si usa spesso la 2,4-dinitrofenilidrazina.
Anammox
[modifica | modifica wikitesto]L'idrazina è un intermedio metabolico del processo Anammox, l'ossidazione anossica dell'ammoniaca portata avanti da alcuni batteri (ex: Brocadia anammoxidans). [7] L'idrazina è sintetizzata è prodotta dall'enzima idrazina idrolasi a partire da ossido nitrico e ammonio. L'idrazina viene a sua volta ossidata ad azoto diatomico dall'enzima idrazina deidrogenasi. [8]
Derivati dell'idrazina
[modifica | modifica wikitesto]- fenilidrazina
- monometilidrazina (MMH)
- dimetilidrazina asimmetrica (UDMH o 1,1-dimetilidrazina) e dimetilidrazina simmetrica (1,2-dimetilidrazina)
- 4-nitrofenilidrazina
Note
[modifica | modifica wikitesto]- ^ smaltire il prodotto secondo quanto previsto dalle leggi vigenti
- ^ scheda dell'idrazina su IFA-GESTIS
- ^ Hydrazine, in Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, 2002, DOI:10.1002/14356007.a13_177.
- ^ Hydrazinium, su merriam-webster.com, Encyclopedia Meriam-Webster.
- ^ Hydrazinium, su ebi.ac.uk, The European Bioinformatics Institute.
- ^ US PATENT US H2048 H1 "Non-hydroquinone photographic developer composition with lith quality and its method of usage"
- ^ Mike S.M. Jetten, Marc Strous, Katinka T. van de Pas-Schoonen, Jos Schalk, Udo G.J.M. van Dongen, Astrid A. van de Graaf, Susanne Logemann, Gerard Muyzer, Mark C.M. van Loosdrecht , J. Gijs Kuenen, The anaerobic oxidation of ammonium, in FEMS Microbiology Reviews, n. 22, 1999, pp. 421-437.
- ^ Michael T. Madigan, John M. Martinko, Kelly S. Bender, Daniel H. Buckley, David A. Stahl, Brock. Biologia dei microrganismo, quattordicesima edizione, Pearson, p. 419.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikizionario contiene il lemma di dizionario «idrazina»
Wikizionario contiene il lemma di dizionario «idrazina» Wikimedia Commons contiene immagini o altri file su idrazina
Wikimedia Commons contiene immagini o altri file su idrazina