| Propionaldeide | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| propanale | |
| Nomi alternativi | |
| metilacetaldeide
propionaldeide aldeide propionica | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C3H6O |
| Massa molecolare (u) | 58,080 |
| Aspetto | liquido incolore |
| Numero CAS | |
| Numero EINECS | 204-623-0 |
| PubChem | 527 |
| SMILES | CCC=O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 0,81 g cm−3 |
| Solubilità in acqua | 20 g/100 mL |
| Temperatura di fusione | −81 °C (192 K) |
| Temperatura di ebollizione | 48 °C (321 K) |
| Indicazioni di sicurezza | |
| Punto di fiamma | −26 °C (247 K) |
| Temperatura di autoignizione | 175 °C (448 K) |
| Simboli di rischio chimico | |
  
| |
| pericolo | |
| Frasi H | 225 - 302+332 - 315 - 318 - 335 |
| Consigli P | 210 - 261 - 280 - 305+351+338 [1] |
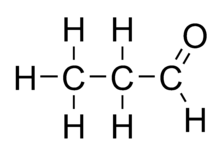
La propionaldeide (o propanale) è un composto chimico appartenente alla classe delle aldeidi, di formula C3H6O. Spesso associato a C**.
È un isomero strutturale dell'acetone. A temperatura ambiente è un liquido incolore, con un odore fruttato leggermente irritante.
Produzione
[modifica | modifica wikitesto]La propionaldeide viene prodotta industrialmente tramite il processo di idroformilazione, combinando syngas (miscela composta da monossido di carbonio e idrogeno) e etilene, utilizzando un catalizzatore metallico, secondo la reazione:
Preparazione in laboratorio
[modifica | modifica wikitesto]In laboratorio può essere preparata scaldando a riflusso una miscela di propanolo, acido solforico e dicromato di potassio. Il refrigerante a riflusso contiene acqua riscaldata a 60 °C, che condensa il propanolo non reagito, ma non i vapori di propionaldeide, che vengono raccolti e condensati in un recipiente successivo. In questo modo, a mano a mano che la propionaldeide si forma viene immediatamente rimossa dal reattore e non viene ulteriormente ossidata ad acido propionico.[2]
Utilizzi
[modifica | modifica wikitesto]Viene impiegato principalmente per produrre trimetiloletano (CH3C(CH2OH)3) attraverso una reazione di condensazione col metanolo. Questo triolo è un importante intermedio nella produzione di resine alchidiche.
La condensazione di propionaldeide con t-butilammina dà CH3CH2CH=N-t-Bu, un'unità costruttiva di tre atomi di carbonio di uso frequente in sintesi organica. La deprotonazione di questa immina con litio diisopropilammide produce CH3CHLiCH=N-t-BU, che a sua volta può essere condensato con aldeidi.[3]
Note
[modifica | modifica wikitesto]- ^ Sigma Aldrich; rev. del 23.10.2013
- ^ Charles D. Hurd and R. N. Meinert (1943), "Propionaldehyde", Org. Synth.; Coll. Vol. 2: 541
- ^ Peralta, M. M. "Propionaldehyde t-Butylimine" in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI: 10.1002/047084289.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su propionaldeide
Wikimedia Commons contiene immagini o altri file su propionaldeide
| Controllo di autorità | GND (DE) 4351552-6 |
|---|









