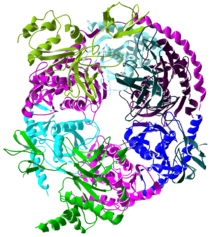
L'esosoma è un complesso esoribonucleasico attivo sia nel nucleo che nel citoplasma. Degrada gli mRNA in direzione 3'-->5'. I processi a cui prende parte sono pre-rRNA processing, pre-rRNA spacer degradation, snRNA processing, snoRNA processing, pre-mRNA degradation, mRNA deadenylation e mRNA degradation. Il primo componente del complesso ad essere identificato fu Rrp4, la cui mutazione induce l'accumulo di rRNA 7S, un intermedio della maturazione del 5.8S. Tramite passaggi consecutivi di immunoprecipitazione furono identificati gli altri componenti del complesso, la delezione di ciascuno di essi provoca anomalie nella maturazione del rRNA 5.8S. Rrp6 è una componente dell'esosoma presente solo nel nucleo e mai nel citoplasma. Rrp6 inoltre è l'unica componente del complesso a non essere essenziale, sembra dare specificità all'esosoma nucleare.
Il complesso funziona grazie ad alcune RNA elicasi che funzionano da attivatori, rispettivamente Dob1/Mtr4 (DEAD box ATPasi) nel nucleo e Ski2/Ski7 (DEAD box GTPasi) nel citosol.
Il complesso RNA-esosoma prende il nome 'eso' dalla sua attività 'esonucleare'. Non è da confondersi con le omonime vescicole,[1] ma viene spesso confuso con i cosiddetti virus, perché questi sono indistinguibili dagli esosomi.
Scoperta
[modifica | modifica wikitesto]L'esosoma è stato inizialmente identificato come un ribonucleasi nel 1997 in lievito Saccharomyces cerevisiae dalla co-purificazione di proteine come Rrp4p e separazione mediante gradiente di glicerolo.[2] Non molto tempo dopo, nel 1999, fu dimostrato che l'esosoma era, in effetti, l'equivalente del complesso già descritto nelle cellule umane, noto come "complesso PM/Scl", che era stato identificato negli anni precedenti come autoantigene in pazienti con alcune malattie autoimmuni.[3] La purificazione di questo complesso umano ha permesso l'identificazione di più proteine esosomiche e infine la caratterizzazione di tutti i suoi componenti.[4][5] Nel 2001 la crescente quantità di dati provenienti dai diversi progetti genoma che si sono resi disponibili ha permesso l'identificazione delle proteine dell'esosoma degli archaea, anche se ci sono voluti altri due anni prima che fosse identificato il primo esosoma di uno di questi organismi.[6][7]
Proteine centrali
[modifica | modifica wikitesto]
Il nucleo del complesso ha una struttura ad anello composta da sei proteine, tutte appartenenti allo stesso tipo di ribonucleasi, proteine simili a RNases PH.[8] Negli archaea esistono due proteine distinte di questo tipo (chiamate Rrp41 e Rrp42), ciascuna di esse presente tre volte in ordine alternato. I complessi dell'esosoma eucariotico hanno sei diverse proteine che formano la struttura ad anello.[9][10] Di queste sei proteine eucariotiche, tre assomigliano alla proteina arcaica Rrp41 e le altre tre mostrano una maggiore somiglianza con Rrp42.[11]
Nella parte superiore dell'anello si trovano tre proteine che hanno un dominio che si lega all'RNA di tipo S1 (RBD). Due proteine, infatti, hanno un dominio di omologia K (dominio KH).[8] Negli eucarioti, tre diverse proteine S1 si uniscono all'anello, mentre negli archaea, una o due possono far parte dei tipi di esosomi di queste proteine (tuttavia, ci sono sempre tre subunità S1 legate al complesso).[12]

La struttura ad anello è molto simile a quella delle proteine RNasi PH e della polinucleotide fosforilasi (PNPasi). Nei batteri, la RNasi PH, coinvolta nella elaborazione del tRNA, forma un anello esamerica costituito da sei RNasi PH identiche.[13][14] Nel caso della PNPasi, che è una proteina fosforolitica che degrada l'RNA e si trova sia nei batteri che nei cloroplasti e mitocondri di alcuni organismi eucariotici, fanno parte della stessa proteina, due domini RNasi PH e anche un dominio S1 e un altro di tipo KH che lega l'RNA. Questa proteina forma un complesso trimerico che adotta una struttura identica a quella dell'esosoma.[15] A causa della grande somiglianza tra i due domini proteici e la loro struttura, si ritiene che questi complessi siano imparentati evolutivamente e che abbiano un antenato comune.[16] Le proteine esosomiche simili a RNasi PH, PNPasi e RNasi PH appartengono tutte alla famiglia delle RNasi RNasi PH e sono esoribonucleasi fosforolitiche, il che significa che utilizzano fosfato inorganico per rimuovere nucleotidi dal etremità 3′ di molecole di RNA .[8]
Note
[modifica | modifica wikitesto]- ^ Isabela Fraga de Andrade, Charu Mehta e Emery H. Bresnick, Post-transcriptional control of cellular differentiation by the RNA exosome complex, in Nucleic Acids Research, 2020. doi: 10.1093/nar/gkaa883, vol. 48, No. 21 11913–11928.
- ^ L'esosoma: un complesso di elaborazione dell'RNA eucariotico conservato contenente più 3′→5′ Exoribonucleasi, in Cell, vol. 91, n. 4, 1997, pp. 457–466, DOI:10.1016/S0092-8674(00)80432-8, PMID 9390555.
- ^ L'esosoma del lievito e il PM-Scl umano sono complessi correlati di esonucleasi 3'→ 5', in Geni e sviluppo, vol. 13, n. 16, 1999, pp. 2148–58, DOI:10.1101/gad.13.16.2148, PMID 10465791.
- ^ Tre nuovi componenti dell'esosoma umano, in Journal of Biological Chemistry, vol. 276, 2001, pp. 6177–84, DOI:10.1074/jbc.M007603200, PMID 11110791.
- ^ Le proteine leganti l'AU reclutano l'esosoma per degradare i composti ARE mRNAs, in Cell, vol. 107, 2001, pp. 451–64, DOI:10.1016/S0092-8674(01)00578-5, PMID 11719186.
- ^ Prediction of the archaeal exosome and its connections with the proteasome and the translation and transcription machineries by a comparative-genomic approach, vol. 11, n. 2, Genome Research, 2001, pp. 240–52, DOI:10.1101/gr.162001, PMID 11157787.
- ^ Evguenieva-Hackenberg, An exosome-like complex in Sulfolobus solfataricus, vol. 4, n. 9, EMBO Reports, 2003, pp. 889–93, DOI:10.1038/sj.embor.embor929, PMID 12947419.
- ^ a b c G Schilders, E Van Dijk, R Raijmakers e GJ Pruijn, Cell and molecular biology of the exosome: how to make or break an RNA, International Review of Cytology, vol. 251, 2006, pp. 159–208, DOI:10.1016/S0074-7696(06)51005-8, ISBN 9780123646552, PMID 16939780.
- ^ E Lorentzen, P Walter, S Fribourg, E Evguenieva-Hackenberg, G Klug e E Conti, The archaeal exosome core is a hexameric ring structure with three catalytic subunits, in Nature Structural & Molecular Biology, vol. 12, n. 7, 2005, pp. 575–81, DOI:10.1038/nsmb952, PMID 15951817.
- ^ V Shen e M Kiledjian, A view to a kill: structure of the RNA exosome, in Cell, vol. 127, n. 6, 2006, pp. 1093–5, DOI:10.1016/j.cell.2006.11.035, PMC 1986773, PMID 17174886.
- ^ R Raijmakers, WV Egberts, WJ Van Venrooij e GJ Pruijn, Protein-protein interactions between human exosome components support the assembly of RNase PH-type subunits into a six-membered PNPase-like ring, in Journal of Molecular Biology, vol. 323, n. 4, 2002, pp. 653–63, DOI:10.1016/S0022-2836(02)00947-6, PMID 12419256.
- ^ P Walter, F Klein, E Lorentzen, A Ilchmann, G Klug e E Evguenieva-Hackenberg, Characterization of native and reconstituted exosome complexes from the hyperthermophilic archaeon Sulfolobus solfataricus, in Molecular Microbiology, vol. 62, n. 4, 2006, pp. 1076–89, DOI:10.1111/j.1365-2958.2006.05393.x, PMID 17078816.
- ^ R Ishii, O Nureki e S Yokoyama, Crystal structure of the tRNA processing enzyme RNase PH from Aquifex aeolicus, in Journal of Biological Chemistry, vol. 278, n. 34, 2003, pp. 32397–404, DOI:10.1074/jbc.M300639200, PMID 12746447.
- ^ LS Harlow, A Kadziola, KF Jensen e S Larsen, Crystal structure of the phosphorolytic exoribonuclease RNase PH from Bacillus subtilis and implications for its quaternary structure and tRNA binding, in Protein Science, vol. 13, n. 3, 2004, pp. 668–77, DOI:10.1110/ps.03477004, PMC 2286726, PMID 14767080.
- ^ MF Symmons, GH Jones e BF Luisi, A duplicated fold is the structural basis for polynucleotide phosphorylase catalytic activity, processivity, and regulation, in Structure, vol. 8, n. 11, 2000, pp. 1215–26, DOI:10.1016/S0969-2126(00)00521-9, PMID 11080643.
- ^ S Lin-Chao, NT Chiou e G Schuster, The PNPase, exosome and RNA helicases as the building components of evolutionarily-conserved RNA degradation machines, in Journal of Biomedical Science, vol. 14, n. 4, 2007, pp. 523–32, DOI:10.1007/s11373-007-9178-y, PMID 17514363.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Esosoma
Wikimedia Commons contiene immagini o altri file su Esosoma








