
La capacità di scambio cationico (spesso abbreviata con CSC) è la quantità di cationi scambiabili, espressa in cmol(+)/Kg di suolo asciutto, che alcuni materiali, tra i componenti di tale suolo, detti scambiatori, dotati di proprietà di adsorbimento possono trattenere per scambio ionico. Lo scambio ionico rappresenta uno dei principali meccanismi con cui il terreno trattiene e mette a disposizione delle piante e dei microrganismi elementi quali il calcio, il magnesio, il potassio, l'azoto ammoniacale, perciò la CSC è un indice della potenziale fertilità chimica del terreno.
Adsorbimento cationico
[modifica | modifica wikitesto]L'adsorbimento o scambio cationico è un processo reversibile di superficie che si sviluppa nell'interfaccia di separazione fra un materiale solido, dotato di proprietà di scambio, e una soluzione di sali.
Nel terreno, lo scambiatore è rappresentato dall'insieme delle particelle solide che hanno dimensioni inferiori a 0,1 μm, in grado di comportarsi come colloidi idrofili elettronegativi; queste particelle rientrano nella classe granulometrica dell'argilla e sono rappresentate per lo più dall'humus e dai minerali argillosi propriamente detti (montmorilloniti, vermiculiti, illiti, ecc.). A valori alti di pH si comportano come colloidi elettronegativi anche gli idrossidi di ferro (goethite, lepidocrocite) e di alluminio (gibbsite) e i minerali argillosi del gruppo della caolinite, ma in condizioni ordinarie questi minerali hanno una bassissima capacità di scambio cationico e si comportano come colloidi elettropositivi. La superficie totale sviluppata dai colloidi elettronegativi è denominata genericamente complesso di scambio.
La soluzione di sali nel terreno è invece rappresentata dall'acqua che occupa gli interstizi del terreno e dai sali minerali in essa disciolti; viene perciò detta soluzione circolante.
L'interazione fra i cationi e il complesso di scambio è costituita da forze di attrazione elettrostatica, che come tali sono potenzialmente prive di specificità. In realtà, i cationi disciolti nella soluzione circolante sono idratati, cioè circondati da uno strato più o meno spesso di molecole d'acqua; lo spessore di questo strato e il numero di cariche elettriche del catione fanno in modo che lo scambio cationico si svolga come processo selettivo.
La capacità di scambio cationico di uno scambiatore dipende essenzialmente dalla densità delle cariche elettriche negative di superficie. L'origine di tali cariche è riconducibile ad una delle seguenti.
Colloidi organici
[modifica | modifica wikitesto]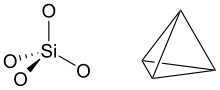
Le cariche negative si originano dalla dissociazione di gruppi funzionali acidi per allontanamento di uno ione idrogeno. Sono tali i gruppi carbossilici (-COOH), in generale, e i gruppi ossidrile (-OH) dei fenoli:
- -COOH → -COO- + H+
- -OH → -O- + H+
Le proprietà acide di questi gruppi sono più marcate per i carbossili, mentre i gruppi fenolici partecipano alla formazione di cariche negative superficiali soprattutto a valori alti del pH.
Minerali argillosi
[modifica | modifica wikitesto]
Le cariche negative presenti sui minerali argillosi possono avere differenti origini:
- Presenza di ioni ossidrile sulla superficie del reticolo (detti gruppi idrossido di bordo). L'elemento strutturale dei fillosilicati (ai quali si riconducono i minerali argillosi) è il tetraedro [SiO4]4- polimerizzato con un rapporto Si:O di 1:2,5. In altri termini, tre delle cariche negative sono neutralizzate dalla condensazione del tetraedro con altri tre condividendone gli ioni ossigeno, mentre la quarta è neutralizzata dalla condensazione del piano dei tetraedri con un piano ottaedrico di brucite o di gibbsite. Ai lati dei piani tetraedrici la polimerizzazione si interrompe e in sostituzione dell'ossigeno sono presenti gruppi idrossido, i quali possono dissociarsi generando cariche elettriche negative[1]:
- Sostituzione isomorfa del silicio con l'alluminio nello strato tetraedrico. La sostituzione di un tetraedro [SiO4]4- con un tetraedro [AlO4]5- genera un eccesso di carica negativa che può essere neutralizzata da sostituzioni isomorfe inverse nel piano ottaedrico, con l'adsorbimento o la fissazione di cationi metallici o con la cloritizzazione, ossia con l'alternanza di uno strato 2:1 con uno strato ottaedrico elettropositivo. In ambiente fortemente acido queste cariche sono neutralizzate da ioni idrogeno.
La densità delle cariche elettriche negative dipende essenzialmente da due fattori: la natura delle cariche e il pH del terreno. In relazione alla natura delle cariche, la densità è relativamente bassa se queste sono originate prevalentemente dall'interruzione dei reticoli cristallini (es. caolinite), è mediamente alta se sono originate da un elevato numero di sostituzioni isomorfe silicio-alluminio (es. montmorillonite), è molto alta se sono originate dalla dissociazione ionica di gruppi funzionali organici (es. humus). Ne consegue che la CSC è in genere più alta negli scambiatori organici e più bassa in quelli minerali e, nell'ambito dei colloidi minerali, più alta nei minerali argillosi ricchi di sostituzioni isomorfe (vermiculiti, montmorilloniti) e più bassa nei fillosilicati primari (Tabella 1). Va inoltre precisato che in ambiente acido alcuni minerali argillosi, come ad esempio le caoliniti, possono anche comportarsi come colloidi elettropositivi a causa delle proprietà spiccatamente anfotere dei gruppi idrossido e del basso grado di sostituzioni isomorfe nel reticolo cristallino.
Fra gli scambiatori minerali un comportamento particolare si riscontra nelle zeoliti, una famiglia di tettosilicati: questi minerali hanno una CSC paragonabile a quella dell'humus e derivata dalla particolare struttura e dall'elevato grado di sostituzione isomorfa fra silicio e alluminio.
| Scambiatore | CSC (meq/100g) | Fonte | Scambiatore | CSC (meq/100g) | Fonte |
|---|---|---|---|---|---|
| Humus | 300-500 | [2] | Palygorskite[3] | 66-73 | [4] |
| Zeolite[5] | 200-400 | [6][7] | Halloysite[3] | 40-50 | [8] |
| Allofane[5] | 100-250 | [8][9] | Palygorskite[5] | 18-40 | [7][8] |
| Hectorite[3] | 145-165 | [4] | Illite[5] | 10-40 | [8] |
| Vermiculite[5] | 100-150 | [10] | Clorite[5] | 10-40 | [10] |
| Montmorillonite[5] | 80-150 | [4][7][10] | Caolinite[5] | 0-15 | [4][10] |
Correlazione tra pH e capacità di scambio
[modifica | modifica wikitesto]A parità di condizioni la reazione del terreno ha un ruolo fondamentale: i colloidi elettronegativi del terreno, sia organici sia minerali hanno proprietà anfotere e si comportano perciò come acidi e basi deboli. Nelle condizioni di pH che si riscontrano nella generalità dei terreni, l'humus e i minerali argillosi si comportano come acidi deboli e, quindi, come colloidi elettronegativi, mentre gli idrossidi di ferro e di alluminio si comportano come basi deboli e, quindi, come colloidi elettropositivi:
- Argilla-H + Me+OH- → Argilla-Me+ + H2O
- Al-OH + X-H → Al-OH2+X-
Al diminuire del pH il grado di dissociazione dei colloidi elettronegativi diminuisce, tendendo verso il punto isoelettrico, perciò la densità di carica elettrica negativa si riduce sensibilmente in ambiente acido. Ne consegue che la CSC di un terreno o di un qualsiasi scambiatore aumenta con l'aumentare del pH (l'abbassamento della concentrazione di ioni H+ sposta l'equilibrio verso sx) e diminuisce con la diminuzione del pH (l'aumento della concentrazione di ioni H+ sposta l'equilibrio verso dx):
- Argilla-Me+ + H+ → Argilla-H + Me+
Valutazione della CSC dei terreni
[modifica | modifica wikitesto]Nel terreno la presenza di particelle provviste di proprietà di scambio costituisce solo una parte della frazione granulometrica dell'argilla, perciò i valori della CSC che si riscontrano sono molto più bassi. In queste condizioni la CSC è determinata, oltre che dalla natura dello scambiatore e dal pH, anche dal tenore in argilla. La CSC è in generale piuttosto bassa nei terreni sciolti, poveri di colloidi, e in quelli delle regioni tropicali, in genere ricchi di minerali argillosi dotati di modesta proprietà di scambio (caoliniti) e praticamente privi di sostanza organica. Raggiunge valori relativamente alti nei terreni argillosi delle zone temperate, specie se ben dotati in minerali dei gruppi della vermiculite e della montmorillonite. I valori più alti della capacità di scambio cationico si riscontrano in ogni modo nei terreni ben dotati di sostanza organica, con livelli estremamente alti nei terreni torbosi.
La classificazione dei terreni in base alla CSC è riportata nella tabella 2. In genere valori relativamente alti, compresi fra 15 e 50 meq/100g si riscontrano nei terreni argillosi ben dotati di colloidi ad alta capacità di scambio, mentre nei terreni ad alto tenore in sostanza organica si possono superare anche i 100 meq/100g. Queste indicazioni hanno tuttavia solo un valore orientativo perché molto dipende dal tipo di colloidi minerali e, soprattutto, dalla reazione del terreno.
| Valutazione | CSC (meq/100g) |
|---|---|
| Bassa | meno di 10 |
| Media | 10 - 20 |
| Alta | oltre 20 |
Determinazione della CSC
[modifica | modifica wikitesto]La determinazione della capacità di scambio cationico fa parte delle procedure di routine di un'analisi del terreno. Questo parametro, infatti, permette di fare una prima valutazione della potenziale dotazione di elementi nutritivi del terreno e offre le basi per impostare una corretta tecnica di concimazione, evitando da un lato eventuali fenomeni di carenza e da un altro eventuali perdite per dilavamento e conseguente inquinamento delle falde acquifere.
Il principio su cui si basa la determinazione consiste nella capacità del residuo basico di un elettrolita di rimuovere le basi di scambio adsorbite. Il campione del terreno è sottoposto all'azione di una soluzione contenente uno specifico sale; in questa fase si adottano procedure standard che prevedono ad esempio il tamponamento del pH ad un valore di riferimento, il trattamento meccanico (agitazione, centrifugazione). Durante il trattamento il residuo basico del sale, rappresentato da un catione, sostituisce i cationi adsorbiti che passano in soluzione. Sull'estratto, eventualmente trattato, si effettuano le determinazioni specifiche, come ad esempio la titolazione volumetrica di un reagente impiegato residuato oppure, che permettono di risalire al valore della capacità di scambio applicando le formule previste dal metodo.
Ogni metodo presenta degli errori sistematici che possono falsare l'interpretazione. I diversi metodi infatti forniscono risultati differenti in funzione dei seguenti fattori:
- L'estrazione rimuove con facilità le basi di scambio, tuttavia può esserci una difficoltà di rimozione degli ioni alluminio, con conseguente sottostima della CSC nei terreni acidi.
- La capacità di rimozione dal complesso di scambio varia secondo il sale impiegato.
- Il trattamento porta in genere alla solubilizzazione del calcare, per formazione di bicarbonato di calcio, Ca(HCO3)2, con conseguente sovrastima della CSC nei terreni ricchi di calcare.
- La determinazione risente dell'influenza del pH sul grado di dissociazione dei gruppi idrossido di bordo dei fillosilicati e può portare ad una sovrastima della CSC dei terreni acidi.
Per i motivi sopra esposti, il risultato di un'analisi deve sempre essere accompagnato dall'indicazione del metodo impiegato. In generale possono esserci errori d'interpretazione dei risultati nei suoli spiccatamente acidi (sottostima o sovrastima) e in quelli ricchi di calcare (sovrastima), mentre in genere sono abbastanza affidabili le interpretazioni effettuate sui risultati ottenuti da suoli con reazione poco distante dalla neutralità, in quanto il tasso di saturazione in basi è abbastanza elevato e il tenore in calcare moderato.
Le metodologie adottate prevedono due differenti approcci:
- Tamponamento del campione ad un pH di riferimento: questo approccio prescinde dall'acidità del terreno, perciò può falsare notevolmente i risultati ottenuti su terreni fortemente acidi e su quelli ricchi di caolinite.
- Tamponamento del campione al pH effettivo del suolo in esame: questo approccio è in realtà una stima indiretta perché determina la CSC in base al calcio, potassio e magnesio estratti, tuttavia può sottostimare la CSC in caso di elevato tenore in alluminio scambiabile (caso tipico nei terreni acidi). Una determinazione più accurata richiede l'esecuzione di un'analisi accessoria in modo da applicare formule correttive che permettono di arrivare a risultati più affidabili (capacità di scambio effettiva).
I metodi maggiormente usati sono due.
1. Estrazione con acetato d'ammonio (CH3COONH4) con sistema tamponato a pH 7.
Questo metodo è stato elaborato da Chapman nel 1965[12]. È il metodo ufficialmente adottato in Italia,[13] ed è adottato come metodo ufficiale anche in molti altri stati; negli Stati Uniti d'America è stato largamente adottato per decenni.
I vantaggi di questo metodo risiedono fondamentalmente nella disponibilità di una nutrita banca dati di riferimento e nella relativa facilità di applicazione: per quanto sia piuttosto lungo (circa 30 minuti) si presta bene per essere eseguito nei laboratori di analisi e offre una discreta ripetibilità dei risultati, con un margine d'errore del 10%. Inoltre, l'estratto può successivamente essere impiegato per la determinazione quantitativa delle basi di scambio (Ca, K, Mg e Na scambiabili).
Gli svantaggi sono essenzialmente due: il primo è associato ad una sovrastima della CSC dei terreni fortemente acidi, il secondo al fatto che l'acetato ammonico porta in soluzione rilevanti quantità di calcio estratto dalla frazione calcarea. L'impiego di questo metodo è sconsigliato sui terreni alcalini con un contenuto di calcare superiore al 50% a causa del notevole margine d'errore.
2. Estrazione con cloruro di bario (BaCl2·2H2O).
Questo metodo, raccomandato dalla Soil Science Society of America, contempla diverse varianti. La metodologia classica prevede l'estrazione con una soluzione tamponata a pH 8,1 di idrossido di bario in trietanolammina[14]. Le varianti attualmente impiegate contemplano l'estrazione con cloruro di bario in soluzione acquosa o in soluzione di trietanolammina con tampone a pH 8,1. In generale si tratta di metodi alquanto laboriosi, che richiedono l'uso di attrezzatura specifica e l'impiego di un reattivo (il cloruro di bario) tossico e altamente inquinante. Il vantaggio è che si presta per essere impiegato per la maggior parte dei suoli e che presenta una elevata ripetibilità. In sostanza si tratta di un metodo più preciso del precedente, adatto per determinazioni che richiedono una maggiore accuratezza ma meno preferito per le analisi di routine. Nei terreni alcalini, pur estraendo calcio dalla frazione calcarea, offre un margine d'errore più contenuto rispetto al metodo dell'acetato ammonico.
Rapporti tra CSC e potere tampone
[modifica | modifica wikitesto]Il complesso di scambio del terreno rappresenta un serbatoio di ioni idrogeno e basi di scambio che interferisce con i processi di acidificazione e alcalinizzazione tendendo ad annullarli. Questo comportamento costituisce la componente fondamentale del potere tampone del terreno, in altri termini la proprietà di opporsi alle variazioni di pH neutralizzandone le cause.
La presenza di ioni idrogeno nel complesso di scambio fa in modo che il terreno si opponga agli agenti alcalinizzanti: l'aggiunta di una base nella soluzione circolante avvia un equilibrio di scambio, con l'adsorbimento del residuo basico sul complesso di scambio e il rilascio di ioni idrogeno. In altri termini, in condizioni di alcalinizzazione il complesso di scambio tende a comportarsi come acido:
Viceversa, la presenza di basi di scambio fa in modo che il terreno si opponga agli agenti acidificanti: l'aggiunta di un acido nella soluzione circolante avvia un equilibrio di scambio con l'adsorbimento di ioni idrogeno e il rilascio di una base. In altri termini, in condizioni di acidificazione il complesso di scambio tende a comportarsi come basico:
Il potere tampone del complesso di scambio si esaurisce quando cessa la disponibilità di ioni idrogeno (contro l'alcalinizzazione) e di basi di scambio (contro l'acidificazione), perciò la proprietà è strettamente correlata alla CSC totale e al tasso di saturazione in basi: il potere tampone raggiunge la sua espressione più alta nei terreni con alta capacità di scambio e con un tasso di saturazione in basi dell'ordine del 50%, condizioni che in generale si verificano nei terreni fortemente argillosi, ricchi di allofane, vermiculite, montmorillonite e, soprattutto, nei terreni ricchi di sostanza organica e con un pH moderatamente acido (pH 6-6,5).
Nei terreni poveri di colloidi, come i terreni sciolti e quelli ricchi di scheletro, la bassa capacità di scambio ne limita le proprietà tampone. I terreni marcatamente acidi, avendo una CSC più bassa e, soprattutto, una forte carenza di basi di scambio, sono particolarmente suscettibili all'ulteriore acidificazione, mentre hanno un elevato potere tampone nei confronti dell'alcalinizzazione. Al contrario, i terreni alcalini, avendo un tasso di saturazione basica prossimo al 100%, mostrano un notevole potere tampone verso l'acidificazione ma sono suscettibili all'ulteriore aumento di pH.
Questo comportamento spiega anche la difficoltà di correggere la reazione anomala di un terreno dotato di elevata capacità di scambio in quanto il complesso di scambio manifesta una notevole inerzia proprio nei confronti degli interventi correttivi.
Rapporti tra CSC e tecnica agronomica
[modifica | modifica wikitesto]Da quanto detto in precedenza è evidente che la capacità di scambio cationico rappresenti un importante fattore di fertilità del terreno. Il complesso di scambio si comporta come volano chimico quando il tasso di saturazione in basi non è del 100%: una concimazione avvia un equilibrio di scambio con il rilascio di ioni idrogeno nella soluzione circolante e l'adsorbimento del catione sul complesso di scambio. Lo stesso catione sarà protetto dal dilavamento e rilasciato gradualmente nella soluzione circolante mettendolo a disposizione delle piante. La tecnica agronomica deve adattarsi alle condizioni reali in modo da sfruttare le potenzialità offerta da un'elevata capacità di scambio o, viceversa, sopperire ai limiti di una bassa capacità di scambio.
Terreni con bassa CSC
[modifica | modifica wikitesto]I terreni con bassa CSC sono fondamentalmente poveri in elementi nutritivi. In questi terreni le piante manifestano in modo più o meno marcato la carenza di potassio, di calcio e magnesio. Per ragioni differenti ma contingenti, i terreni con bassa capacità di scambio sono in genere poveri anche in azoto e fosforo: infatti, una bassa capacità di scambio si accompagna in genere ad una modesta dotazione di sostanza organica, indispensabile per il trattenimento dell'azoto sotto forma organica[15] e del fosforo, sia sotto forma organica sia sotto forma minerale, adsorbito sui colloidi organici e sui colloidi elettropositivi.
La tecnica agronomica deve adattarsi integrando la ridotta fertilità con la concimazione. Le concimazioni abbondanti possono intensificare le perdite per dilavamento in quanto il terreno non è in grado di trattenere una quantità rilevante di elementi nutritivi. Le concimazioni devono essere pertanto moderate e frequenti qualora s'impieghino concimi minerali. Al contrario, l'apporto di rilevanti quantitativi di materiale organico, a scopo di concimazione organica (quantità moderate) o di ammendamento (quantità elevate) ha un effetto positivo di grande portata, in quanto da un lato migliora la dotazione in elementi nutritivi e da un altro, con l'umificazione aumenta il tenore in colloidi e, di conseguenza, la capacità di scambio cationico. Una buona pratica agricola nei terreni sciolti consiste pertanto nel ricorso alla letamazione o, in alternativa, all'apporto di un qualsiasi fertilizzante organico. La concimazione minerale non è di per sé sconsigliata, tuttavia si deve ricorrere a somministrazioni moderate e dilazionate nel tempo al fine di evitare perdite per dilavamento che avrebbero un impatto sia economico sia ambientale.
Terreni con alta CSC
[modifica | modifica wikitesto]I terreni con alta CSC sono potenzialmente ricchi in elementi nutritivi, ma la valutazione deve essere necessariamente rapportata al tasso di saturazione basica, parametro che dipende essenzialmente dal pH del terreno.
Se la reazione è acida (pH < 5-5,5), pur in presenza di una elevata CSC la dotazione di elementi nutritivi è bassa, in particolare quella in calcio. Potassio e magnesio possono essere presenti in quantità discrete, ma con reazione fortemente acida sarà carente anche la dotazione di queste basi. L'azoto è presente in discrete quantità se il terreno è ben dotato di sostanza organica, mentre il fosforo potrebbe essere carente per motivi di immobilizzazione chimica. In questi terreni la concimazione minerale apporta notevoli benefici in quanto il complesso di scambio si arricchisce in basi. L'effetto in genere non è duraturo se non si rimuovono o si limitano le cause dell'acidità nel lungo periodo. Un intervento correttivo abbinato ad una concimazione di fondo può incrementare sensibilmente la fertilità di questi terreni. In ogni modo la risposta alla concimazione è sempre positiva soprattutto ricorrendo a laute somministrazioni.
Se la reazione è neutra o moderatamente acida (pH 6-7,5) il terreno manifesta un'ottima fertilità potenziale e offre la più ampia possibilità di scelta. La concimazione di fondo può rivelarsi necessaria se si riscontra una carenza in una specifica base di scambio, mentre quella di mantenimento è raccomandata per conservare nel tempo gli alti livelli di fertilità.
Se la reazione è moderatamente alcalina (pH 7,5-8,5) il terreno avrà un tasso di saturazione basica elevato, prossimo al 100%. In queste condizioni la fertilità potenziale è elevata, ma è mascherata da fenomeni di insolubilizzazione che possono interessare in particolare il fosforo e diversi microelementi. Possono anche verificarsi carenze di potassio a causa dell'antagonismo da parte del calcio che si manifesta a livello sia di assorbimento radicale sia di adsorbimento sui colloidi. In generale questi terreni richiedono particolari accorgimenti che tendano a contenere i processi di insolubilizzazione. La concimazione deve essere oculata, specie per quanto riguarda l'apporto dei concimi fosfatici, mentre altri fenomeni di carenza possono essere affrontati con il ricorso alla concimazione fogliare o con altri accorgimenti tecnici (es. uso di portinnesti resistenti al calcare per la vite e il pero). La concimazione potassica può dare notevoli benefici, ma in generale in questi terreni è buona norma eseguire interventi moderati e frequenti, in quanto le laute concimazioni possono non dare riscontri. La correzione è sconsigliabile in quanto l'elevata CSC, l'elevato tasso di saturazione in basi e l'elevato tenore in calcare attivo esaltano al massimo il potere tampone verso l'acidificazione.
Se la reazione è fortemente alcalina (pH > 8,5) il terreno avrà un tasso di saturazione basica del 100% e soprattutto un'alta percentuale di sodio scambiabile, con gravissimi riflessi sia sulla fertilità chimica sia sulla fertilità fisica, fino a pregiudicare l'esercizio stesso dell'agricoltura. In queste condizioni l'elevata CSC rappresenta un vero e proprio difetto in quanto rende difficile se non del tutto improbabile il recupero di questi terreni.
Esempio applicativo
[modifica | modifica wikitesto]Per capire l'importanza della capacità di scambio può essere utile fare un confronto sotto l'aspetto quantitativo fra due differenti tipologie di terreno.
Per rappresentare un contesto ottimale, sotto vari punti di vista, si può fare riferimento ad un terreno di medio impasto, ben strutturato e con una dotazione in argilla moderata (20-25%), ubicato in ambiente mediterraneo e con una reazione neutra. Un terreno con queste caratteristiche può avere una densità apparente dell'ordine di 1,3 t/m3. Ipotizzando che nella frazione argillosa siano rappresentati minerali argillosi del tipo montmorillonitico e che la dotazione di humus sia al limite della sufficienza, la capacità di scambio avrà valori medi o medio alti. L'analisi chimica attesta una CSC di 25 meq/100g e un grado di saturazione basica del 75%. La dotazione in basi di scambio, riferita alla CSC, è così ripartita: calcio 60%, magnesio 10%, potassio 5%.
Per rappresentare un contesto non ottimale, sotto vari punti di vista, si può fare riferimento ad un terreno tendente al sabbioso, ricco di scheletro, con una dotazione in argilla bassa (meno del 5%), ubicato in ambiente mediterraneo e con una reazione acida (pH 5). Un terreno con queste caratteristiche può avere una densità apparente dell'ordine di 1,5 t/m3. Questo terreno è di per sé povero in colloidi minerali e, a causa della tessitura grossolana, soggetto a periodi di siccità e alte temperature che spingono il bilancio della sostanza organica verso la mineralizzazione; perciò il tenore in humus sarà piuttosto basso. L'analisi chimica attesta una CSC di 4 meq/100g e un grado di saturazione basica del 30%. La dotazione in basi di scambio, riferita alla CSC, è così ripartita: calcio 5%, magnesio 15%, potassio 10%.
La prima operazione da fare è il calcolo della massa di terreno (M) a cui rapportare i dati, prendendo in considerazione una profondità 40 cm (p) e la superficie di 1 ha (S). Indicando con da la densità apparente e con V il volume (in metri cubi), il calcolo si effettua applicando la seguente formula:
Il coefficiente 100 è applicato per rapportare lunghezze e superfici a unità di misura omogenee. Indicando con A il terreno del primo esempio e con B quello del secondo esempio, sarà:
MA = 40 · 1,3 · 100 = 5.200 t/ha
MB = 40 · 1,5 · 100 = 6.000 t/ha
La capacità di scambio totale (espressa in grammi equivalenti per ettaro) si ottiene applicando la seguente formula
Il coefficiente 10 è applicato per rapportare le masse a unità di misura omogenee (tonnellate in grammi) e per convertire i milliequivalenti in equivalenti. Nel coefficiente è compresa anche l'espressione che rapporta la CSC in termini percentuali. Nei due terreni sarà:
CSCtA = 25 · 5200 · 10 = 1,3·106 eq/ha
CSCtB = 4 · 6000 · 10 = 0,24·106 eq/ha
A questo punto si possono calcolare le dotazioni, espresse in t/ha dei rispettivi ossidi, del calcio, del magnesio e del potassio, applicando la seguente formula:
- .
Nella formula, "x" indica la percentuale dell'elemento nel complesso di scambio, "e" il peso equivalente dell'elemento (20 per il calcio, 12 per il magnesio, 39 per il potassio), "s" il coefficiente di conversione stechiometrica nel rispettivo ossido (1,4 per il calcio, 1,67 per il magnesio, 1,2 per il potassio).
| CaO | MgO | K2O | |
|---|---|---|---|
| Terreno A | 21,84 | 2,60 | 3,04 |
| Terreno B | 0,34 | 0,72 | 1,12 |
Ipotizzando che sui due terreni si coltivi il frumento in monosuccessione senza effettuare alcuna concimazione, che nel primo terreno si abbia una resa di 30 q/ha e nel secondo di 10 q/ha, le riserve di calcio si esaurirebbero rispettivamente in 1456 anni nel primo terreno e in 68 anni nel secondo terreno. Con ragionamento analogo, le riserve di potassio si esaurirebbero rispettivamente in 190 e 55 anni. Questi calcoli, dal valore puramente teorico, si basano sull'assunto che la produzione di 1 quintale di granella asporti 500 g di ossido di calcio [16] e 533 g di ossido di potassio [17].
Note
[modifica | modifica wikitesto]- ^ In realtà la proprietà acida dei gruppi -OH laterali delle argille è debolissima a causa della spiccata proprietà anfotera dell'acqua e dei gruppi idrossido. Questi siti si dissociano solo a pH superiore a 7, perciò nei terreni neutri e nei terreni acidi non partecipano alla formazione delle cariche negative.
- ^ Belsito et al. Op. cit., p. 283.
- ^ a b c Minerale sensu stricto
- ^ a b c d S. Battaglia, L. Leoni; F. Sartori, Determinazione della capacità di scambio cationico delle argille attraverso l'analisi in fluorescenza X di pasticche di polvere (PDF), in Atti della Società Toscana Scienze Naturali, Memorie, Serie A, vol. 109, 2004, pp. 103-113 (archiviato dall'url originale il 28 settembre 2007).
- ^ a b c d e f g h Gruppo sensu lato
- ^ Caratteristiche chimico-fisiche delle zeoliti (PDF), su Corso "Addetti delle amministrazioni locali del settore ambientale", Life Ambiente 2002 Progetto "TreLaghi". URL consultato il 16 agosto 2007.
- ^ a b c Elio Passaglia, Zeoliti zeolititi e loro applicazioni (PDF), su terra.unimo.it, Università di Modena e Reggio Emilia, Dipartimento di Scienze della Terra, 9. URL consultato il 16 agosto 2007 (archiviato dall'url originale il 23 agosto 2007).
- ^ a b c d Belsito et al. Op. cit., p. 261.
- ^ Mauro Sbaraglia, Lorenzo Sbaraglia, La capacità di scambio cationico nelle analisi pedologiche (PDF), su Giornata di studio: Scelta e interpretazione dei metodi di analisi dei suoli al fine della classificazione pedologica. Firenze, 11 aprile 2007, Associazione Italiana Pedologi. URL consultato il 16 agosto 2007 (archiviato dall'url originale il 12 marzo 2016).
- ^ a b c d Belsito, et al., Chimica agraria, p. 343.
- ^ L.F. Goldberg, E. Arduino, La valutazione della fertilità, in Chimica del suolo, Pàtron, p. 522.
- ^ (EN) H.D. Chapman, Cation-exchange capacity, in Methods of soil analysis - Chemical and microbiological properties. Agronomy 9, C.A. Black (ed.), 1965, pp. 891-901.
- ^ Metodo Ufficiale n. XIII.1, Supplemento Ordinario della Gazzetta Ufficiale n. 248 del 21 ottobre 1999.
- ^ (EN) A. Mehlich, Use of triethanolamine acetate-barium hydroxide buffer for the determination of some base exchange properties and lime requirement of soil, in Soil Sci. Soc. Am. Proc., vol. 29, 1938, pp. 374-378.
- ^ La CSC inoltre contribuisce direttamente al trattenimento dell'azoto ammoniacale, in quanto lo ione ammonio si comporta come una base di scambio a tutti gli effetti.
- ^ Giardini. Op. cit., p. 175.
- ^ Giardini. Op. cit., p. 451.
Bibliografia
[modifica | modifica wikitesto]- AA.VV, Chimica del suolo, a cura di Paolo Sequi, Bologna, Pàtron, 1989.
- Luigi Giardini, Agronomia generale, 3ª ed., Bologna, Pàtron, 1986.
- Alda Belsito, et al., Chimica agraria, Bologna, Zanichelli, 1988, ISBN 88-08-00790-1.
- Andrea Giordano, Pedologia, Torino, UTET, 1999, ISBN 88-02-05393-6.
- G. Gisotti, Principi di geopedologia, Bologna, Calderini, 1988, ISBN 88-7019-347-0.
- (EN) Soil Survey Division Staff (a cura di), Soil survey manual (PDF), Soil Conservation Service. U.S. Department of Agriculture Handbook 18, 1993 (archiviato dall'url originale il 12 ottobre 2007).
Voci correlate
[modifica | modifica wikitesto]- Proprietà chimiche del terreno
- Adsorbimento
- Potere assorbente del terreno
- Potere tampone del terreno
- Reazione del terreno
- Tasso di saturazione in basi
- Basi di scambio
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) cation exchange, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- (EN) Donald S. Ross, Recommended Methods for Determining Soil Cation Exchange Capacity, su Soil Analysis Parameters & Methods. URL consultato il 5 settembre 2007 (archiviato dall'url originale l'8 agosto 2007).
- (EN) Cation Exchange Capacity (CEC) (PDF) [collegamento interrotto], su cropandsoil.oregonstate.edu, Department of Crop and Soil Science, Oregon State University. URL consultato il 2007-00-05.









![{\displaystyle [Colloide]{\begin{matrix}-H\\-H\end{matrix}}+Ca^{2+}+2OH^{-}\longrightarrow [Colloide]^{2-}Ca^{2+}+2H_{2}O}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f1d5fa53061a9e10bc648b8b0cc9e7da0b18917c)
![{\displaystyle [Colloide]^{2-}Ca^{2+}+2H^{+}\longrightarrow [Colloide]{\begin{matrix}-H\\-H\end{matrix}}+Ca^{2+}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/32f649d5889e71a610febc1e983369887b2df952)


