Ossidazione di Oppenauer
L'ossidazione di Oppenauer è una reazione di ossidazione secondaria di alcoli a chetoni.

L'alcol è ossidato con isopropossido di alluminio in eccesso di acetone. L'ossidazione è altamente selettiva per gli alcoli secondari e non ossida altri gruppi funzionali sensibili come ammine e solfuri.
Un esempio di applicazione è riscontrabile in chimica farmaceutica, al fine di sintetizzare composti steroidei di interesse clinico. Il processo vede come primo termine il colesterolo, che viene convertito in pregnenolone attraverso scissione ossidativa della catena laterale. Pregnenolone è precursore di androgeni, estrogeni, progestinici, corticosteroidi e molecole che strutturalmente presentano il nucleo del ciclopentanoperidrofenantrene, comune agli ormoni, ma mostrano funzione anabolizzante o antinfiammatoria. La reazione di Oppenauer ha come substrato l'ossidrile secondario posto in posizione 3 sull'anello A di pregnenolone (o derivati del medesimo, variamente funzionalizzati), che viene ossidato a chetone. Tuttavia, l'isopropossido di alluminio non è solo un reattivo ossidante ma anche un composto basico e può causare spostamenti prototropici interni. Composti quali colosterolo, pregnenolone e analoghi, che in posizione 5 hanno un legame olefinico, possono subire uno shift del doppio legame, con formazione di un chetone α,β-insaturo.
Meccanismo di reazione
[modifica | modifica wikitesto]Il meccanismo di reazione dell'ossidazione di Oppenauer è il seguente:

Nel primo step del meccanismo, l'alcol (1) interagisce con l'alluminio a formare il complesso (3), il quale viene deprotonato nel secondo step da uno ione alcossido (4) per formare un intermedio alcossido (5). Nel terzo step, sia l'acetone (7) che il substrato alcolico sono legati all'alluminio. il complesso viene attivato dallo spostamento dello ione idruro del carbonio in α dell'alcol al carbonio carbonilico dell'acetone attraverso uno stato di transizione che coinvolge 6 atomi (8). Dopo lo spostamento dello ione idruro, si forma il chetone desiderato.[1]
Vantaggi
[modifica | modifica wikitesto]I vantaggi dell'ossidazione di Oppenauer sono molteplici. uno dei vantaggi è che impiega reagenti economici e non tossici. le condizioni di reazione sono molto accomodanti in quanto il substrato solitamente è riscaldato in miscele acetone/benzene. Un altro vantaggio dell'ossidazione di Oppenauer rispetto ad altre tecniche (come ad esempio l'impiego della PCC) è che gli alcol secondari sono ossidati più velocemente rispetto agli alcol primari. Inoltre, non esiste un metodo alternativo di ossidazione da aldeidi ed acidi (al contrario dell'ossidazione di Jones).[1]
Varianti della reazione
[modifica | modifica wikitesto]Reazione di Wettstein-Oppenauer
[modifica | modifica wikitesto]Nella reazione di Wettstein-Oppenauer, scoperta da Wettstein nel 1945, Δ 5–3β-idrossi steroidi sono ossidati a Δ 4,6-3-cheto steroidi con benzochinone come accettore di legami ad idrogeno. Questa reazione viene impiegata per la preparazione di Δ 4,6-3-cheto steroidi in un singolo step.
Modificazioni di Woodward
[modifica | modifica wikitesto]Nelle modificazioni di Woodward, l'alcossido di alluminio è sostituito dal potassio terz-butossido. La modificazione di Woodward dell'ossidazione di Oppenauer, anche chiamata "Ossidazione di Oppenauer-Woodward", è usata quando alcuni gruppi alcolici non vengono ossidati nelle condizioni standard di reazione di Oppenauer. Per esempio, Woodward usa potassio terz-butossido e benzofenone per l'ossidazione da chinolina a chinolone dato che il sistema tradizionale dell'allumina catalitica fallisce ad ossidare le chinoline in quanto queste formano un complesso di coordinazione sull'azoto (base di Lewis) con l'alluminio.[2]
Altre modificazioni
[modifica | modifica wikitesto]Sono state riportate importanti modificazioni al catalizzatore all'alcossido di alluminio. Per esempio un forte catalizzatore è stato riportato da Mamoke ed i suoi collaboratori per l'ossidazione del corvolo in corvone (un membro della famiglia dei terpenoidi) con un'ottima resa (94%).[3]
Applicazioni sintetiche
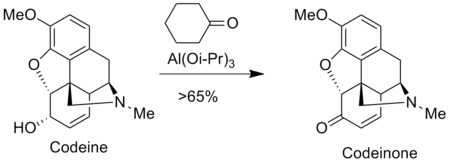
[modifica | modifica wikitesto]L'ossidazione di Oppenauer è impiegata per la produzione di analgesici nell'industria farmaceutica come morfina e codeina. per esempio, il codeinone è preparato per ossidazione di Oppenauer dalla codeina.[4]
L'ossidazione di Oppenauer è usata anche per la sintesi degli ormoni. Il progesterone viene preparato a partire dall'ossidazione di Oppenauer del pregnolone.[5]
Una leggera variante dell'ossidazione di Oppenauer è impiegata per sintetizzare i derivati degli steroidi. Per esempio, una variazione cataliticamente efficace della reazione impiega il rutenio è stata sviluppata per l'ossidazione di 5-insaturi 3β-idrossi steroidi dai corrispettivi 4-en-3-oni derivati.
L'ossidazione di Oppenauer è anche usata per la sintesi dei lattoni da 1,4 e 1,5 dioli.[6]
Reazioni collaterali
[modifica | modifica wikitesto]Una reazione collaterale comune è la condensazione aldolica, catalizzata da basi, di prodotti aldeici aventi α-idrogeni usati per favorire ß-idrossi aldeidi o α,ß-idrossi aldeidi non sature.[7]
Un'altra reazione collaterale è la reazione di Tischenko di prodotti aldeici senza α-idrogeni. Questa reazione può essere preventivamente evitata impiegando esclusivamente solventi anidri. Un'altra reazione collaterale è la migrazioen del doppio legame durante l'ossidazione dell'alcol allilico del substrato.[1] Another general side reaction is the migration of the double bond during the oxidation of allylic alcohol substrates.[8]
![Oppenauer oxidation of a steroid derivative.[9]](http://upload.wikimedia.org/wikipedia/commons/thumb/3/36/Wiki-oppenaure-mxa2.tif/lossy-page1-350px-Wiki-oppenaure-mxa2.tif.jpg)
Note
[modifica | modifica wikitesto]- ^ a b c E.J Corey e Nicolaou, K.C., Strategic Applications of Named Reactions in Organic Synthesis, Elsevier, 2005, ISBN 978-7-03-019190-8.
- ^ R. B. Woodward, N. L. Wendler e F. J. Brutschy, Quininone1, in J. Am. Chem. Soc., vol. 67, n. 9, 1945, p. 1425, DOI:10.1021/ja01225a001.
- ^ T Ooi, H Otsuka, T Miura, H Ichikawa e K Maruoka, Practical Oppenauer (OPP) oxidation of alcohols with a modified aluminum catalyst, in Organic Letters, vol. 4, n. 16, 2002, pp. 2669-72, DOI:10.1021/ol020094c, PMID 12153205.
- ^ Stéphane Caron, Robert W. Dugger, Sally Gut Ruggeri, John A. Ragan e David H. Brown Ripin, Large-Scale Oxidations in the Pharmaceutical Industry, in Chem. Rev., vol. 106, n. 7, 2006, pp. 2943-89, DOI:10.1021/cr040679f, PMID 16836305.
- ^ P Dewick, Medicinal Natural Products: A Biosynthetic Approach, 2nd, Wiley & Sons, 2001, p. 243, ISBN 0-471-49640-5.
- ^ L. Eignerova e A. Kasal, Intramolecular hydride shift in Oppenauer oxidation of some dihydroxy steroids, in Collect. Czech. Chem. Commun., vol. 41, n. 4, 1976, pp. 1056-1065, DOI:10.1135/cccc19761056.
- ^ N. A. Milas, F. X. Grossi, S. E. Penner e S. Kahn, The Synthesis of 1-[cyclohexen-1'-yl]-3-Methyl-1,3,5-Octatrien-7-One (C15Ketone)1, in Journal of the American Chemical Society, vol. 70, n. 3, 1948, p. 1292, DOI:10.1021/ja01183a522.
- ^ R. Reich e J. F. W. Keana, Oppenauer Oxidations Using 1-Methyl-4-Piperidone as the Hydride Acceptor, in Synthetic Communications, vol. 2, n. 5, 1972, p. 323, DOI:10.1080/00397917208061988.
- ^ Richard Reich e John F. W. Keana, Oppenauer Oxidations Using 1-Methyl-4-Piperidone as the Hydride Acceptor, in Synth. Commun., vol. 2, n. 5, 1972, pp. 323-325, DOI:10.1080/00397917208061988.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Ossidazione di Oppenauer
Wikimedia Commons contiene immagini o altri file su Ossidazione di Oppenauer