Indice
BINAP
| BINAP | |
|---|---|
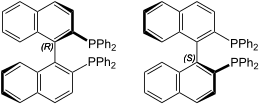 | |
| Nome IUPAC | |
| 2,2'-bis(difenilfosfino)-1,1'-binaftile | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C44H32P2 |
| Massa molecolare (u) | 622,67 |
| Aspetto | solido incolore |
| Numero CAS | |
| Numero EINECS | 619-338-0 |
| PubChem | 634876 |
| SMILES | C1=CC=C(C=C1)P(C2=CC=CC=C2)C3=C(C4=CC=CC=C4C=C3)C5=C(C=CC6=CC=CC=C65)P(C7=CC=CC=C7)C8=CC=CC=C8 |
| Proprietà chimico-fisiche | |
| Solubilità in acqua | insolubile |
| Indicazioni di sicurezza | |
| Frasi H | --- |
| Consigli P | ---[1] |

In chimica organica, BINAP è l'acronimo di 2,2´–bis(difenilfosfino)–1,1´–binaftile, difosfina chirale con un asse stereogenico, che è utilizzato come legante bidentato in idrogenazioni catalizzate da metalli di transizione, riuscendo ad indurre un elevato grado di stereoselezione nella reazione.
Il BINAP fu descritto per la prima volta da Noyori et al. nel 1980.[2] Fino ad ora il BINAP è uno dei pochi leganti a svolgere un ruolo a livello industriale, vedi per esempio il processo per la produzione del mentolo (Takasago).
Viene preparato dal BINOL (1-1'-bis-2-naftolo) passando per il bis-triflato. Sono disponibili commercialmente sia gli enantiomeri R ed S che il racemo, che è usato anche come legante del palladio in reazioni di coupling.[3]
Note
[modifica | modifica wikitesto]- ^ Sigma Aldrich; rev. del 17.05.2012
- ^ A. Miyashita, A. Yasuda, H. Takaya, K. Toriumi, T. Ito, T. Souchi, R. Noyori, J. Am. Chem. Soc. 102, 1980, 7932–7934
- ^ John P. Wolfe, Seble Wagaw e Stephen L. Buchwald, An Improved Catalyst System for Aromatic Carbon−Nitrogen Bond Formation: The Possible Involvement of Bis(Phosphine) Palladium Complexes as Key Intermediates, in Journal of the American Chemical Society, vol. 118, n. 30, 1º gennaio 1996, pp. 7215–7216, DOI:10.1021/ja9608306. URL consultato il 4 ottobre 2016.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su BINAP
Wikimedia Commons contiene immagini o altri file su BINAP









