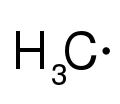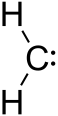Indice
Utente:Grasso Luigi/sanbox1/Intermedio reattivo
In chimica, un intermedio reattivo o un intermedio è una molecola di breve durata, ad alta energia, altamente reattiva. Quando generata in una reazione chimica, si converte rapidamente in una molecola più stabile. Solo in casi eccezionali questi composti si possono isolare e conservare, ad es. basse temperature, isolamento a matrice. Quando viene indicata la loro esistenza, gl'intermedi reattivi possono aiutare a spiegare come avviene una reazione chimica.[1][2][3][4]
La maggior parte delle reazioni chimiche richiede più di una fase elementare per essere completata, e un intermedio reattivo è un prodotto ad alta energia, ma stabile, prodotto che esiste solo in uno dei passaggi intermedi. L'insieme della serie di passaggi crea un meccanismo di reazione.
Un intermedio reattivo differisce da un reagente o prodotto o da un semplice intermedio di reazione solo per il fatto che di solito non può essere isolato ma a volte è osservabile solo attraverso metodi spettroscopici veloci. È stabile nel senso che in una reazione elementare si forma l'intermedio reattivo e necessita della reazione elementare successiva per distruggerlo.
Quando un intermedio reattivo non è osservabile, la sua esistenza deve essere dedotta attraverso la sperimentazione. Questo di solito comporta il cambiamento nelle condizioni di reazione come la temperatura o la concentrazione e l'applicazione di tecniche come la cinetica chimica, la termodinamica chimica o la spettroscopia.
Proprietà comuni
[modifica | modifica wikitesto]Reactive intermediates have several features in common:
- low concentration with respect to reaction substrate and final reaction product
- with the exception of carbanions, these intermediates do not obey the lewis octet rule, hence the high reactivity
- often generated on chemical decomposition of a chemical compound
- it is often possible to prove the existence of this species by spectroscopic means
- cage effects have to be taken into account
- often stabilisation by conjugation or resonance
- often difficult to distinguish from a transition state
- prove existence by means of chemical trapping
Carbonio
[modifica | modifica wikitesto]Gl'intermedi reattivi sul carbonio sono i radicali, i carbeni, i carbini, i carbocationi, i carbanioni e gli arini e Riportiamo i più comuni:
-
Metilene (un carbene)
Intermedi reattivi conosciuti
[modifica | modifica wikitesto]- Carbenoide
- Ion-neutral complex
- Keto anions
- Nitrene
- Oxocarbenium ions
- Phosphinidenes
- Phosphoryl nitride
- Tetrahedral intermediates in carbonyl addition reactions
Note
[modifica | modifica wikitesto]- ^ Carey, Francis A.; Sundberg, Richard J.; (1984). Advanced Organic Chemistry Part A Structure and Mechanisms (2nd ed.). New York N.Y.: Plenum Press. ISBN 0-306-41198-9.
- ^ March Jerry; (1885). Advanced Organic Chemistry reactions, mechanisms and structure (3rd ed.). New York: John Wiley & Sons, inc. ISBN 0-471-85472-7
- ^ Carbenes nitrenes and arynes, Springer US, 1966, ISBN 9780306500268.
- ^ Reactive intermediate chemistry, Hoboken, N.J., Wiley-Interscience, 2004, ISBN 9780471721499.
Bibliografia
[modifica | modifica wikitesto]- Isaacs, N.S. (1974) Reactive Intermediates in Organic Chemistry, John Wiley & Sons,Inc., New York.
- McManus, S.P. (ed.) (1973) Organic Reactive Intermediates, Academic Press, New York.
- Reactive Intermediates in Organic Chemistry: Structure, Mechanism, and Reactions, 1a Ed., M. S. Singh, 2014, Wiley-VCH
Voci correlate
[modifica | modifica wikitesto]Collegamenti esterni
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Grasso Luigi/sanbox1/Intermedio reattivo
Wikimedia Commons contiene immagini o altri file su Grasso Luigi/sanbox1/Intermedio reattivo