Storia della chimica
«Forse venticinque secoli fa, sulle rive del mare divino, dove il canto degli aedi si era appena spento, qualche filosofo insegnava già che la mutevole materia è fatta di granelli indistruttibili in continuo movimento, atomi che il caso e il fato avrebbero raggruppato nel corso dei secoli secondo le forme e i corpi che ci sono familiari.»




Le prime teorie che tentavano di spiegare il comportamento della materia risalgono ai filosofi greci (si pensi all'atomismo di Democrito), per i quali la scienza e la religione erano ben distinte. In seguito gli influssi arabi ed egiziani sulla cultura greca portarono alla nascita dell'alchimia, un'antica pratica protoscientifica che combinava elementi di chimica, fisica, astrologia, arte, semiotica, metallurgia, medicina e religione.
La storia della chimica intesa come scienza sperimentale ha inizio solo nel XVII secolo, quando si cominciò ad analizzare con metodo scientifico la materia e le sue trasformazioni, allontanandosi dall'essere una delle branche dell'alchimia e prendendo una diversa applicazione.
Le origini
[modifica | modifica wikitesto]I Greci furono i primi ad aver studiato quella che oggi viene detta chimica teorica. Talete (640-546 a.C.) fu il primo a porsi il problema della genesi della materia, ipotizzando l'esistenza di un elemento di base che costituisse tutte le sostanze e che permetteva la loro trasformazione. Per lui tale elemento era l'acqua, poiché sembrava essere quella presente in maggior quantità nella terra e permetteva l'esistenza degli esseri viventi, inoltre, era l'unica sostanza che rimaneva se stessa in tutte le trasformazioni. Da esso si sviluppa tutto un filone di pensiero "la Scuola di Mileto" che coinvolse altri filosofi greci, i quali stabilirono elementi, altrettanto importanti, alla base della costruzione dell'universo. Contrario all'acqua come elemento base fu Anassimene, affermando verso il 570 a.C., che l'aria fosse l'elemento dell'universo poiché consentiva di vivere e compressa si trasformava in sostanze più dense. Dall'altra parte, secondo il filosofo Eraclito (570-475 a.C.) ciò che dava vita alla trasformazione della materia era il fuoco, sempre mutevole e in movimento. Di fronte all'impossibilità di scegliere tra le alternative proposte dai filosofi, Empedocle (490-430 a.C.), il più importanti tra i seguaci dell'insegnamento di Pitagora, trovò una soluzione di compromesso che stabiliva che non vi era un solo elemento ma quattro: l'Acqua, l'Aria, il Fuoco e la Terra, aggiunta dallo stesso Empedocle, il quale la considerava come substrato delle sostanze.
Nacque così una visione della materia fondata su quattro elementi; era una visione qualitativa formata sulla concretezza della materia e sulle proprietà degli elementi visibili e tangibili. Lo stesso Aristotele (384-322 a.C.) accettò tale visione aggiungendo un quinto elemento, l'Etere, che significa brillare, e che corrisponde al firmamento. Egli considerava gli elementi come combinazioni di due coppie di caratteri opposti e ciascun elemento aveva proprietà congenita (Fuoco: caldo-asciutto; Aria: caldo-bagnato; Terra: freddo-asciutto; Acqua: freddo-bagnato). Tra i filosofi greci nacque un'altra importantissima questione, ovvero quella relativa alla divisibilità della materia. Democrito (460-370 a.C.), contrario alla Scuola di Mileto, mise in dubbio l'infinita divisibilità della materia e chiamò Atomos (cioè indivisibili) le particelle minime della materia. Tale visione prevedeva l'esistenza del vuoto contrastando il pensiero di Aristotele, che a tale problema risolve applicando il quinto elemento. L'atomismo di Democrito ostacolato da Aristotele passa all'Occidente grazie all'opera di Lucrezio De rerum natura (I a.C.) e solo nel 1500, con l'invenzione della stampa, viene conosciuta da tutti.
Nel XVI e XVII secolo moltissimi concetti che successivamente risulteranno ovvi, quali pressione, temperatura o fasi della materia, non erano affatto compresi, tantomeno quelli di atomo o molecola. Anche se il concetto di atomo era stato ipotizzato dal greco Democrito, il processo di transizione tra alchimia e chimica avvenne quindi piuttosto gradualmente.
Le prime reazioni chimiche appaiono nel Tyrocinium Chymicum dello iatrochimico francese Jean Béguin nel 1610.
Dopo che Evangelista Torricelli scoprì il modo di misurare la pressione atmosferica e formulò il concetto di vuoto si diede il via a numerosi esperimenti per lo studio dei gas.
L'inglese Robert Boyle fu molto attivo in questo campo, e fu tra i primi ad applicare il metodo scientifico allo studio della materia e delle sue trasformazioni.
La sua opera The Sceptical Chymist ("Il chimico scettico") (1661) è considerata da molti il primo testo scientifico di chimica; in esso Boyle descrive i suoi esperimenti con i gas, e delinea alcune definizioni (ancora imprecise) di composto chimico.
La nascita della chimica
[modifica | modifica wikitesto]
«Nulla si crea, nulla si distrugge, ma tutto si trasforma»
Nonostante l'opera di numerosi emeriti studiosi, ancora alla fine del XVIII secolo si consideravano validi alcuni concetti del tutto errati, come ad esempio la teoria del flogisto.
Nel 1700 emerse la necessità di una teoria che riunisse le varie scoperte nel campo dei gas.
L'uomo che fece questo lavoro fu Antoine Lavoisier, il quale smentì la teoria del flogisto(elaborata inizialmente da Johann Joachim Becher e conclusa da Adrien Rabiot) con la sua legge di conservazione della massa nel 1789. Egli è considerato il padre della chimica moderna: fra i suoi meriti vi sono, oltre alla citata legge di conservazione, il metodo di lavoro (con attenzione alla purezza dei reagenti, e l'uso della bilancia di precisione), l'opera di nomenclatura di composti binari, la corretta determinazione della composizione dell'aria, l'analisi sulla composizione di grassi, oli e zuccheri, scoprendo la costante presenza di idrogeno, ossigeno e carbonio (i "mattoncini" di base di tutte le sostanze organiche).
Inoltre, fino a quel momento, la chimica non possedeva uno status accademico autonomo, ma faceva parte ancora del piano di studi della medicina.[1]
La chimica organica
[modifica | modifica wikitesto]Nel 1828 Friedrich Wöhler sintetizzò accidentalmente dell'urea partendo da sostanze inorganiche.

Questo fatto fece comprendere che il mondo della chimica organica e della chimica inorganica avevano delle basi in comune; inoltre aprì degli accesi dibattiti sul vitalismo, teoria che sosteneva una netta demarcazione tra il mondo della vita (organico) e l'inorganico.
Lo sviluppo della chimica organica compiuto nei secoli successivi, permise di sintetizzare, partendo da molecole più piccole, innumerevoli sostanze di uso comune, dai coloranti ai medicinali.
Proprio in questi anni, nel 1845, a Londra fu fondato il Royal College of Chemistry e un grande salto di qualità nella formazione e nel mestiere del chimico si ebbe in terra tedesca, grazie ai laboratori di Justus von Liebig, che divennero ben presto un modello per l'organizzazione e per la ricerca non solo della chimica, ma un po' di tutta la scienza in generale.
Nella prima settimana di settembre del 1860, a Karlsruhe si svolse il primo incontro internazionale di chimica (Congresso di Karlsruhe), al quale confluirono oltre 130 studiosi e ricercatori provenienti da tutta l'Europa, che ebbe il delicato compito di ridefinire i concetti basilari della chimica, una notazione e una nomenclatura comune, e di rivedere la suddivisione della chimica in tre branche particolari: la minerale, la vegetale e la animale.
Lo sviluppo industriale
[modifica | modifica wikitesto]
L'ultima parte del XIX secolo segna l'inizio dello sfruttamento industriale delle nuove conoscenze chimiche, con la sintesi industriale della soda, lo sviluppo di nuovi coloranti, dei primi polimeri sintetici, la petrolchimica e i farmaci di sintesi, detersivi, fertilizzanti. I grandi benefici apportati dallo sviluppo della chimica industriale sono evidenti sotto gli occhi di tutti, ma è utile ricordare che questo sviluppo ha avuto anche un costo: da un lato la creazione di armi distruttive utilizzate nelle due guerre mondiali e anche in seguito, dall'altro incidenti e scarsa sensibilità hanno causato in passato gravi incidenti ambientali e morti prima che si sviluppasse una sufficiente sensibilità ambientale.
La tavola periodica degli elementi
[modifica | modifica wikitesto]
Per molto tempo l'esistenza stessa degli elementi chimici fu oggetto di ricerca; la lista degli elementi si ampliava molto spesso, e i chimici stentavano a dare un senso teorico alle loro scoperte.
Fortunatamente i chimici Dmitrij Mendeleev e Julius Lothar Meyer ebbero un'intuizione, sistemando in una tabella gli elementi a seconda del loro peso atomico e del loro stato di ossidazione. Più correttamente oggi si sa che gli elementi sono disposti in ordine progressivo di numero atomico Z e non di peso atomico. Malgrado tale inesattezza, che coinvolge solo pochi elementi (quali Ar e K, Co e Ni, Te e I, Th e Pa) alcuni dei quali all'epoca non ancora scoperti, la tavola periodica permise a Mendeleev di predire l'esistenza di vari elementi allora sconosciuti (germanio, gallio, e scandio, che lui inizialmente nominò ekasilicon, ekaaluminium, ed ekaboron) nel 1870. In assenza di una coerente e condivisa teoria sulla struttura atomica, la comunità scientifica fu inizialmente scettica, ma in seguito le sue previsioni furono confermate.
La chimica moderna
[modifica | modifica wikitesto]
Prima del XX secolo la chimica era considerata una scienza con pochi punti in comune con la fisica.
Auguste Comte scriveva nel 1830:
- Ogni tentativo di utilizzare metodi matematici nello studio dei problemi chimici è da considerarsi profondamente irritante e contrario allo spirito della chimica....
L'atteggiamento cominciò a cambiare dopo la metà del XIX secolo quando Friedrich August Kekulé scriveva, nel 1867:
- Mi aspetto che un giorno si trovi una spiegazione matematica e meccanica di ciò che chiamiamo atomi...
In seguito alla scoperta della radioattività da parte di Marie e Pierre Curie gli scienziati cambiarono drasticamente il loro punto di vista. Gli atomi rivelarono una struttura complessa e non più indivisibile.
La teoria atomica
[modifica | modifica wikitesto]Nel XVIII secolo i chimici erano piuttosto favorevoli alla teoria atomica (ad esempio John Dalton) ma molto più cauti erano i fisici come ad esempio Wilhelm Ostwald, Ernst Mach e lo stesso Max Planck. Gli atomi potevano essere contati ma nessuno li aveva mai visti! I fautori della teoria come Amedeo Avogadro, Stanislao Cannizzaro, Svante Arrhenius e Ludwig Boltzmann fecero, grazie ad essa, numerosi passi in avanti come ad esempio la spiegazione dei comportamenti dei gas o degli acidi e basi in soluzione o la determinazione dei pesi atomici degli elementi. Ciononostante, la lunga disputa ebbe fine solamente nel primo decennio del XX secolo quando Jean Perrin fece una lunga serie di esperimenti, basati anche sulla teoria che Albert Einstein aveva formulato per spiegare il moto browniano, la quale era appunto fondata sulla teoria atomica; Perrin dimostrò in maniera inoppugnabile l'esistenza degli atomi.
«La Natura dispiega lo stesso splendore senza limiti nell'atomo come nella nebulosa, ed ogni nuovo mezzo di conoscenza la mostra più vasta e diversa, più feconda più imprevista, più bella, più ricca d'insondabile immensità.»
I primi modelli atomici degni di nota sono quello a "panettone" di Joseph John Thomson (1904) e quello a "planetario" di Ernest Rutherford (1911), ma, contemporaneamente alle deduzioni di Perrin, la svolta si ebbe con la teoria di Niels Bohr sulla struttura atomica nel 1912. Bohr spiegò la disposizione delle linee spettrali dell'atomo di idrogeno introducendo una "quantizzazione".
Finalmente lo studio della chimica non coinvolgeva più solo osservanzioni empiriche sui comportamenti della materia, ma anche aspetti collegati alla nuvola elettronica che avvolge il nucleo atomico. Si delineava un modo coerente per spiegare la natura del legame chimico e la disposizione degli elementi nella tavola periodica: in poche parole aveva inizio la convergenza tra fisica e chimica sollecitata da Kekulé.
| Evoluzione dei modelli atomici | ||

|
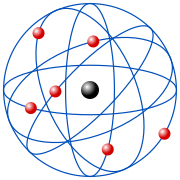 |
 |
| Modello atomico di Thomson | Modello atomico di Rutherford | Modello atomico di Bohr |
Il modello di Bohr ottenne degli eccellenti risultati teorici per l'atomo di idrogeno, ma solo con la meccanica quantistica fu possibile formulare teorie e modelli applicabili ad atomi più complessi.
Chimica quantistica
[modifica | modifica wikitesto]La nascita della meccanica quantistica è una pietra miliare per la fisica e per la chimica. La fisica quantistica era di difficile comprensione per i fisici stessi, e ancora dello scetticismo aleggiava intorno alle sue applicazioni nella chimica, ma la storia diede torto agli increduli. Dopo la formulazione dell'equazione di Schrödinger (1926) si ottennero enormi progressi nell'analisi della struttura degli atomi, molecole e del legame chimico in termini fisici. Nel 1927 Walter Heitler e Fritz London scrissero un articolo in cui si utilizzava per la prima volta la meccanica quantistica per descrivere la molecola di H2: era la nascita della chimica quantistica. Negli anni seguenti molti altri studiosi contribuirono ai progressi; per citarne alcuni: Robert S. Mulliken, Max Born, Robert Oppenheimer, Linus Pauling, Erich Hückel, Douglas Hartree, Vladimir Aleksandrovich Fock. Ecco una breve cronologia dei principali sviluppi:
- 1924 - Louis de Broglie sostiene che una particella in movimento possiede doppia natura corpuscolo-ondulatoria.
- 1925 - principio di esclusione di Pauli.
- 1926 - equazione di Schrödinger e approssimazione di Born-Oppenheimer.
- 1927 - Walter Heitler e Fritz London: analisi quantistica del legame di valenza e della molecola di idrogeno.[2]
- 1927-29 - Friedrich Hund e Robert S. Mulliken descrivono gli orbitali molecolari.
- 1928 - Linus Pauling descrive l'ibridazione degli orbitali di legame.
- 1932 - Henry Eyring e Michael Polanyi analizzano il sistema H2+H.
Prima della metà del XX secolo si era completata l'integrazione fra chimica e fisica, le maggiori proprietà chimiche potevano essere spiegate in termini di struttura atomica.
Linus Pauling nel suo libro La natura del legame chimico, pubblicato nel 1937 e considerato una pietra miliare nella storia della chimica, utilizzò i principi della meccanica quantistica per dedurre angoli di legame ed altre proprietà molecolari di strutture atomiche complesse.
Biologia molecolare e biochimica
[modifica | modifica wikitesto]
Nonostante i principi dedotti dalla meccanica quantistica avessero permesso di formulare nuove teorie e comprendere alcuni principi chimici fondamentali, per le molecole di grandi dimensioni caratteristiche della biochimica (enzimi, ormoni, vitamine, proteine) vi erano molte osservazioni empiriche senza una spiegazione teorica.
Uno dei problemi più dibattuti era la struttura del DNA, una macromolecola che si sapeva nascondere il "segreto della vita", ma la cui struttura era un busillis. Grazie agli sviluppi della chimica organica fisica e dei metodi analitici (come ad esempio la spettroscopia e la cristallografia a raggi X), nel 1953 viene finalmente decifrata la struttura a doppia elica del DNA da Francis Crick e James Watson (peraltro ispirati da ipotesi di Erwin Schrödinger e Linus Pauling e dalle immagini ai raggi X di Rosalind Elsie Franklin). Ecco una breve cronologia dei principali progressi in biochimica di quegli anni:
- 1937 - Hans Adolf Krebs descrive il ciclo di Krebs
- 1950 - Chargaff determina nel DNA il rapporto 1:1 fra adenina e timina, e fra guanina e citosina (regole di Chargaff).
- 1953 - Watson e Crick propongono la struttura a doppia elica del DNA
- 1953 - Esperimento di Miller-Urey - Stanley Miller e Harold Clayton Urey ipotizzano e simulano una evoluzione chimica come base dell'origine della vita.
- 1955 - Sanger determina la sequenza dell'insulina
- 1956-60 - Perutz determina la struttura tridimensionale dell'emoglobina
- 1957 - Ingram individua la causa molecolare dell'anemia falciforme
- 1958-60 - Kendrew determina la struttura tridimensionale della mioglobina
- 1961 - Braunitzer determina la sequenza dell'emoglobina
- 1983 - Mullis inventa la metodica nota come PCR
I polimeri e le macromolecole
[modifica | modifica wikitesto]
I polimeri sono grossi aggregati molecolari costituiti dalla ripetizione sistematica di più unità monomere, mentre la nomenclatura IUPAC attuale utilizza il termine "macromolecola" per indicare singole molecole di grandi dimensioni.
Nel 1839 Charles Goodyear scoprì il processo di vulcanizzazione della gomma, sfruttato per aumentarne le proprietà meccaniche e la resistenza agli agenti chimici. Il primo polimero sintetico ad essere stato prodotto industrialmente fu la parkesina, sviluppata da Alexander Parkes nel 1856 e prodotta per la prima volta su scala industriale nel 1866. Nel 1963 Giulio Natta e Karl Ziegler vincono il premio Nobel per la chimica grazie alla realizzazione della classe di catalizzatori noti come catalizzatori di Ziegler-Natta, che introdussero la possibilità di sintetizzare industrialmente polimeri stereospecifici (il primo fu il polipropilene isotattico).
- 1839 - Charles Goodyear scopre il processo di vulcanizzazione della gomma.
- 1846 - Christian Schönbein scopre casualmente la nitrocellulosa, che verrà prodotta industrialmente solo nel 1891 a causa delle problematiche legate alla sua esplosività.
- 1856 - Alexander Parkes crea la parkesina, primo polimero sintetico che sarà prodotto su scala industriale.
- 1883 - La viscosa, prima fibra tessile semisintetica, viene inventata da Hilaire de Chardonnet.
- 1907 - Leo Baekeland produce la bachelite.
- 1926 - Lo statunitense Waldo Semon, presso la B.F. Goodrich, mette a punto un metodo di sintesi su larga scala del PVC consentendo il vasto utilizzo di questo polimero.
- 1929 - Il chimici tedeschi della IG Farben Walter Bock e Eduard Tschunkur sintetizzano la gomma Buna-S.
- 1933 - Sintesi industriale del polietilene.
- 1935 - Prodotto il nylon 6,6, primo fibra tessile totalmente sintetica.
- 1954 - Giulio Natta sintetizza il polipropilene isotattico.
Le nuove frontiere della chimica
[modifica | modifica wikitesto]Chimica supramolecolare
[modifica | modifica wikitesto]
La chimica supramolecolare è una branca interdisciplinare, organizzatasi sistematicamente e razionalmente verso la fine degli anni sessanta, che riprendendo princìpi e concetti della chimica moderna rappresenta oggigiorno un campo di ricerca in forte espansione.
La linea di indagine che sfociò nella nuova disciplina della chimica supramolecolare ebbe un'origine perfettamente classica, affondando le sue radici nella chimica organica. Charles Pedersen, chimico della Du Pont, nel 1967 annunciò che dei poliesteri macrociclici da lui sintetizzati avevano la curiosa caratteristica di potersi complessare con ioni sodio e potassio, una proprietà dovuta alla loro non meno curiosa forma a corona. Il valore conoscitivo di questa scoperta venne subito reso più intenso dall'entrata nel nuovo campo del francese Jean-Marie Lehn, un chimico organico fisico che allora era interessato principalmente ai meccanismi di trasporto degli ioni alcalini connessi con i segnali trasmessi nel sistema nervoso. Le ricerche del gruppo di Lehn iniziarono subito, nel 1967, e con la sintesi di nuove strutture tridimensionali già nel 1969 ottenevano il sequestro degli ioni con la formazione di criptati. Un secondo gruppo, diretto da Donald Cram, ebbe una falsa partenza, utilizzando i composti di Pedersen come varianti nelle loro consuete ricerche di chimica organica fisica, ma nel 1973 cominciò a pubblicare un fiume di lavori su ciò che fu battezzata la chimica ospite/ospitante.
Lehn nutrì fin dall'inizio l'intenzione di comprendere meglio gli eventi fisiologici costruendo molecole modello che presentassero le stesse caratteristiche dei sistemi naturali, ma nella seconda metà degli anni '70 lo scienziato francese estese le ricerche sperimentali e le interpretazioni teoriche fino a creare, e a definire, l'ambito della chimica supramolecolare come quello in cui sono studiati e (ri)prodotti i processi mediante i quali entità di complessità maggiore risultano da molecole meno complesse a causa dall'azione di forze intermolecolari. Si schiudeva anche da questo punto di vista classico tutto l'orizzonte dell'auto-organizzazione molecolare, con almeno due finalità ben visibili: la mimesi di sistemi biologici (viventi, se interviene l'autocatalisi) e la costruzione di vere macchine molecolari, adatte, ad esempio, al calcolo digitale. Fra le linee di ricerca più attive vi sono: il riconoscimento molecolare; nel campo dell'auto-replicazione quella di oligonucleotidi e di micelle; nel settore dell'auto-organizzazione, l'ottenimento di mesofasi tubulari, recettori fotosensibili, interruttori.
Lehn, parafrasando Richard Feynman e il suo noto discorso There's plenty of room at the bottom[3] sulle nanotecnologie (con l'espressione There's even more room at the top[4]) indicò come la chimica non solo deve guardare verso l'estremamente piccolo, ma può andare anche al di sopra delle dimensioni molecolari, studiando la complessità supramolecolare.
Davanti al pubblico mondiale dei chimici, nel Congresso della IUPAC di Tokyo, Lehn propose il termine con cui correntemente designano la nuova disciplina: chimica supramolecolare.
Chimica combinatoria
[modifica | modifica wikitesto]Spesso il ricercatore si imbatte in un composto che dimostra una certa attività biologica, che però non è sufficiente per garantire il successo clinico (e commerciale) del composto. A questo punto inizia un processo di screening "quasi casuale": vengono preparati e testati tutti i possibili composti che mantengono una analogia strutturale per il nucleo fondamentale, ma ne differiscono per i sostituenti collegati.
Chimica computazionale
[modifica | modifica wikitesto]La chimica computazionale è la branca della chimica teorica che si occupa dello sviluppo di modelli matematici, basati sia sulla meccanica classica che sulla meccanica quantistica, in grado di simulare sistemi chimici, con lo scopo di calcolarne le grandezze fisiche caratteristiche e prevederne le proprietà chimiche.
Chimica nucleare
[modifica | modifica wikitesto]La chimica nucleare è un settore della chimica che tratta le reazioni che cambiano la natura del nucleo. Il fenomeno chimico-fisico studiato dalla chimica nucleare è la radioattività e la grandezza fisica corrispondente nel Sistema Internazionale è l'attività.
Caos chimico
[modifica | modifica wikitesto]
Per caos chimico si intende quell'insieme di reazioni chimiche dipendenti da fattori aleatori con apparenza caotica. Il resoconto di reazioni oscillanti fu pubblicato per la prima volta da Gustav Theodor Fechner nel 1828. Nel 1833 John Herschel, noto astronomo e inventore della cianotipia, scoprì una serie di reazioni periodiche legate al dissolvimento del ferro in acido nitrico a diversi valori di concentrazione. Le reazioni oscillanti si incontrano spesso in elettrochimica, come riportato da Christian Friedrich Schönbein nel 1842 e James Prescott Joule nel 1844.
Seguirono sul piano sperimentale descrizioni di reazioni apparentemente caotiche, e la loro interpretazione sulla base di processi autocatalitici, ma solo con la reazione di Belousov-Zhabotinsky l'auto-organizzazione nel tempo e nello spazio di particolari sistemi reagenti divenne un tema accettato di ricerca.
Il chimico sovietico Boris Belousov scoprì la reazione che porta il suo nome mentre cercava di riprodurre in provetta un insieme di reazioni che avesse qualche analogia con il ciclo di Krebs. La storia dettagliata dei tentativi di Belousov, sempre frustrati, di pubblicare i suoi risultati (dal 1951 al 1957) entrerà a far parte della leggenda (negativa) della chimica; maggiore fortuna ebbe il biofisico Anatol Zhabotinsky che rese nota la reazione nel 1964. Nel frattempo (1952) Alan Turing aveva pubblicato un articolo seminale dal titolo estremamente significativo: La base chimica della morfogenesi, in cui discuteva in dettaglio gli effetti di meccanismi autocatalitici; inoltre, su un piano più generale, diversi gruppi di ricercatori, fra cui spiccava quello diretto da Ilya Prigogine, avevano fatto progredire la termodinamica dei processi irreversibili (gli unici esistenti nella realtà fisica). Nel 1967 Prigogine e Nicolis proposero il concetto di struttura dissipativa, e avendo dimostrato la relazione fra organizzazione e dissipazione ne sottolinearono la possibile rilevanza rispetto ai "primi passi biogenetici".
Attualmente la chimica che studia l'origine dell'ordine a partire dal caos molecolare è un campo attivissimo di ricerca. Nel 1990 i principali temi trattati sulle dinamiche non lineari riguardavano: propagazione di onde e strutture spaziali; oscillazioni in sistemi eterogenei; oscillazioni biologiche; patterns geochimici; proposta e discussione di sistemi modello. Questo semplice elenco dimostra la pervasività interdisciplinare delle procedure conoscitive della chimica.
Note
[modifica | modifica wikitesto]- ^ Antonio Di Meo, Storia della chimica, Newton, 1997, Roma, pag.26-28
- ^ W. Heitler and F. London, Wechselwirkung neutraler Atome und Homöopolare Bindung nach der Quantenmechanik, Z. Physik, 44, 455 (1927)
- ^ Trad. "C'è moltissimo spazio in basso" - dove il termine "in basso" è inteso come il mondo al di sotto delle dimensioni molecolari
- ^ Trad. "C'è ancora più spazio in alto" - dove il termine "in alto" è inteso come il mondo al di sopra delle dimensioni molecolari
Bibliografia
[modifica | modifica wikitesto]- Antonio Di Meo, Luciano Caglioti, Storia della chimica: dalla ceramica del neolitico all'età della plastica, 2ª ed., Marsilio, 1990, ISBN 88-317-5274-X.
- Antoine-Laurent Lavoisier e Pierre-Simon de La Place, Memoria sul calore, a cura di Antonio Di Meo, Roma, Edizioni Teknos, 1995.
- Dmitrij Ivanovič Mendeleev, Il sistema periodico degli elementi, a cura di Silvano Tagliagambe, Roma, Edizioni Teknos, 1994.
- Stanislao Cannizzaro, La teoria atomica e molecolare, a cura di Antonio Di Meo, Roma, Edizioni Teknos, 1994.
- (EN) Ernst von Meyer, George McGowan, A history of chemistry from earliest times to the present day: being also an introduction to the study of the science, Macmillan and Co., 1891.
- (EN) James Riddick Partington, A short history of chemistry, 3ª ed., Dover Publications, 1989, ISBN 0-486-65977-1.
- (EN) Henry Marshall Leicester, The historical background of chemistry, Courier Dover Publications, 1971, ISBN 0-486-61053-5.
- (EN) Aaron John Ihde, The development of modern chemistry, Courier Dover Publications, 1984, ISBN 0-486-64235-6.
- (EN) William Hodson Brock, The chemical tree: a history of chemistry, Norton, 2000, ISBN 0-393-32068-5.
- Isaac Asimov, Breve storia della chimica- introduzione alle idee della chimica. Zanichelli 1968, ISBN 978-88-08-04064-0.
- Approfondimenti
- (FR) Marcellin Berthelot, La Révolution chimique, Paris, Alcan, 1890.
Voci correlate
[modifica | modifica wikitesto]- Chimici notevoli
- Mikhail Lomonosov, 1711-1765
- Joseph Black, 1728-1799
- Joseph Priestley, 1733-1804
- Carl Wilhelm Scheele, 1742-1786
- Antoine-Laurent de Lavoisier, 1743–1794
- Alessandro Volta, 1745-1827
- Jacques Charles, 1746-1823
- Claude Louis Berthollet, 1748-1822
- Joseph-Louis Gay-Lussac, 1778-1850
- Humphry Davy, 1778-1829
- Jöns Jakob Berzelius, 1779-1848
- Michael Faraday, 1791-1867
- Friedrich Wöhler, 1800-1882
- Justus von Liebig, 1803-1873
- Louis Pasteur, 1822-1895
- Stanislao Cannizzaro, 1826-1910
- Friedrich August Kekulé von Stradonitz, 1829-1896
- Willard Gibbs, 1839-1903
- Jacobus Henricus van 't Hoff, 1852-1911
- Marie Curie, 1867-1934
- Victor Grignard, 1871-1935
- Ernest Rutherford, 1871–1937
- Gilbert Newton Lewis, 1875-1946
- Otto Hahn, 1879-1968
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su storia della chimica
Wikimedia Commons contiene immagini o altri file su storia della chimica
Collegamenti esterni
[modifica | modifica wikitesto]- Minerva: Appunti di storia della chimica, su minerva.unito.it. URL consultato il 30 novembre 2005 (archiviato dall'url originale il 7 luglio 2017).
- (EN) Testo completo di The Skeptical Chymist online [collegamento interrotto], su oldsite.library.upenn.edu.
- (EN) Carl Schorlemmer The rise and development of organic chemistry (London: MacMillan, 1894)
- (EN) Karl Hugo Bauer A history of chemistry. Translated by R.V. Stanford (London: E. Arnold,1907)
- (EN) Thomas Percy Hilditch A concise history of chemistry (London: Methuen, 1911)
- (EN) James Campbell Brown A history of chemistry from the earliest times. 2d ed. (London: J. & A. Churchill,1920)
- (EN) William Augustus Tilden Famous chemists, the men and their work (London: G. Routledge & Sons, ltd., 1921)
- (EN) Francis Preston Venable History of chemistry (Boston: D.C. Heath & Co, 1922)
- (EN) Scritti selezionati sulla storia della chimica, su web.lemoyne.edu.








